
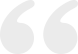
张静, 袁培, 雷荟仔, 等. 三阴性乳腺癌中程序性死亡配体抗体克隆22C3和SP142的表达分析及预后研究[J]. 中华肿瘤杂志, 2022, 44(3):260-267.
DOI: 10.3760/cma.j.cn112152-20200803-00704.
目的
探讨程序性死亡配体1(PD-L1)不同抗体克隆SP142和22C3在三阴性乳腺癌中的表达情况,分析不同抗体表达与患者临床病理特征及预后的关系。
方法
收集2010年8月至2013年12月于中国医学科学院肿瘤医院治疗的259例三阴性乳腺癌(TNBC)患者的临床病理资料,将患者手术组织样本切片进行SP142和22C3免疫组化染色,分别评估肿瘤细胞及肿瘤浸润免疫细胞PD-L1的表达情况,分析2种抗体表达与患者临床病理特征的关系,采用Cox比例风险回归模型分析PD-L1表达与无病生存时间(DFS)和总生存时间(OS)之间的相关性。
结果
SP142(免疫细胞表达评分≥1%)与22C3(联合阳性评分≥1分)在TNBC中的阳性表达率分别为42.1%(109/259)和41.3%(107/259),二者总符合率为82.3%,阳性表达病例的Kappa值为0.571,差异有统计学意义(P<0.001)。PD-L1抗体阳性患者的组织学级别和Ki-67增殖指数与阴性患者比较升高,阳性患者出现脉管侵犯的概率小(均P<0.05);PD-L1(SP142)阳性患者的复发或转移数(8例)低于阴性患者(27例,P=0.016)。SP142阳性表达患者DFS长于阴性患者(P=0.019);SP142阳性表达患者的OS长于阴性患者,但差异无统计学意义(P=0.116)。22C3阳性表达与患者DFS和OS均无关(均P>0.05)。
结论
PD-L1(22C3)和PD-L1(SP142)在TNBC中表达情况存在差异,临床检测中二者不可相互替代;PD-L1阳性表达患者预后更好,PD-L1(SP142)阳性患者DFS明显延长。
【关键词】乳腺肿瘤;三阴性乳腺癌;程序性死亡配体1; SP142抗体; 22C3抗体;预后
乳腺癌是女性最常见恶性肿瘤,其中三阴性乳腺癌(triple negative breast cancer, TNBC)恶性程度最高,由于激素受体及人表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2)均为阴性,而无法从内分泌治疗和HER-2分子靶向治疗中获益,术后辅助常规放疗和化疗仍易出现早期复发及转移,从而影响患者生存质量及长期预后。近年来,通过阻断程序性死亡受体1(programmed death-1, PD-1)/程序性死亡配体1(programmed death ligand-1, PD-L1)免疫抑制信号通路,激活人体自身免疫系统抵御肿瘤的免疫疗法在多种恶性肿瘤包括乳腺癌在内的实体肿瘤中均显示出良好的疗效。尽管TNBC中激素受体和HER-2表达为阴性,但较高的增殖活性及基因组不稳定性使其具有较高的免疫原性,从而TNBC成为最有可能从免疫治疗中获益的乳腺癌亚型。基于IMpassion130 Ⅲ期临床试验结果显示,PD-L1(22C3)或PD-L1(SP263)检测可以筛选出更多可能在免疫治疗中获益的人群,而PD-L1(SP142)阳性表达与阿替珠单抗联合白蛋白结合型紫杉醇治疗TNBC疗效更加相关。因此PD-L1(SP142)被美国食品药品监督管理局批准用于筛选免疫治疗人群的伴随诊断性检测。目前,关于PD-L1在TNBC中的表达情况暂无统一的检测抗体及阳性判读标准,PD-L1在TNBC中的预后指导意义尚存在争议。本研究中,我们回顾性分析了PD-L1不同克隆抗体22C3及SP142在TNBC中的表达情况,并分析其与患者临床病理特征及预后的关系,旨在为TNBC中PD-L1检测抗体的选择及预后评估价值提供一定的参考依据。


一、临床病理资料
1.临床资料:
收集我院2010年8月至2013年12月经手术后病理诊断为乳腺浸润性癌的患者(3871例)的临床病理资料,包括年龄、肿瘤组织学类型、肿瘤大小、淋巴结转移情况、是否有脉管侵犯、Ki-67增殖指数、手术方式、术后是否接受辅助放射治疗和具体辅助化疗方案。筛选标准:(1)术后病理结果示免疫组织化学(immunohistochemical, IHC)染色雌激素受体(estrogen receptor, ER)阴性、孕激素受体(progesterone receptor, PR)阴性和IHC染色或荧光原位杂交检测显示HER-2阴性;(2)术后均接受系统辅助化疗。排除标准:(1)术前已接受新辅助化疗和(或)放射治疗;(2)术前已发生转移;(3)术前已接受手术治疗,此次为复发的患者。共259例患者纳入本研究。
2.随访:
预后随访信息通过查阅患者门诊复查记录或通过电话随访获取。无病生存时间(disease-free survival, DFS)定义为患者手术日期到首次出现局部复发或者远处转移的时间,总生存时间(overall survival, OS)定义为患者手术日期到任何原因引起死亡的时间。随访截至2020年1月16日,随访9.3~113个月,中位随访时间为81.6个月,无失访患者。
二、研究方法
1.免疫组化:
收集259例TNBC患者术后石蜡包埋的肿瘤组织样本,切取4 μm厚的整张切片进行PD-L1(SP142)及PD-L1(22C3)全自动IHC染色,实验步骤严格依据检测试剂操作说明书进行。SP142为上海罗氏制药有限公司产品,稀释比例为1∶100,检测平台为Ventana Benchmark ULTRA;22C3为美国Dako公司产品,稀释比例1∶50,检测平台为DAKO Autostainer Link 48。
2.结果判读:
PD-L1(SP142)和PD-L1(22C3)IHC染色结果由2名高年资病理医师进行双盲判读,结果不一致的请第3名病理医师判读,阳性表达比取平均值。阳性表达定义为活肿瘤细胞任意强度的部分或完全膜染色,以及免疫细胞(包括淋巴细胞、巨噬细胞、树突状细胞及粒细胞等)细胞质或细胞膜染色,细胞质染色常表现为深棕色点状或线状染色,也可以呈现环周染色。参考文献[5]的方法,SP142抗体采用免疫细胞(immune cells, IC)阳性评分,IC判读方法为肿瘤区域内有任何强度PD-L1染色的IC所占肿瘤面积的百分比,阳性定义IC≥1%。22C3抗体采用联合阳性评分(combined positive score, CPS),CPS是指阳性活肿瘤细胞(任何强度的部分或完全膜染色)及阳性淋巴细胞、巨噬细胞(任何强度的细胞膜或细胞质染色)占所有活肿瘤细胞的百分比,结果采用0~100数值来表示(当计算结果超过100时,最终结果按照100来计算),CPS≥1分定义为22C3阳性。病理报告中ER、PR、HER-2、Ki-67的IHC染色结果均由高年资病理医师进行判读,ER和PR依据文献[6]进行判读,HER-2依据文献[7]进行判读,HER-2 IHC 2+的患者进行荧光原位杂交。
三、统计学方法
采用SPSS 25.0统计软件进行数据分析。计数资料采用χ2检验或Fisher精确检验,采用Cox比例风险回归模型进行单因素和多因素分析,生存分析采用Kaplan-Meier法和Log rank检验。所有检验均为双侧检验,检验水准α=0.05。


1.临床病理特征和预后:
259例TNBC患者年龄为28~76岁,中位年龄49岁,≤55岁者181例,>55岁者78例。乳腺浸润性癌,非特殊型253例(其中伴髓样癌特征5例,图1),乳腺浸润性小叶癌3例,乳腺化生性癌3例。组织学分级2级77例,3级182例。肿瘤直径为0.5~10.5 cm,≤2.0 cm者119例,2.1~5.0 cm者137例,>5.0 cm者3例。伴淋巴结转移100例,其中淋巴结转移数≤4枚63例,5~9枚18例,≥10枚19例。脉管侵犯34例;Ki-67指数>25%者189例。保乳手术45例,乳腺癌根治手术214例。术后辅助放疗98例,术后辅助化疗128例(化疗以蒽环类联合紫杉醇周期化疗为主)。出现局部复发和(或)远处转移35例,其中24例出现远处转移,转移部位最常见于骨(11例)、肺(9例)、肝(6例),其次为纵隔(5例)和脑(4例)。全组患者中,死亡28例,其中1例死因为直肠癌,其他27例死因均为乳腺癌。
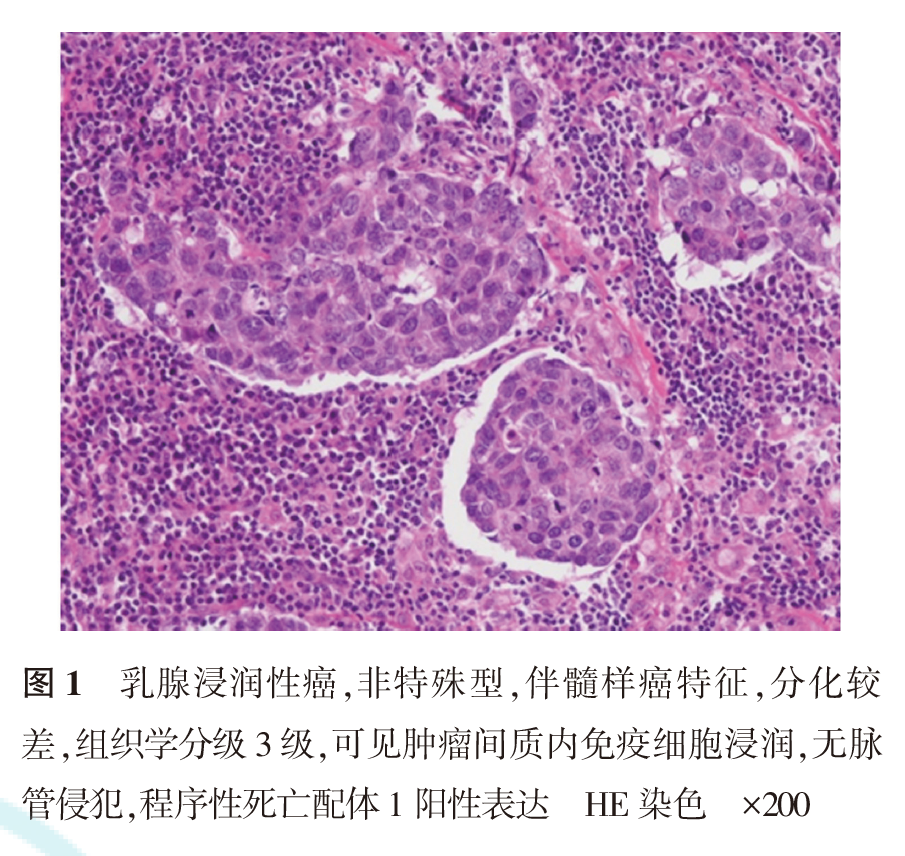
2.TNBC中PD-L1(SP142)与PD-L1(22C3)表达结果:
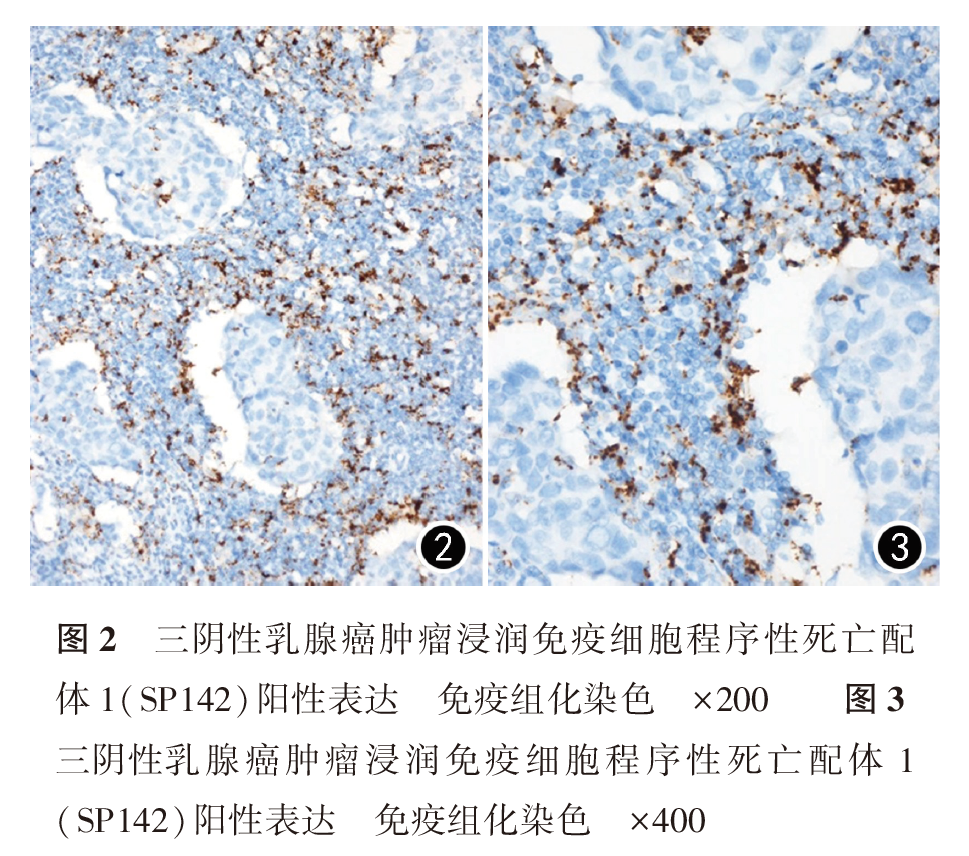
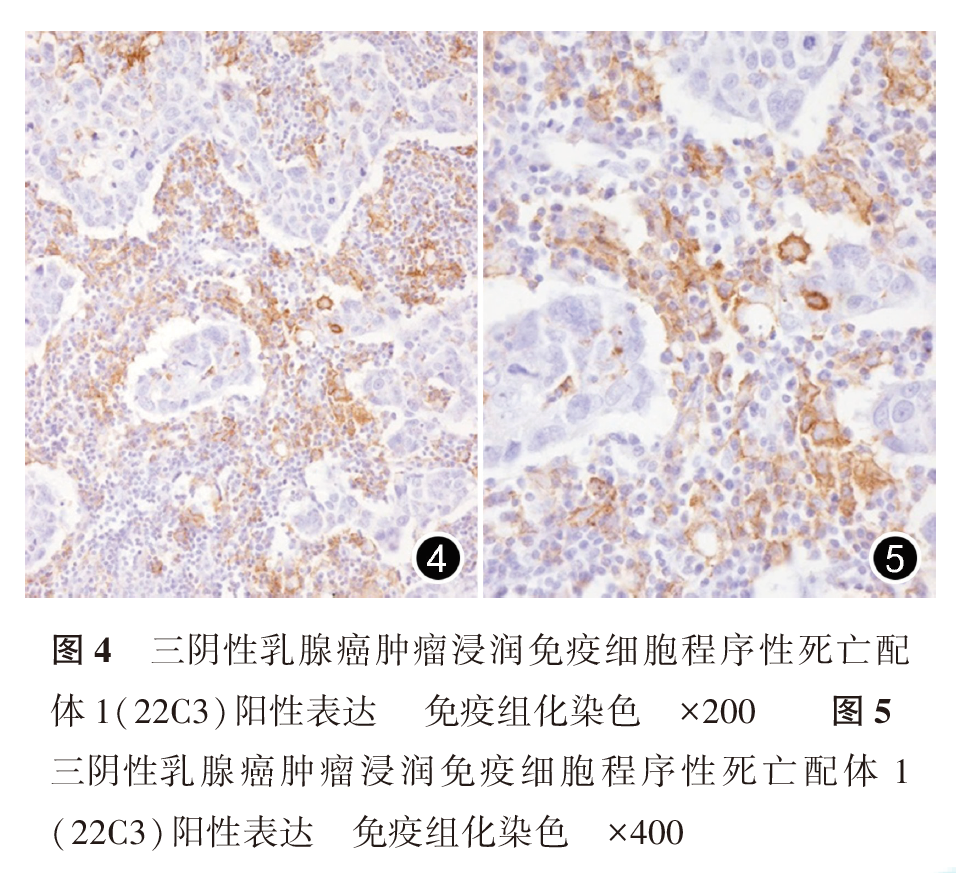
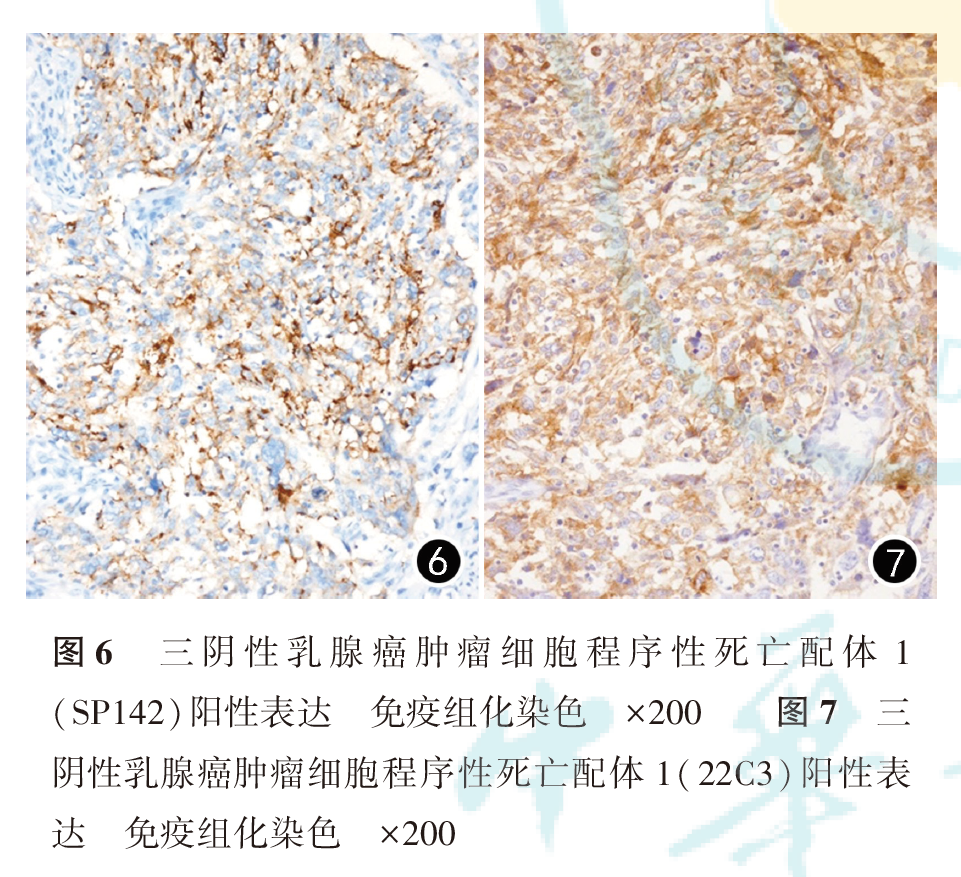
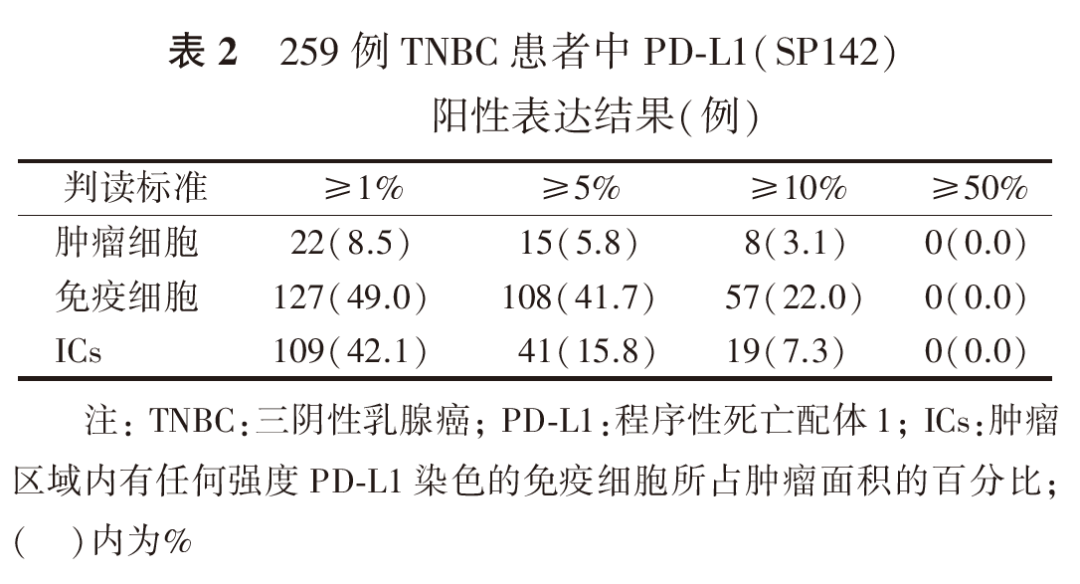
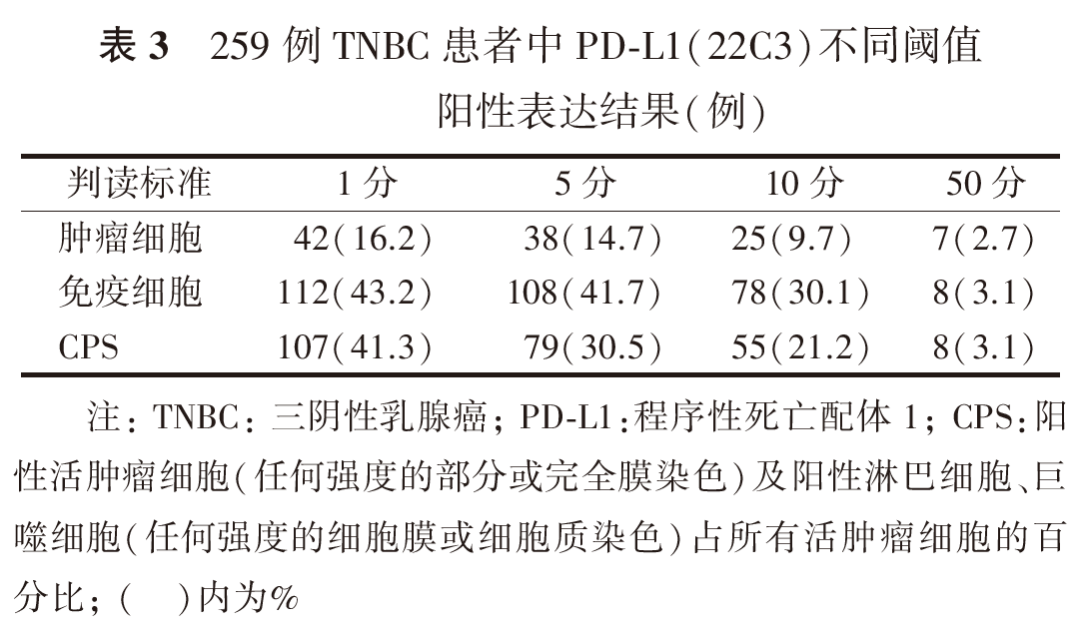
SP142抗体阳性主要呈细胞膜和或近膜区胞质内细小或粗大颗粒状着色,以中强阳性着色为主,阳性细胞较分散,也可呈聚集体着色(图2、图3)。22C3抗体阳性膜染色较均匀,以弱及中等强度着色为主,阳性细胞常呈片状分布(图4、图5)。SP142抗体依据ICs判读标准,阳性表达率为42.1%(109/259);22C3抗体依据CPS判读标准,阳性表达率为41.3%(107/259)。SP142与22C3的阳性符合率为74.3%,阴性符合率为82.7%,总符合率为82.3%,二者阳性表达病例Kappa值为0.571,SP142和22C3阳性表达差异有统计学意义(P<0.001,表1)。与22C3比较,SP142阳性细胞主要为肿瘤间质浸润IC(图2、图3),阳性率为49.0%,仅22例出现肿瘤细胞表达(图6),而16.2%的患者为肿瘤细胞阳性表达22C3(图7)。2种抗体均具有较高的表达异质性,22C3抗体CPS中仅8例病例阳性表达比例达到50%及以上,而SP142抗体IC判读标准中无一例表达超过50%(表2、表3)。

3.TNBC中PD-L1(SP142)与PD-L1(22C3)表达与临床病理特征的关系:
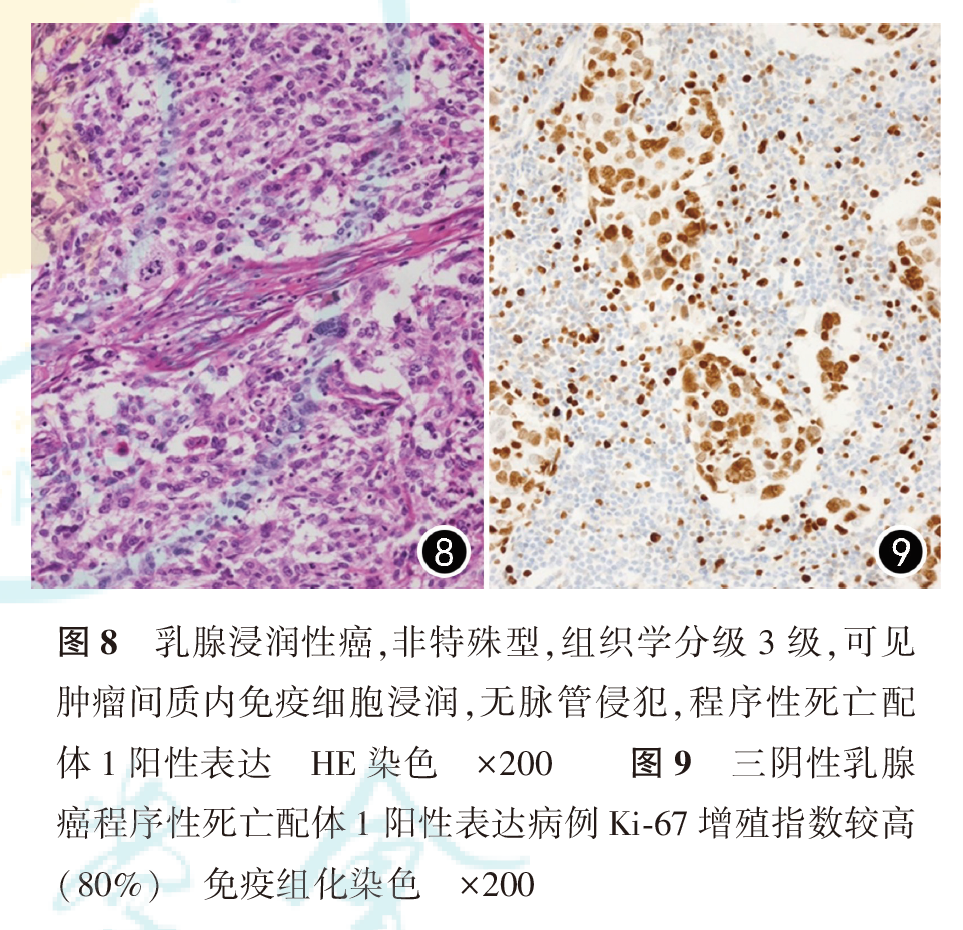
在TNBC中,PD-L1(SP142)阳性患者109例,阴性150例;PD-L1(22C3)阳性表达107例,阴性152例。PD-L1阳性表达患者较少出现脉管侵犯,组织学级别及Ki-67增殖指数(图8、图9)更高(均P<0.001)。SP142和22C3抗体的阳性表达与脉管侵犯、组织学分级及Ki-67增殖指数均有关(均P<0.05),与患者发病年龄、肿瘤大小及淋巴结转移无关(均P>0.05),PD-L1(SP142)阳性患者的复发或转移率低于阴性患者(P=0.016,表4)。
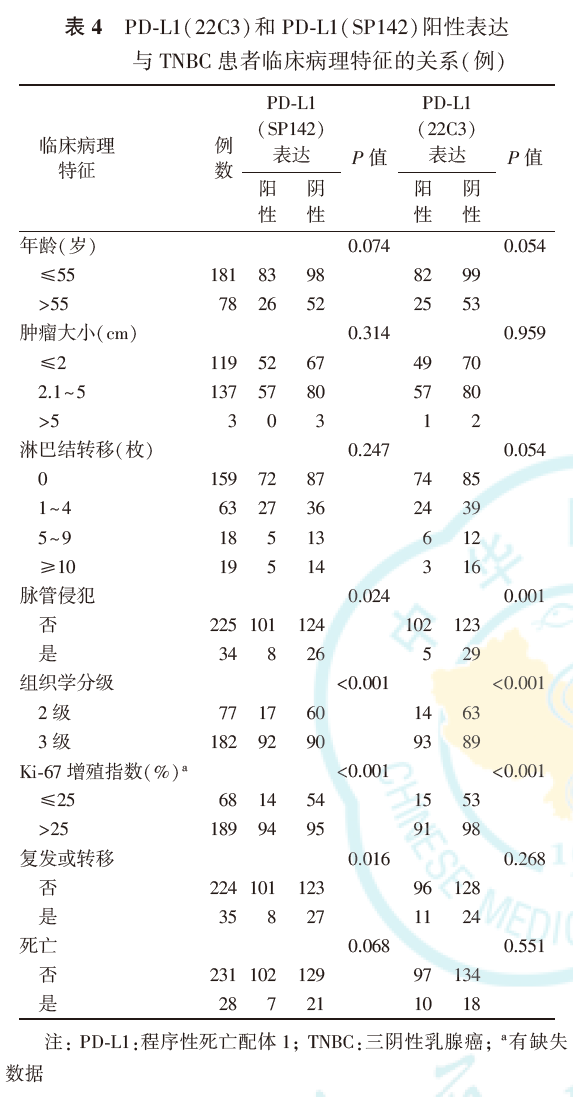
4.TNBC中PD-L1(SP142)与PD-L1(22C3)阳性表达与预后的关系:
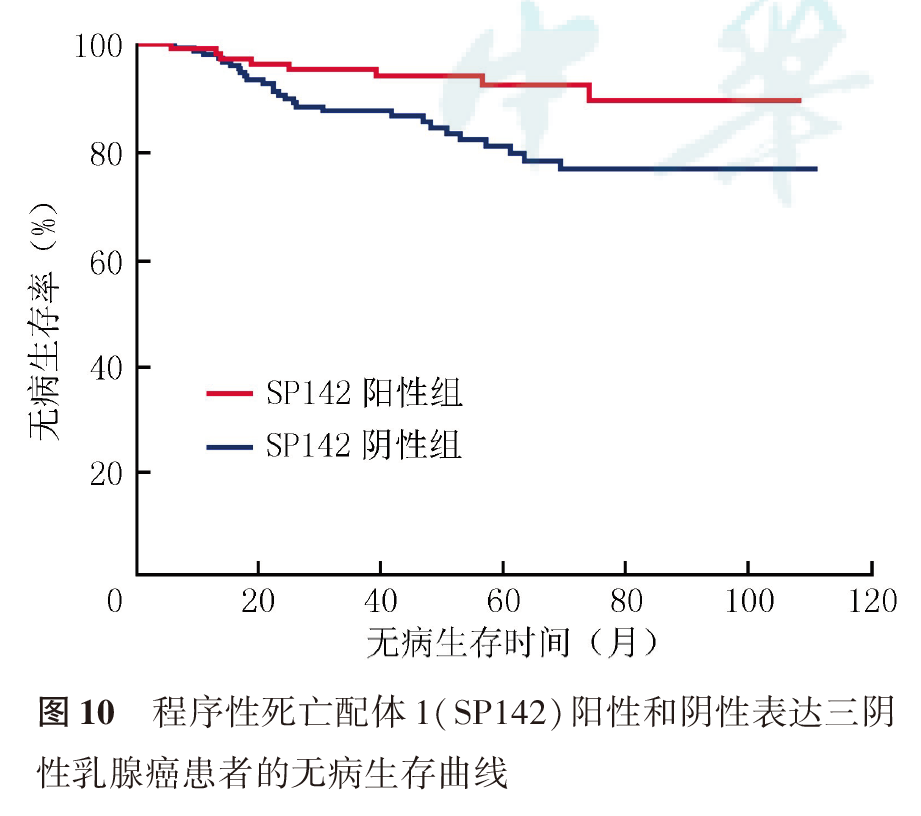
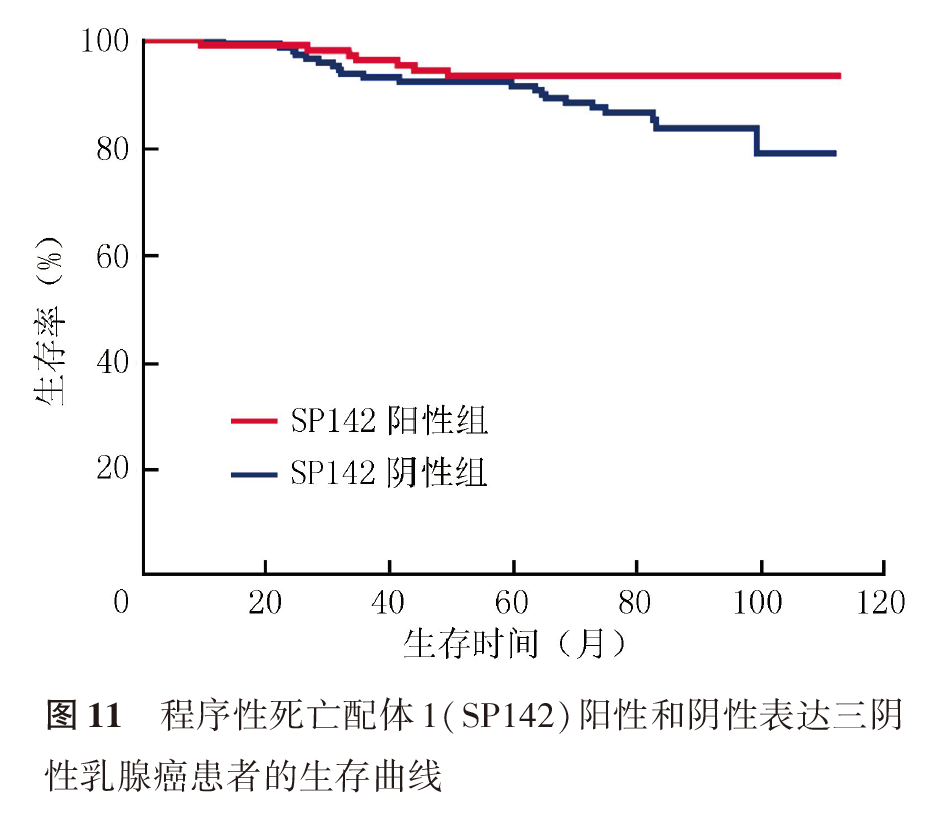
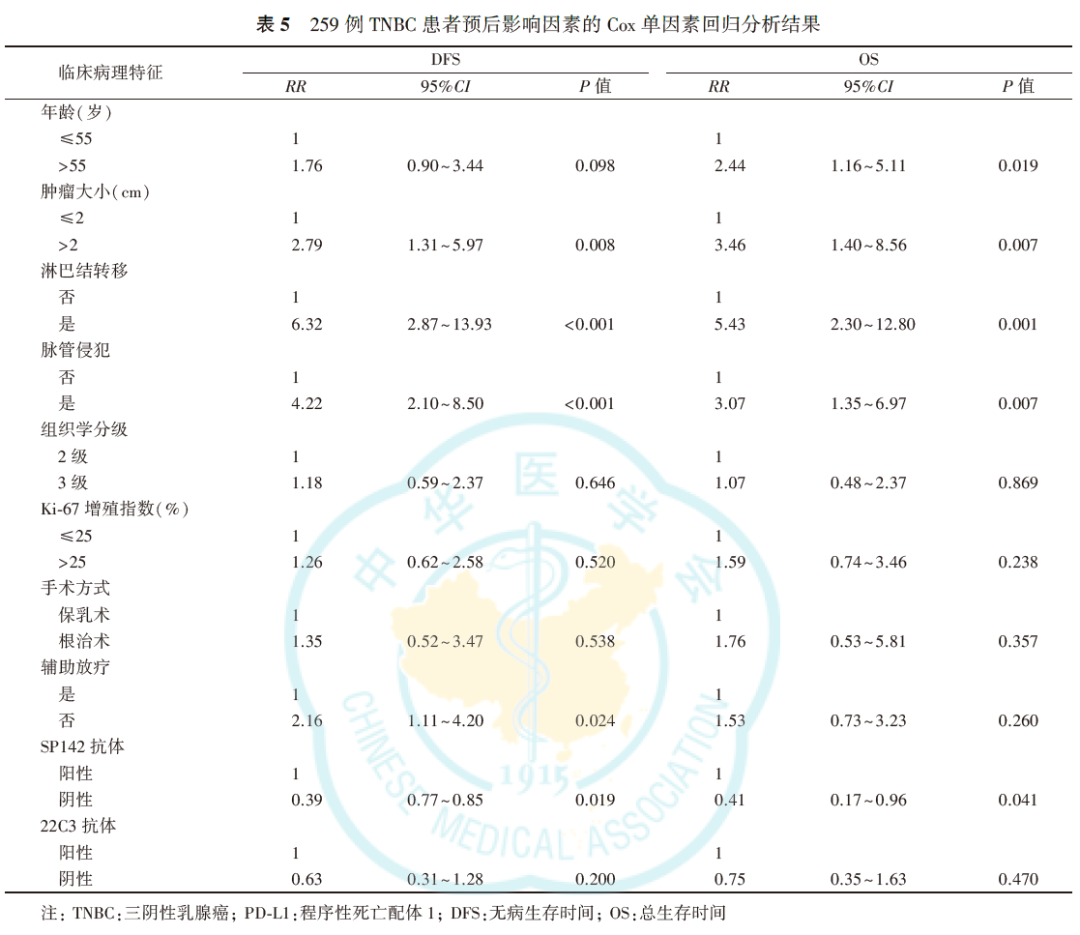
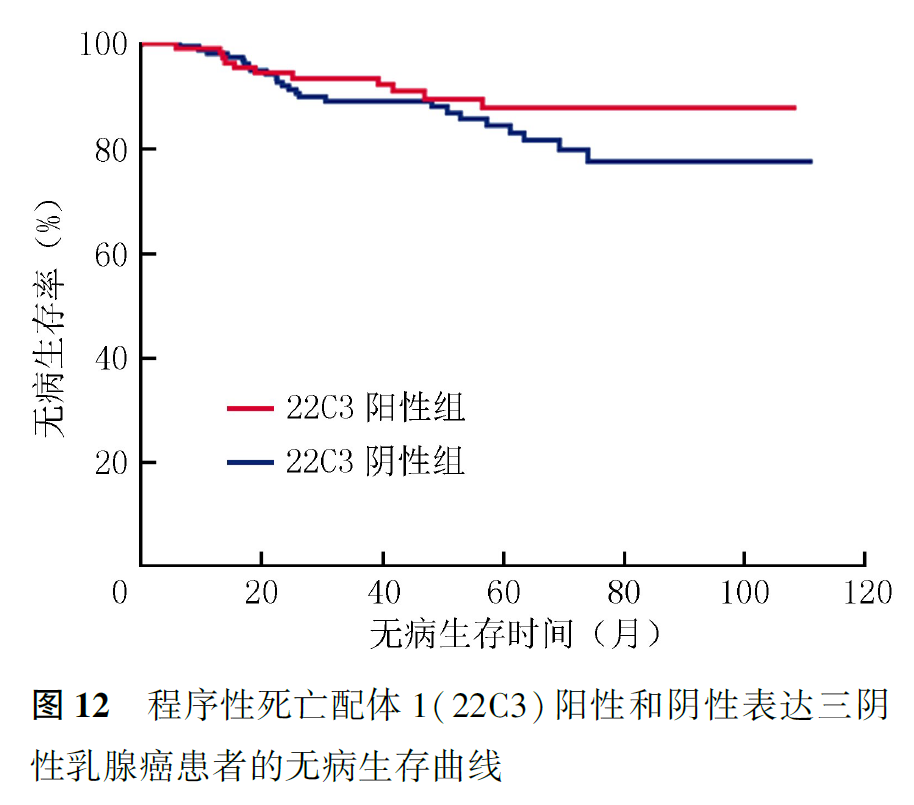
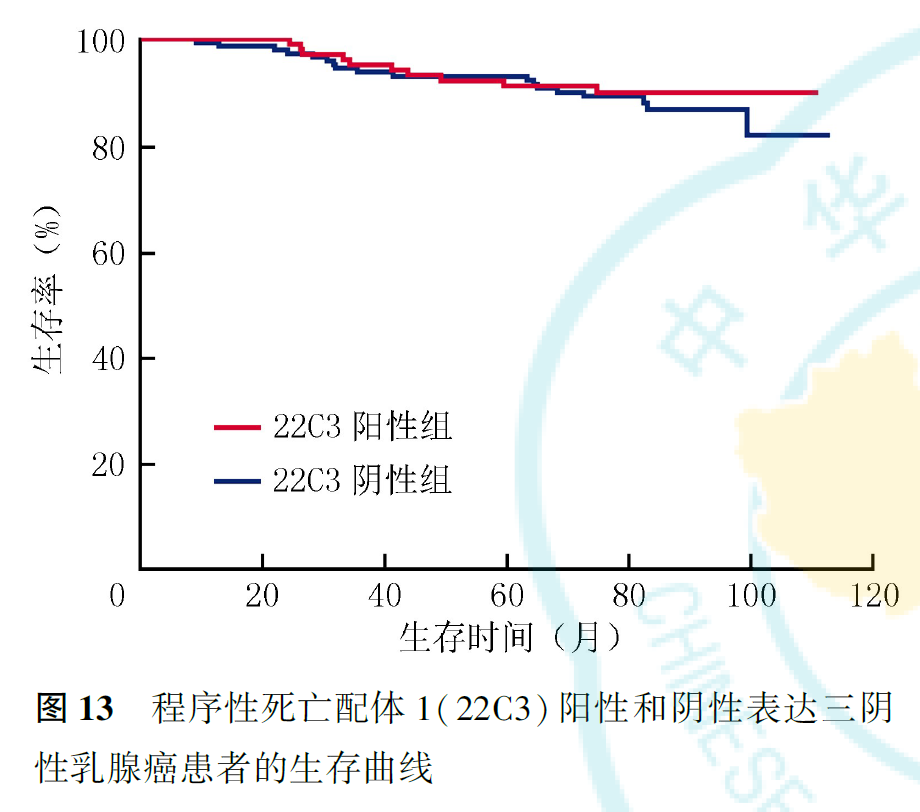
SP142阳性患者DFS更长(未到达中位DFS, P=0.015,图10),SP142阳性表达提示患者具有较长的OS(未到达中位OS,P=0.035,图11)。肿瘤大小、淋巴结转移、脉管侵犯和SP142阳性表达与DFS有关,SP142阳性表达与患者复发或转移有关(均P<0.05,表4、表5)。22C3阳性表达提示患者DFS和OS更长,但差异均无统计学意义(均P>0.05;表5、表6,图12、图13)。



既往关于TNBC PD-L1表达情况的相关研究中,检测标本类型(组织芯片、活检标本、手术标本)、检测抗体种类(22C3、SP142、SP263,28-8、E1L3N、B7H1)、检测平台以及判读标准均不同,同时TNBC本身具有高度异质性,因此关于TNBC中PD-L1表达情况及其与预后相关性的结论存在很大争议,目前尚无明确定论。本研究中,我们对手术切除标本选择不同抗体克隆进行PD-L1 IHC染色,评估不同克隆类型PD-L1在TNBC中的表达情况,并分析其与临床病理特征及预后的相关性,为今后乳腺癌PD-L1规范化检测及预后评估提供参考依据。
一项包含37例乳腺癌PD-L1表达情况及其与预后相关性研究的系统回顾分析结果显示,在不同分子分型乳腺癌中,PD-L1阳性率为0~83%,TNBC较其他分子亚型乳腺癌PD-L1阳性率更高(Luminal A型为2.3%~37.0%,Luminal B型为6%~46%,HER-2过表达型为0~49%,TNBC为8.3%~83%)。IMpassion130 Ⅲ期临床试验研究中,以ICs≥1%为阳性阈值,研究结果显示,902例TNBC患者中,41%的患者PD-L1(SP142)表达为阳性,ICs表达比例>5%的病例占14%,而全组患者中仅有9%(81/902)的患者出现肿瘤细胞阳性表达。本研究中,若分别以ICs≥1%和≥5%为界值,SP142阳性率分别为42.1%和15.8%,仅有8.5%(22/259)的患者出现肿瘤细胞阳性表达,与IMpssion130研究结果相似。PD-L1弥漫性着色(≥50%)非常罕见,本研究中,22C3阳性表达CPS≥50分的患者仅为3.1%(8/259),SP142阳性表达ICs≥50%,0例阳性表达超过50%,基于PD-L1在乳腺癌的表达存在明显的异质性,使用组织芯片或粗针穿刺活检标本检测的PD-L1表达结果可能存在误差,乳腺癌中,增加检测样本量可提高PD-L1检测的准确性,从而获得更真实的PD-L1表达情况评估。本研究结果与以往研究结果一致,不同PD-L1抗体克隆类型表达具有一定差异,本研究中,22C3与SP142表达总符合率为82.3%,二者表达有一定相关性及可比性,但二者表达Kappa值为0.571,仅为中等的一致性水平,因此,在临床检测中二者不可相互替代。相关研究对比了TNBC中PD-L1(SP142)及PD-L1(22C3)的表达情况,也得到了相似结论。
PD-L1是PD-1的主要配体,广泛表达于IC及多种包括乳腺癌在内的实体TC中,TC表达的PD-L1与肿瘤杀伤T细胞表面的PD-1相结合,引起下游蛋白激酶去磷酸化,从而抑制T细胞的增殖与活化,同时抑制多种炎性因子的释放,最终导致肿瘤免疫逃逸。从作用机制上看,肿瘤内PD-L1的表达反映患者肿瘤免疫抑制状态,因此PD-L1阳性肿瘤患者预后较差。有研究表明,PD-L1阳性表达与乳腺癌不良预后的临床病理特征(组织学高级别、较晚分期和ER阴性等)有关,提示预后不良。1项包含4181例乳腺癌的系统回顾及荟萃分析显示,乳腺癌TC PD-L1蛋白的表达与更短的预后有关,但PD-L1基因的表达却提示患者具有更长的生存期,PD-L1基因的表达可能来源肿瘤浸润IC。PD-L1阳性表达的乳腺癌与阴性表达的乳腺癌相比,存在较高比例的肿瘤浸润淋巴细胞(分别为89%和24%)和活化的外周血淋巴细胞(分别为100%和41%),这在一定程度上说明了PD-L1阳性表达的乳腺癌处于免疫活化状态,也部分解释了PD-L1阳性表达作为提示患者预后良好的机制。目前,越来越多的临床研究表明,在TNBC中,PD-L1阳性表达提示患者预后更好,这与本研究的结果一致。对比SP142和22C3,二者阳性表达均更多见于高组织学级别及高增殖活性的肿瘤中,而高组织学级别及高增殖活性肿瘤会暴露更多的肿瘤相关抗原,从而激发机体产生更多的淋巴细胞浸润,引起机体更强的抗肿瘤免疫反应,因此这部分患者预后相对更好;同时二者阳性表达更多见于无脉管侵犯的病例中,我们推测,PD-L1阳性表达患者免疫微环境中可能存在抑制肿瘤微环境脉管系统增长的调节因子分泌,从而抑制肿瘤营养血管生长,并抑制肿瘤通过侵犯脉管系统而发生转移,因此SP142阳性表达也与肿瘤不易复发或转移有关,这使得患者有更好的临床预后。这些推测仍需要更加深入的研究进行进一步证实。
综上所述,PD-L1(22C3)与PD-L1(SP142)在TNBC中的表达存在明显的异质性,增加检测样本量可以提高PD-L1检测的准确性;22C3与SP142抗体在TNBC中的表达情况有一定相关性,但二者阳性病例存在统计学差异,临床检测中二者不可相互替代;在TNBC预后评估中,SP142与22C3抗体相比有更高的预后提示价值,PD-L1(SP142)阳性表达TNBC患者的DFS明显延长,且提示患者有较长的OS。
免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate











 苏公网安备32059002004080号
苏公网安备32059002004080号


