

2023年4月,广医一院何建行/梁文华教授团队针对非小细胞肺癌新辅助免疫治疗后淋巴结评估问题,于Experimental Hematology & Oncology(IF:8.593)期刊发表题为“Major Pathologic response” in Lymph nodes: A Modified Nodal Classification for Non-Small Cell Lung Cancer Patients Treated with Neoadjuvant Immunochemotherapy的论文文章,该研究明确了淋巴结主要病理缓解(MPR)的定义,并提出转移淋巴结MPR为新辅助免疫联合化疗术后更优的生存预测指标。广州医科大学附属第一医院、广州呼吸健康研究院何建行教授、梁文华教授为该研究通讯作者,在读博士邓宏生为第一作者。

主要发现
1、淋巴结的MPR界值和原发灶一致,均为残留存活肿瘤百分比≤10%,淋巴结MPR与淋巴结pCR预后相近;
2、原发灶与淋巴结,淋巴结与淋巴结之间RVT的病理缓解反应异质性较大;
3、淋巴结MPR的生存预测价值独立于原发灶MPR,mLN-MPR(+)/PT-MPR(+)的患者预后最好;
4、非MPR淋巴结具有完全不同的病理免疫亚型;
5、基于淋巴结MPR评估的改良淋巴结分期标准优于ypTNM分期系统
研究构思
免疫检查点抑制剂(ICI)通过靶向免疫细胞表面抗原识别受体(如PD-1和CTLA-4)或肿瘤细胞表面特定抗原(如PD-L1)激活机体免疫系统、增强免疫T细胞的杀伤能力。目前,新辅助免疫治疗被广泛应用于可切除非小细胞肺癌(NSCLC)的治疗,根据现有文献报道,新辅助免疫联合化疗治疗NSCLC的淋巴结降期率高达71.0%2,而仅进行新辅助化疗的淋巴结降期率仅为7.0%3-32.5%4之间,同时,ICI可能引起“淋巴结免疫耀斑”1(新辅助ICIs治疗后,影像学呈现异常淋巴结高摄取,但病理不存在肿瘤浸润的原发性非干酪性肉芽肿),这些结果均提示ICI可能对于转移淋巴结有相对更好的疗效。
根据Hellmann等人5制定的一份专家共识,原发肿瘤(PT)的主要病理学缓解(MPR),定义为残留存活肿瘤百分比(RVT%)≤10%,可作为评估肺癌新辅助疗效的可靠生存替代指标。然而,目前鲜少有研究将MPR的概念拓展至转移淋巴结。此前,Corsini等人6已证明对于接受新辅助化疗的NSCLC,原发灶MPR且淋巴结病理分期为ypN0期的患者(PT-MPR/ypN0)患者预后最好;然而,这一标准忽略了转移淋巴结(mLNs)大部分退缩但仍有少量残留的情况,而此类患者也可能获得长期生存。在新辅助免疫联合化疗的治疗模式下,预估有更多淋巴结部分缓解的患者。
因此,该研究旨在探索淋巴结MPR的定义,并提出以下假设,对于接受新辅助免疫治疗联合化疗的NSCLC患者,转移淋巴结的主要病理缓解[mLN-MPR(+)]具有良好的术后生存预测效能。此外,这项研究还探究了新辅助免疫治疗后部分退缩的转移淋巴结的病理特征。
研究结果
纳入2020年1月至2021年1月期间接受新辅助免疫化疗并接受根治性手术的cIII期(N1-N3)NSCLC患者共53例。大多数患者为鳞状细胞癌(66.0%)。由两名经验丰富的病理医师对PT及其配对淋巴结的石蜡包埋切片进行苏木精-伊红染色,根据irPRC标准7对RVT%进行评分。ypN0定义为病理无区域淋巴结转移,PT-MPR(+)定义为原发灶标本RVT≤10%,mLN-MPR(+)定义为切除淋巴结样本平均RVT%≤10%。新辅助免疫化疗后PT-MPR(+)共31例(58.5%),mLN-MPR(+)共34例(64.2%),ypN0共28例(52.8%)。术后中位随访时间为12.5(95%CI:9.6~15.0)个月。
为了确定mLN-MPR的预后意义,我们对DFS进行了单因素Cox模型分析(包括年龄、性别、组织学、PT-MPR、mLN-RVT、mLN-MPR、mLN-MPR/PT-MPR反应模式、ypN分期、ypN分期/PT-MPR反应模式和辅助治疗等因素)(表1)。
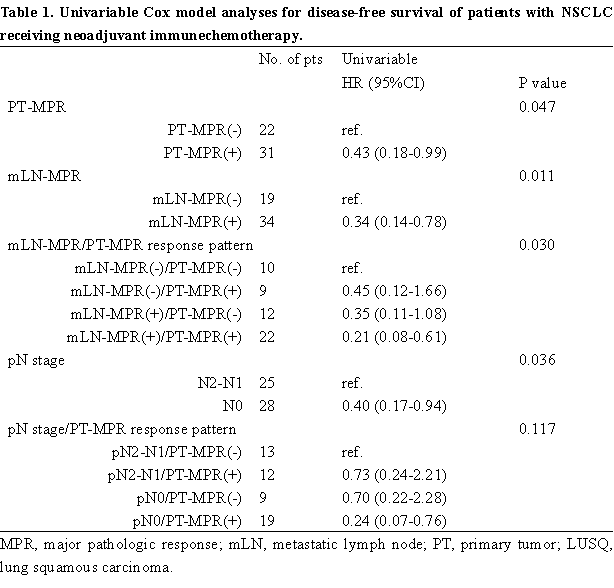
使用单因素Cox比例风险模型按mLN-RVT0%、mLN-RVT1~10%和mLN-RVT11~100%分层的累积DFS如图1A所示。显示mLN-RVT1~10%的风险比(HR)与mLN-RVT0%相似(0.42对0.32)。提示淋巴结MPR的截断值和原发灶一致,均为残留存活肿瘤百分比≤10%。
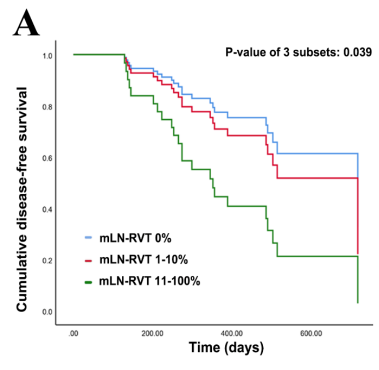
PT-MPR(HR:0.43, 95%CI: 0.18~0.78;P=0.184, ref: PT-MPR(-))与DFS延长相关。mLN-MPR(+)(HR: 0.34,95%CI: 0.14~0.78;P=0.011, ref: mLN-MPR(-))(表1)与DFS的相关性比ypN0(因纳入均为N1-3患者,因此相当于LN-pCR)更显著(HR:0.40,95%CI:0.17~0.94;P=0.036,ref:ypN1-N2)。与ypN分期联合PT-MPR相比(p值:0.030比0.117)(图1C、图1D),mLN-MPR联合PT-MPR可以更好地区分4个亚组患者的DFS曲线(图1B、1D)。mLN-MPR(+)/PT-MPR(+)的患者预后最好。
经过严格的组织病理学评估程序,发现肿瘤原发灶与配对淋巴结,淋巴结与淋巴结之间RVT的病理缓解反应可能相互不一致(PT/mLN-MPR不一致率:39.6%)。31例原发灶MPR(PT-MPR(+))患者其转移淋巴结RVT>10%;22例原发灶非MPR患者中12例转移淋巴结MPR(mLN-MPR(+))。图1E为两例PT和配对淋巴结RVT病理缓解反应不一致的病例。病例1:PT组RVT为0%(PT-pCR(+)),N1站转移淋巴结RVT为5%,N2站转移淋巴结RVT为95% (mLN-MPR(-))(图1E,病例1);例2患者PT的RVT占90%(PT-MPR(-)),N1站转移淋巴结RVT占80%,N2站转移淋巴结RVT仅30%(图1E,病例2)。

此外,本研究还发现在新辅助免疫联合化疗治疗后,对于部分退缩的转移淋巴结(RVT%>10%,≤50%),即使转移淋巴结内残余肿瘤数量比例相似,转移淋巴结内残余肿瘤也可表现为完全不同的病理免疫亚型:即免疫炎症亚型(图1H,病例3)或免疫荒漠亚型(图1H,病例4)。病例3患者N2站LN表现为免疫炎症亚型。例4患者N2站转移LN有30%的RVT但表现为免疫荒漠亚型,LN中央伴有大量坏死。

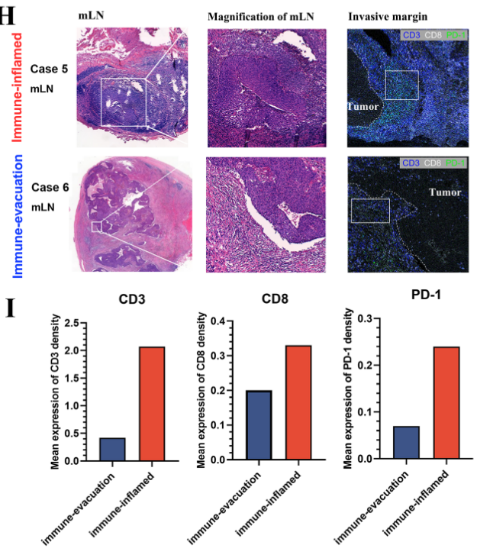
为了在蛋白质水平上量化不同淋巴结免疫亚型的免疫微环境状态,我们设计了一种具有3种标记(CD3,CD8,PD-1)的质谱流式(IMC)Panel,对免疫炎症亚型(图1H,病例5)和免疫荒漠亚型(图1H,病例6)的转移淋巴结标本进行检测。免疫浸润亚型转移淋巴结样本的浸润边缘(肿瘤边缘与微环境交界处)的CD3表达 (2.07 vs. 0.42)、CD8表达 (0.33 vs. 0.20)、PD-1表达 (0.24 vs. 0.07)相比免疫排斥亚型的转移淋巴结样本更高(图1I)。
在目前的ypTNM分期系统8中,治疗后部分缓解的转移LN被认为与没有任何消退迹象的转移LN相同分期,存在不合理之处。因此,ypN分期标准可能不能准确评估新辅助免疫治疗后转移LN疗效反应。本研究旨在探讨mLN-MPR的预后意义,为进一步完善这一标准提供参考。综上,该研究明确了mLN-MPR的界值(RVT%cut-off值为10%)以及独立于原发灶MPR的预后价值,并提出代替ypN0作为NSCLC新辅助免疫化疗术后改良的淋巴结分期标准,以更好地预测新辅助免疫术后DFS。此外,本研究发现(1)新辅助免疫化疗的淋巴结降期率较高(52.8%);(2)原发灶和配对淋巴结,以及淋巴结与淋巴结RVT的病理缓解反应可能不一致;(3)部分病理缓解的转移淋巴结可呈现不同的免疫亚型,可能与预后相关。评估转移淋巴结内肿瘤残余数量+对淋巴结内微环境进行免疫分型可能可以获得更好的生存预测价值,而这需要进一步的研究来验证这些发现。
1. Cascone T, Weissferdt A, Godoy MCB, et al. Nodal immune flare mimics nodal disease progression following neoadjuvant immune checkpoint inhibitors in non-small cell lung cancer. Nature communications 2021;12(1):5045. doi: 10.1038/s41467-021-25188-0 [published Online First: 2021/08/21]
2. Wu J, Hou L, E H, et al. Real-world clinical outcomes of neoadjuvant immunotherapy combined with chemotherapy in resectable non-small cell lung cancer. Lung cancer (Amsterdam, Netherlands) 2022;165:115-23. doi: 10.1016/j.lungcan.2022.01.019 [published Online First: 2022/02/06]
3. Girard N, Mornex F, Douillard JY, et al. Is neoadjuvant chemoradiotherapy a feasible strategy for stage IIIA-N2 non-small cell lung cancer? Mature results of the randomized IFCT-0101 phase II trial. Lung cancer (Amsterdam, Netherlands) 2010;69(1):86-93. doi: 10.1016/j.lungcan.2009.10.003 [published Online First: 2009/11/03]
4. Yang CF, Gulack BC, Gu L, et al. Adding radiation to induction chemotherapy does not improve survival of patients with operable clinical N2 non-small cell lung cancer. The Journal of thoracic and cardiovascular surgery 2015;150(6):1484-92; discussion 92-3. doi: 10.1016/j.jtcvs.2015.06.062 [published Online First: 2015/08/12]
5. Hellmann MD, Chaft JE, William WN, Jr., et al. Pathological response after neoadjuvant chemotherapy in resectable non-small-cell lung cancers: proposal for the use of major pathological response as a surrogate endpoint. The Lancet Oncology 2014;15(1):e42-50. doi: 10.1016/s1470-2045(13)70334-6 [published Online First: 2014/01/05]
6. Corsini EM, Weissferdt A, Pataer A, et al. Pathological nodal disease defines survival outcomes in patients with lung cancer with tumour major pathological response following neoadjuvant chemotherapy. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery 2021;59(1):100-08. doi: 10.1093/ejcts/ezaa290 [published Online First: 2020/08/31]
7. Cottrell TR, Thompson ED, Forde PM, et al. Pathologic features of response to neoadjuvant anti-PD-1 in resected non-small-cell lung carcinoma: a proposal for quantitative immune-related pathologic response criteria (irPRC). Annals of oncology : official journal of the European Society for Medical Oncology 2018;29(8):1853-60. doi: 10.1093/annonc/mdy218 [published Online First: 2018/07/10]
8. Byrd DR, Brierley JD, Baker TP, et al. Current and future cancer staging after neoadjuvant treatment for solid tumors. CA Cancer J Clin 2021;71(2):140-48. doi: 10.3322/caac.21640 [published Online First: 2020/11/07]











 苏公网安备32059002004080号
苏公网安备32059002004080号


