

孙春晓, 王树森, 李健斌, 等. 紫杉醇脂质体在晚期乳腺癌中应用的真实世界研究[J]. 中华肿瘤杂志, 2023, 45(1):88-94.
DOI: 10.3760/cma.j.cn112152-20220129-00069.
目的
探讨真实世界中紫杉醇脂质体在中国人群晚期乳腺癌中的应用情况及疗效。
方法
本研究为回顾性研究,收集中国11家医院2016年1月1日至2019年8月31日接受紫杉醇脂质体解救治疗的晚期乳腺癌患者的临床病理资料。研究主要观察指标为无进展生存时间(PFS),次要观察指标为客观缓解率(ORR)及安全性。生存分析采用Kaplan-Meier法,单因素分析采用Log rank检验,多因素分析采用Cox比例风险模型。
结果
647例接受紫杉醇脂质体解救治疗的晚期乳腺癌患者中,一线治疗占比为43.3%(280/647),二线治疗占比为27.7%(179/647),三线及以上治疗占比为29.1%(188/647)。一线和二线治疗每周期中位总剂量均为260 mg,三线及以上治疗中位总剂量为240 mg。治疗中位周期数为6个周期,单药治疗中位周期数为4个周期,联合化疗或联合靶向药物治疗中位周期数为6个周期。全组647例患者中,采用紫杉醇脂质体联合卡培他滨±曲妥珠单抗方案治疗167例(25.8%),采用紫杉醇脂质体单药方案治疗123例(19.0%),采用紫杉醇脂质体联合铂类药物±曲妥珠单抗方案治疗119例(18.4%),采用紫杉醇脂质体联合曲妥珠单抗±帕妥珠单抗方案治疗108例(16.7%)。一线治疗和二线治疗患者的中位PFS(分别为5.5和5.5个月)长于三线及以上治疗的患者(4.9个月,均P<0.05);一线、二线、三线及以上治疗患者的ORR分别为46.7%、36.8%和28.2%。多因素分析显示,无事件生存时间和治疗线数是PFS的独立影响因素(均P<0.05)。患者常见不良反应为骨髓抑制、消化道反应、手足综合征、肝功能异常。
结论
紫杉醇脂质体在各类分子分型乳腺癌中广泛应用,有效且安全性良好。
【关键词】乳腺肿瘤;紫杉醇脂质体;真实世界;疗效;安全性
乳腺癌是女性最常见的恶性肿瘤,国际癌症研究中心发布的GLOBOCAN 2020数据显示,2020年全球新发乳腺癌226万例,乳腺癌首次超过肺癌成为最常见的恶性肿瘤。国家癌症中心最新数据显示,2016年乳腺癌居我国女性恶性肿瘤发病的首位,新发病例30.6万例。乳腺癌发病率在近年总体呈上升趋势,疾病负担日趋严重。晚期乳腺癌是乳腺癌的特殊发展阶段,包括转移性和复发乳腺癌。约3%~8%的乳腺癌患者初诊时即有远处转移,此外仍有30%~40%的早期乳腺癌患者在接受手术及规范治疗后出现复发转移。晚期乳腺癌难以治愈,其治疗目的是缓解症状、提高生活质量和延长生存时间。
紫杉类药物是晚期乳腺癌化疗常用的药物之一,包括传统紫杉醇、紫杉醇脂质体、白蛋白结合型紫杉醇(白蛋白紫杉醇)。紫杉类药物通过促进微管蛋白二聚体的聚合并阻止其解聚达到稳定微管的作用,从而抑制分裂间期和有丝分裂细胞功能重要微管网的正常动态重组,同时导致微管束的排列异常,影响肿瘤细胞分裂,从而发挥抗肿瘤作用。传统紫杉醇以聚氧乙基代蓖麻油以及无水乙醇配比为溶媒,聚氧乙基代蓖麻油在体内可激活肥大细胞释放组胺,引起严重过敏反应,并在血液中形成微小颗粒包裹紫杉醇分子,影响药物分子向组织扩散,进而影响抗肿瘤效应。因此,紫杉醇脂质体和白蛋白紫杉醇应运而生,旨在提高紫杉醇的水溶性和药物治疗指数。紫杉醇脂质体采用纳米技术将难溶于水的紫杉醇包封在新型药物载体脂质体磷脂双分子层中,以解决紫杉醇不溶于水的难题。紫杉醇脂质体不再使用聚氧乙基代蓖麻油溶媒,从而减少了药物不良反应(如严重过敏反应、血液学不良反应等)的发生风险,提高了肿瘤患者的耐受性。与传统紫杉醇相比,紫杉醇脂质体的药代动力学特性也更为优越,半衰期延长1倍以上,可以更长时间发挥抗肿瘤作用。
2003年,福建省肿瘤医院等中心开展的一项随机、双盲、紫杉醇注射液对照多中心临床试验结果表明,紫杉醇脂质体联合阿霉素或顺铂治疗乳腺癌或非小细胞肺癌与普通紫杉醇注射液联合化疗相比,疗效相当,但不良反应发生率明显降低。因此,紫杉醇脂质体于2003年被国家食品药品监督管理局批准用于曾用过含阿霉素标准化疗乳腺癌患者的后续治疗或复发患者的治疗。紫杉醇脂质体是国际首个上市的注射用紫杉醇脂质体药物,近年来,紫杉醇脂质体成功引起了国际关注,国外综述对紫杉醇脂质体的作用机制、制剂特点、适应证和临床应用以及前景等方面做了较详细的论述,但迄今为止,尚无文献报道紫杉醇脂质体在中国人群晚期乳腺癌应用的临床数据。紫杉醇脂质体在我国上市已15余年,应用广泛、较为成熟。鉴于此,我们开展了本项真实世界数据研究(CSCO BC MT01研究),以了解紫杉醇脂质体在中国人群真实世界中的治疗模式,包括给药剂量、应用人群、疗效、安全性等,以期为后续规范和优化紫杉醇脂质体的临床应用提供参考。
资料与方法
1.临床资料:
收集2016年1月1日至2019年8月31日在南京医科大学第一附属医院、中山大学附属肿瘤医院、解放军总医院第五医学中心、山东省肿瘤医院、湖南省肿瘤医院、西安交通大学第一附属医院、青岛大学附属医院、浙江省肿瘤医院、南昌市第三医院、中国医学科学院肿瘤医院和河南省肿瘤医院接受过紫杉醇脂质体解救治疗的晚期乳腺癌患者的临床病理资料。纳入标准:(1)经病理组织学或影像学确诊的晚期乳腺癌;(2)美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分为0~2分;(3)2016—2019年接受至少2个疗程紫杉醇脂质体解救治疗方案且随访时间>3个月;(4)按照实体瘤疗效评价标准1.1版,至少有1个颅外可测量病灶或患者存在溶骨性或混合型骨转移灶。排除标准:(1)合并其他肿瘤;(2)男性乳腺癌或双侧乳腺癌。从患者既往医疗记录中收集患者的基线特征、紫杉醇脂质体治疗相关数据以及疗效观察指标相关数据。基线数据包括年龄、初治时月经状态、TNM分期、既往化疗、转移情况等。紫杉醇脂质体治疗相关数据包括治疗方案、线数、剂量、周期等。
2.结局指标:
疗效观察指标包括无进展生存时间(progression-free survival, PFS)、客观缓解率(objective response rate, ORR)、无事件生存时间(event-free survival, EFS)及不良事件。根据研究者判定结果评估完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)、疾病进展(progressive disease, PD)。PFS为从用药治疗开始至出现肿瘤客观进展或死亡的时间。ORR指疗效评价为CR或PR的患者占总人群的比例。EFS定义为从诊断到肿瘤复发、进展或因任何原因死亡的时间。
3.统计学方法:
采用SAS 9.4软件进行统计分析。符合正态分布的计量资料采用 ±s表示,不符合正态分布的资料采用M(Q1,Q3)表示。生存分析采用Kaplan-Meier法,单因素分析采用Log rank检验,多因素分析采用Cox比例风险模型。检验水准α=0.05。
±s表示,不符合正态分布的资料采用M(Q1,Q3)表示。生存分析采用Kaplan-Meier法,单因素分析采用Log rank检验,多因素分析采用Cox比例风险模型。检验水准α=0.05。
结果
一、临床病理特征
647例接受紫杉醇脂质体解救治疗的晚期乳腺癌患者年龄为22~78岁,中位年龄为46岁。初诊时59.8%(387/647)的患者未绝经。初诊时T1~2期患者458例(70.8%),T3~4期116例(17.9%),T分期不明确73例(11.3%);初诊时N0期163例(25.2%),N1~3期414例(64.0%),N分期不明确70例(10.8%);548例(84.7%)患者初诊时为M0期,99例(15.3%)患者初诊时为M1期。激素受体(hormone receptor, HR)阳性321例(49.6%),人表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2)阳性365例(56.4%)。接受紫杉醇脂质体治疗前,393例(60.7%)患者伴有内脏转移,转移部位数为1个的患者252例(38.9%),转移部位≥2个的患者395例(61.1%)。379例患者(58.6%)在本次研究开始前使用过紫杉类药物治疗。
二、紫杉醇脂质体应用情况
1.使用时间和治疗线数:
647例患者中,2015年之前接受紫杉醇脂质体解救治疗的晚期乳腺癌患者25例(3.9%),2015年35例(5.4%),2016年131例(20.2%),2017年157例(24.3%),2018年210例(32.5%),2019年89例(13.8%)。紫杉醇脂质体用于晚期乳腺癌患者的解救治疗以一线治疗为主,占比为43.3%(280/647),二线治疗占比为27.7%(179/647),三线及以上治疗占比为29.1%(188/647)。接受一线治疗的患者中,65.0%(182/280)的患者治疗方案为紫杉醇脂质体联合化疗,23.9%(67/280)为紫杉醇脂质体联合靶向药物,11.1%(31/280)为紫杉醇脂质体单药治疗。接受二线治疗的患者中,59.8%(107/179)的患者治疗方案为紫杉醇脂质体联合化疗药物,18.4%(33/179)为紫杉醇脂质体联合靶向药物治疗,21.8%(39/179)为紫杉醇脂质体单药治疗。三线及以上治疗的患者中,57.4%(108/188)的患者治疗方案为紫杉醇脂质体联合化疗,14.4%(27/188)为紫杉醇脂质体联合靶向药物,28.2%(53/188)为紫杉醇脂质体单药(表1)。

2.给药剂量和治疗周期数:
紫杉醇脂质体一线和二线治疗的每周期中位总剂量均为260 mg,三线及以上治疗中位总剂量为240 mg。不同治疗线数、单药和联合其他药物治疗时的剂量存在差异。一线治疗中,单药紫杉醇脂质体的中位剂量为240 mg,联合化疗时中位剂量为255 mg,仅联合靶向药物时中位剂量为270 mg。二线治疗中,单药紫杉醇脂质体的中位剂量为270 mg,联合化疗时中位剂量为248 mg,仅联合靶向药物时中位剂量为245 mg。三线及以上治疗中,单药紫杉醇脂质体的中位剂量为270 mg,联合化疗时中位剂量为240 mg,仅联合靶向药物时中位剂量为240 mg。
紫杉醇脂质体治疗晚期乳腺癌的周期数为2~21个周期,中位周期数为6个周期;紫杉醇脂质体单药治疗周期数为2~16个周期,中位周期数为4个周期;紫杉醇脂质体联合化疗的周期数为2~17个周期,中位周期数为6个周期;紫杉醇脂质体联合靶向药物治疗的周期数为2~21个周期,中位周期数为6个周期。
3.常用方案:
接受紫杉醇脂质体治疗患者常用的方案有4种:TX±H方案(紫杉醇脂质体+卡培他滨±曲妥珠单抗)167例,T方案(紫杉醇脂质体单药)123例,TP±H方案(紫杉醇脂质体+铂类药物±曲妥珠单抗)119例,TH±P方案(紫杉醇脂质体+曲妥珠单抗±帕妥珠单抗)108例,其余130例患者的治疗方案较为分散,包括GT±H方案(吉西他滨+紫杉醇脂质体±曲妥珠单抗)、TC±H方案(紫杉醇脂质体+环磷酰胺±曲妥珠单抗)等(表2)。
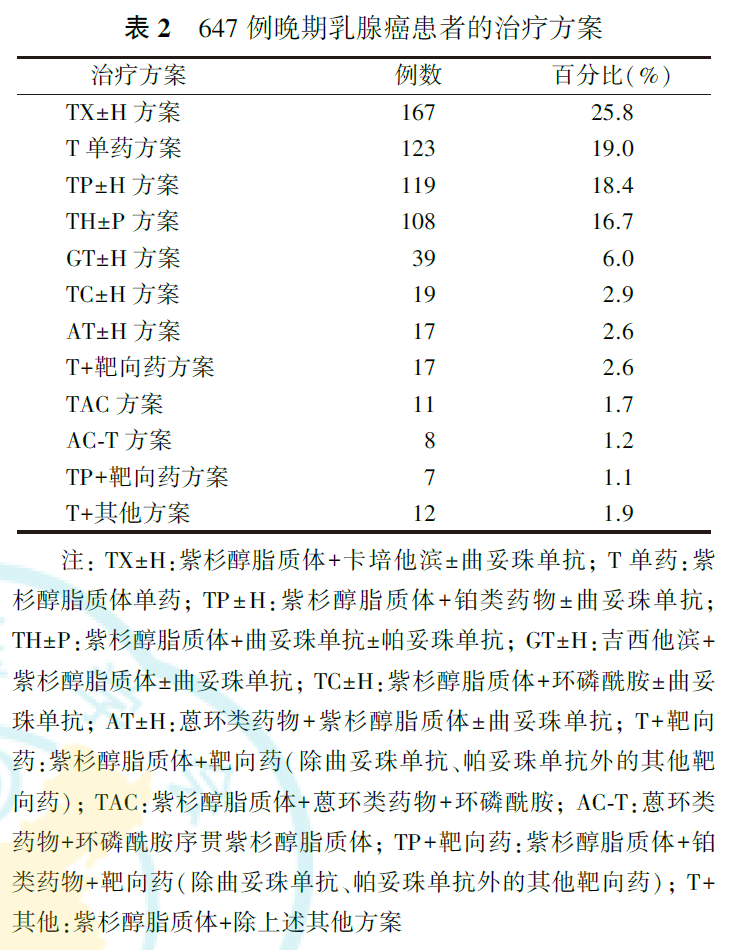
三、临床疗效
1.主要观察指标:
全组647例患者中,一线治疗患者(n=280)的中位PFS为5.5个月(95% CI:5.0~6.0个月),二线治疗患者(n=179)的中位PFS为5.5个月(95% CI:4.8~6.2个月),三线及以上治疗患者(n=188)的中位PFS为4.9个月(95% CI:3.9~5.9个月),全组患者的生存曲线见图1。一线治疗患者的中位PFS长于三线及以上治疗的患者(HR=0.712, 95% CI:0.541~0.938,P=0.016),二线治疗患者的中位PFS长于三线及以上治疗的患者(HR=0.719, 95% CI:0.524~0.987,P=0.041)。
2.次要观察指标:
596例可评估疗效患者的ORR为38.6%。一线治疗患者的ORR为46.7%,二线治疗患者的ORR为36.8%,三线及以上治疗患者的ORR为28.2%(表3)。HR+/HER-2+、HR+/HER-2-、HR-/HER-2+、三阴性乳腺癌患者的ORR分别为44.7%、37.8%、36.5%和34.4%。TX±H方案治疗患者的ORR为43.1%,T单药方案治疗患者的ORR为26.1%,TP±H方案治疗患者的ORR为43.7%,TH±P方案治疗患者的ORR为32.4%。

3.影响因素分析:
540例初诊时无复发转移的患者可评估EFS。EFS≤24个月患者的PFS(5.1个月)短于EFS>24个月的患者(5.7个月,HR=1.305,95% CI:1.004~1.759,P=0.049;图2)。

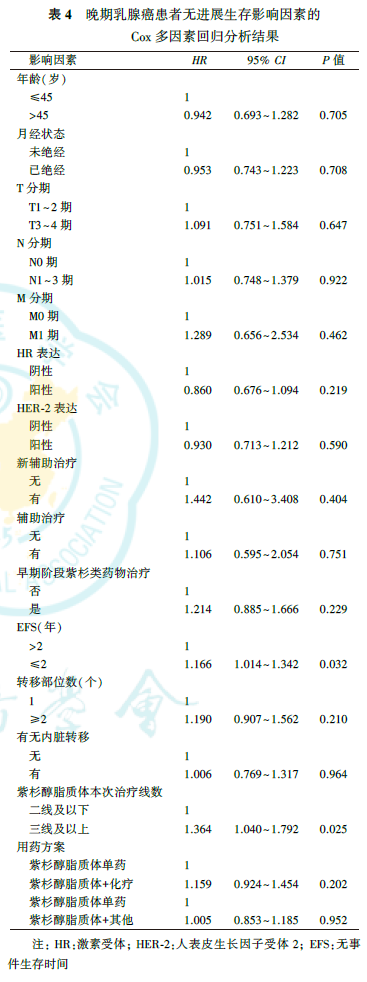
多因素分析结果显示,EFS和治疗线数是影响PFS的独立预后因素(均P<0.05)。EFS>2年的患者疾病进展风险较EFS≤2年的患者降低(P=0.032,表4)。紫杉醇脂质体治疗线数为二线及以下的患者疾病进展风险较三线及以上的患者降低(P=0.025,表4)。
四、安全性和不良反应
全组患者的常见不良反应包括骨髓抑制、消化道反应、手足综合征、肝功能异常等。其中骨髓抑制为最常见的不良反应,紫杉醇脂质体单药治疗患者的骨髓抑制发生率为48.0%(59/123),紫杉醇脂质体联合化疗药物、联合化疗药物+靶向药物治疗患者的骨髓抑制发生率分别为51.8%(206/398)和33.3%(42/126)。消化道反应中,紫杉醇脂质体单药治疗、联合化疗药物、联合化疗药物+靶向治疗的发生率分别为8.9%(11/123)、22.1%(88/398)和14.3%(18/126)。肝功能异常发生率均<8%,手足反应发生率<5%。提示紫杉醇脂质体单药以及联合治疗总体安全性良好。
讨论
临床实践中患者情况较为复杂,对真实世界数据的分析更能反映药物疗效和不良事件的准确信息。本研究是评估紫杉醇脂质体用于中国人群晚期乳腺癌解救治疗的多中心、大型、回顾性真实世界研究,收集了我国11家诊疗中心2016—2019年紫杉醇脂质体的临床应用、疗效及安全性数据。对647例接受含紫杉醇脂质体方案治疗患者的数据分析结果显示,真实世界中紫杉醇脂质体以一线治疗为主,占43.3%,二线、三线及以上治疗各占27.7和29.1%,说明紫杉醇脂质体在临床广泛用于晚期乳腺癌患者的各线数治疗;患者每周期使用紫杉醇脂质体的总剂量为240~270 mg,表明在真实世界中,紫杉醇脂质体的使用剂量在说明书推荐的范围内(135~175 mg/m2);紫杉醇脂质体联合化疗或联合靶向药物时中位治疗周期数为6个周期,单药治疗时中位治疗周期数为4个周期,这可能与联合治疗时多为一线、二线治疗,单药时多为三线及以上治疗有关。本研究中最常用的治疗方案包括TX±H方案、紫杉醇脂质体单药方案、TP±H方案、TH±P方案,说明在真实世界中,紫杉醇脂质体联合化疗药物、联合抗HER-2靶向治疗、单药使用均较为广泛。
本研究的疗效分析结果显示,含紫杉醇脂质体方案一线、二线治疗的PFS优于三线及以上治疗,一线治疗的ORR优于二线和三线及以上治疗,提示紫杉醇脂质体在晚期乳腺癌前线应用疗效更佳。EFS>2年的患者采用紫杉醇脂质体解救治疗PFS长于EFS≤2年的患者,因此,支持新辅助或辅助治疗应用过紫杉类药物的患者解救治疗再次使用紫杉醇脂质体。
本研究的疗效与既往紫杉醇在晚期乳腺癌中的前瞻性随机对照试验(randomized controlled trial, RCT)疗效相比,尚有一些差距,可能的原因包括:(1)本研究为真实世界研究,与RCT研究相比,纳入患者标准更为宽泛,ECOG评分为2分、脑转移患者均可纳入,二线及以上治疗患者占比>50%,>60%的患者有内脏转移,转移部位数≥2个的患者占比>60%,患者肿瘤负荷大、治疗线数偏后可能对ORR及PFS造成一定影响;(2)本研究为多中心回顾性研究,纳入人群可能存在选择偏倚,疗效评估的标准不尽一致、且部分客观疗效数据缺失,在一定程度上对疗效评估产生了影响。
本研究为回顾性研究,安全性数据有一定缺失。对病历系统中有记录的安全性数据分析结果显示,紫杉醇脂质体的不良反应仍以骨髓抑制、消化道反应、手足综合征、肝功能异常为主,未观察到新的不良反应。既往临床试验证实紫杉醇脂质体具有较好的安全性,有Meta分析显示,紫杉醇脂质体与普通紫杉醇的总有效率相当,但血液系统不良反应(白细胞减少、血小板减少)、神经系统不良反应(周围神经炎)、胃肠道反应(恶心呕吐)和过敏反应(皮疹、皮肤潮红、呼吸困难)的发生率显著下降,说明紫杉醇脂质体注射液安全性明显优于紫杉醇。《乳腺癌中紫杉类药物临床应用专家共识》也指出,我国日常临床实践中,紫杉醇脂质体等同于紫杉醇聚氧乙基代蓖麻油溶剂型,如患者对紫杉醇聚氧乙基代蓖麻油溶剂型或多西他赛过敏,可用紫杉醇脂质体替换。
综上所述,本项大型、多中心回顾性真实世界研究表明,紫杉醇脂质体在各类分子分型晚期乳腺癌中广泛应用,是治疗晚期乳腺癌的一种有效且耐受性良好的化疗药物。
免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate











 苏公网安备32059002004080号
苏公网安备32059002004080号


