

桑蝶, 宋丽华, 邸立军, 等. 艾立布林治疗晚期乳腺癌疗效和安全性的多中心真实世界研究[J]. 中华肿瘤杂志, 2022, 44(4):364-369.
DOI: 10.3760/cma.j.cn112152-20210226-00173.
目的
探讨真实世界艾立布林治疗晚期乳腺癌的疗效及安全性。
方法
选取2019年12月至2020年12月就诊于北京市朝阳区三环肿瘤医院、山东省肿瘤医院、北京大学肿瘤医院、包头市肿瘤医院、中国医科大学附属盛京医院及中国医学科学院肿瘤医院的晚期乳腺癌患者。生存分析采用Kaplan-Meier法和Log rank检验,多因素分析采用Cox回归模型。
结果
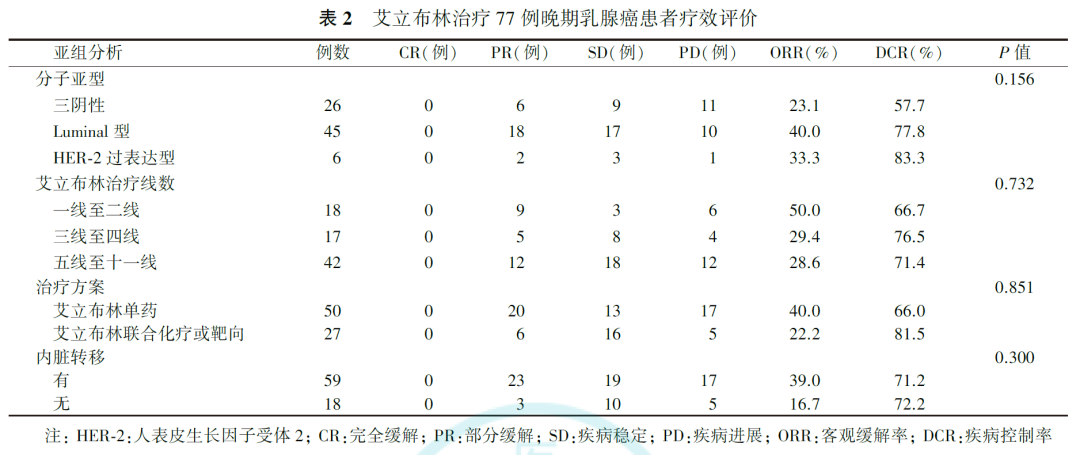
77例患者中位无进展生存时间为5个月,客观缓解率(ORR)为33.8%,疾病控制率(DCR)为71.4%。三阴性乳腺癌患者ORR为23.1%,DCR为57.7%;Luminal型乳腺癌患者ORR为40.0%,DCR为77.8%;人表皮生长因子受体2过表达型乳腺癌患者ORR为33.3%,DCR为83.3%。艾立布林为一线至二线治疗患者的ORR为50.0%,DCR为66.7%;三线至四线治疗患者的ORR为29.4%,DCR为76.5%;五线至十一线治疗患者的ORR为28.6%,DCR为71.4%。艾立布林单药治疗组患者的ORR为40.0%,DCR为66.0%;联合化疗或靶向治疗组患者的ORR为22.2%,DCR为81.5%。在辅助治疗阶段或复发转移后有紫杉醇、多西他赛或白蛋白紫杉醇治疗史的患者接受艾立布林治疗,其ORR为32.9%,DCR为69.9%。疗效评价是患者预后的独立影响因素(P<0.001)。全组患者的主要不良反应为Ⅲ~Ⅳ度中性粒细胞下降[29.9%(23/77)],其他不良反应分别为Ⅲ~Ⅳ度疲乏[5.2%(4/77)]、Ⅲ~Ⅳ度周围神经异常[2.6%(2/77)]和Ⅲ~Ⅳ度脱发[2.6%(2/77)]。
结论
艾立布林对各种分子亚型乳腺癌、多线化疗失败的晚期乳腺癌仍有效,且不良反应可控,具有较好的临床应用价值。
【关键词】乳腺肿瘤;艾立布林;疗效;不良反应
乳腺癌新发病例数居所有恶性肿瘤第1位,严重威胁广大女性身体健康。3%~10%的乳腺癌患者在首次确诊时即为晚期,而早期乳腺癌行根治性手术及多学科综合治疗后仍有30%~40%发展为晚期。晚期乳腺癌患者中位生存时间为2~3年,虽难以治愈,但可通过化疗、内分泌或靶向治疗改善患者生活质量,部分患者可长期带瘤生存。而针对紫杉类、蒽环类、三滨(长春瑞滨、吉西他滨和卡培他滨)及铂类等药物已经产生耐药的患者,如何选择化疗方案是肿瘤科医师面临的挑战。艾立布林是非紫杉烷类微管抑制剂,用于治疗已经接受过蒽环类及紫杉类药物治疗的转移性乳腺癌。由于在中国上市时间短、价格较贵等原因,艾立布林的临床应用经验尚不足,因此,我们开展了多中心临床研究,以总结真实世界中艾立布林治疗晚期乳腺癌的疗效和安全性。
资料与方法
1.临床资料:
选取2019年12月至2020年12月就诊于北京市朝阳区三环肿瘤医院、山东省肿瘤医院、北京大学肿瘤医院、包头市肿瘤医院、中国医科大学附属盛京医院及中国医学科学院肿瘤医院的晚期乳腺癌患者。入组标准:(1)诊断为乳腺癌,有病理和免疫组化结果;(2)检查发现远处转移,有可测量病灶;(3)血常规、肝肾功能及心电图结果正常,符合化疗条件;(4)美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分为0~2分;(5)预计生存时间>3个月。排除标准:(1)脑转移灶未控;(2)临床资料不全;(3)双原发恶性肿瘤患者。本研究纳入77例晚期乳腺癌患者,均为女性,年龄29~75岁,中位年龄53岁。激素受体阳性患者曾接受一线至四线内分泌治疗31例。全组患者中,内脏转移59例,转移脏器或组织包括肝、肺、骨、脑、胸膜、腹膜、肾上腺、淋巴结、胸壁等。全组患者的临床病理特征见表1。

2.治疗方法:
77例患者中,接受艾立布林单药治疗50例,艾立布林联合方案[包括联合化疗药物(顺铂、洛铂或卡培他滨)或联合靶向药物(包括程序性死亡受体1单抗、安罗替尼、阿帕替尼、贝伐珠单抗、曲妥珠单抗、帕妥珠单抗、拉帕替尼、吡咯替尼或恩美曲妥珠单抗)]治疗27例。艾立布林使用方法为1.4 mg/m2,第1天和第8天,溶入100 ml生理盐水,静脉滴注30 min,21 d为1个周期。每2个周期治疗结束后复查原发灶和转移部位CT或磁共振成像及乳腺肿瘤标志物,评估治疗疗效。每个化疗周期复查肝肾功能及心电图,每周复查血常规1~2次,评估治疗相关不良反应,直至肿瘤进展或患者出现不能耐受的不良反应暂停化疗。
3.病理判读标准:
乳腺穿刺活检标本由病理科医师采用全自动免疫组化机进行检测,标本经石蜡包埋并制作成3 μm的切片。雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR)状态判定:阴性为肿瘤细胞核染色阳性百分比<1%,阳性为肿瘤细胞核染色阳性百分比≥1%及任何强度着色。人表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2)状态判定:免疫组化HER-2(1+)或(-)或HER-2(2+),荧光原位杂交(fluorescence in situ hybridization, FISH)检测HER-2/CEP17<2.0为阴性;HER-2(3+)或HER-2(2+),FISH检测HER-2/CEP17≥2.0为阳性。Ki-67判读:阳性细胞为细胞核染色为淡黄色至棕黄色,400倍光镜下检查,随机选择10个视野,每个视野计数500个细胞,计算Ki-67阳性细胞数占总细胞数的比例。
4.疗效评价标准:
参照实体瘤的疗效评价标准1.1版进行疗效评价。完全缓解(complete response, CR):所有靶病灶及非靶病灶消失;部分缓解(partial response, PR):靶病灶最大单径之和减少>30%且非靶病灶未进展;疾病进展(progressive disease, PD):肿瘤最大单径之和增加>20%或出现新病灶;疾病稳定(stable disease, SD):肿瘤最大单径之和减少≤30%或增加≤20%;客观缓解率(objective response rate, ORR)=(CR+PR)/总例数×100%;疾病控制率(disease control rate, DCR)=(CR+PR+SD)/总例数×100%。
5.随访情况:
采用电话、门诊复诊的方式随访。无进展生存时间(progression free survival, PFS)定义为从接受艾立布林治疗开始至首次出现PD或患者死亡的时间。总生存时间(overall survival, OS)定义为从接受艾立布林治疗开始至死亡或随访截止时间。随访截至2021年1月30日,随访时间为1~14个月,中位随访时间为5个月。77例患者全部获得随访,无失访患者。
6.不良反应评估:
参考美国国立癌症研究所扩大通用毒性标准(4.0版)进行不良反应评估。
7.统计学方法:
采用SPSS 25.0软件进行统计学分析。计数资料采用例数及百分比来描述。采用非参数检验Kruskal-Wallis和Mann-Whitney U检验进行亚组分析比较,生存分析采用Kaplan-Meier法和Log rank检验,影响因素分析采用Cox比例风险回归模型。双侧检验水准α=0.05。
结果
一、治疗疗效
全组患者艾立布林治疗周期数为2~17个,中位治疗周期数为4个。77例患者中,PR 26例,SD 29例,PD 22例,ORR为33.8%,DCR为71.4%。
1.不同分子亚型乳腺癌患者的疗效:
三阴性乳腺癌患者ORR为23.1%,DCR为57.7%;Luminal型乳腺癌患者ORR为40.0%,DCR为77.8%;HER-2过表达型乳腺癌患者ORR为33.3%,DCR为83.3%。不同分子亚型乳腺癌患者疗效差异无统计学意义(P=0.156,表2)。
2.不同治疗线数乳腺癌患者的疗效:
艾立布林为一线至二线治疗患者的ORR为50.0%,DCR为66.7%;三线至四线治疗患者的ORR为29.4%,DCR为76.5%;五线至十一线治疗患者的ORR为28.6%,DCR为71.4%。艾立布林不同治疗线数患者疗效差异无统计学意义(P=0.732,表2)。
3.不同治疗方案乳腺癌患者的疗效:
艾立布林单药治疗组患者的ORR为40.0%,DCR%为66.0%;联合化疗或靶向治疗组患者的ORR为22.2%,DCR为81.5%。不同治疗方案乳腺癌患者疗效差异无统计学意义(P=0.851,表2)。
4.有无内脏转移乳腺癌患者的疗效:
曾在辅助治疗阶段或复发转移后有紫杉醇、多西他赛或白蛋白紫杉醇治疗史的患者接受艾立布林治疗,其ORR为32.9%,DCR为69.9%。有无内脏转移患者疗效差异无统计学意义(P=0.300,表2)。
二、治疗安全性
全组患者中,主要不良反应为Ⅲ~Ⅳ度中性粒细胞下降[29.9%(23/77)],其他不良反应分别为Ⅲ~Ⅳ度疲乏[5.2%(4/77)]、Ⅲ~Ⅳ度周围神经异常[2.6%(2/77)]和Ⅲ~Ⅳ度脱发[2.6%(2/77),表3]。第1个治疗周期出现严重骨髓抑制的患者,后续给予对症治疗后血常规恢复正常。Ⅰ~Ⅱ度胃肠反应发生率为24.7%(19/77),Ⅰ~Ⅱ度肝功能异常发生率为28.6%(22/77),其中13例患者可能与肝转移瘤病情进展有关。全组患者不良反应可控,无一例因严重不良反应导致停止化疗的患者。

三、预后
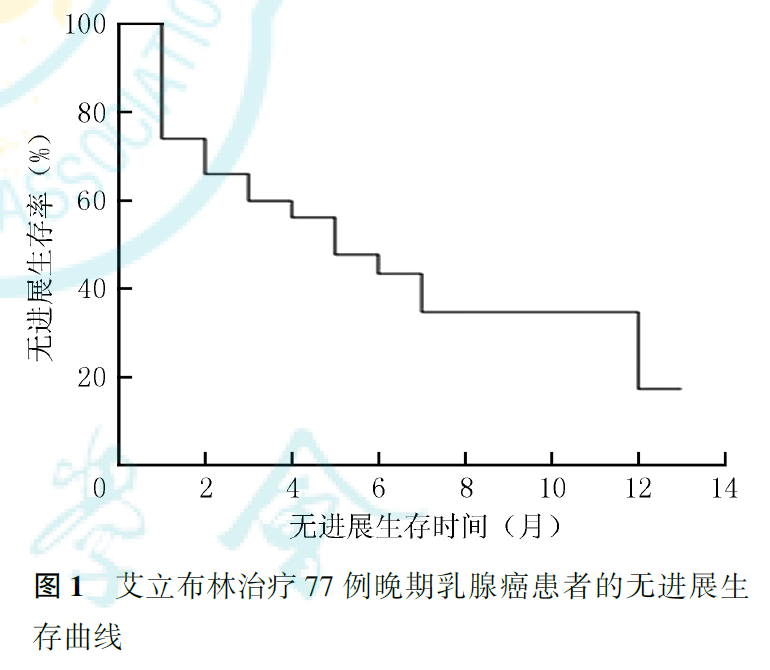
全组患者中位PFS为5个月(图1),PFS最长为13个月,中位OS未达到,平均OS为12个月。三阴性、Luminal型、HER-2过表达型乳腺癌的中位PFS分别为3、5和6个月(P=0.239;表4,图2)。单因素分析显示,疗效评价与患者预后有关(P<0.001, 表4)。多因素分析结果显示,疗效评价是影响患者预后的独立影响因素(P<0.001,表5)。



讨论
基于多项Ⅲ期临床研究证实,艾立布林在乳腺癌治疗中能兼顾疗效和安全性的优势。美国国立综合癌症网络、欧洲肿瘤内科学会、中国肿瘤临床学会等权威指南一致推荐艾立布林作为晚期乳腺癌新的化疗选择。
目前,在中国应用艾立布林治疗乳腺癌的经验仍较少,缺乏真实世界研究数据。因此,我们收集了多中心的77例患者进行分析,研究结果显示,一线或二线接受艾立布林治疗的患者仅占23.4%(18/77),与后线治疗比较,一线或二线接受艾立布林治疗患者与后线接受艾立布林治疗患者的ORR分别为50.0%和28.8%,此结果显示,更早阶段选择艾立布林治疗疗效有更优的趋势,但可能由于样本量所限以及两组病例数的差异,其ORR和DCR差异均无统计学意义。五线以上使用艾立布林患者占54.5%(42/77),ORR为28.6%,DCR为71.4%,提示对于多线化疗失败的患者,艾立布林仍有较强的抗肿瘤活性及治疗疗效。Luminal型患者ORR为40.0%、DCR为77.8%,研究结果提示Luminal型、三阴性和HER-2过表达型乳腺癌患者接受艾立布林治疗疗效显著。
本研究中,艾立布林治疗患者的中位PFS为5个月,PFS最长13个月,平均OS为12个月,中位OS未达到。一线或二线治疗患者与三线以上治疗患者中位PFS分别为7和5个月,艾立布林单药组与联合用药治疗组患者的中位PFS分别为5和6个月,提示早线治疗、联合方案治疗组患者PFS有更优趋势,但也可能由于样本量所限,随访时间较短,中位PFS差异无统计学意义,我们会在后续随访中进一步观察此原因。
既往关键性临床研究展现出艾立布林良好的应用前景。2015年国外学者比较了艾立布林与卡培他滨在局部晚期或转移性乳腺癌患者中的疗效,纳入艾立布林治疗患者554例,卡培他滨治疗患者548例,结果显示,两组患者的中位OS分别为15.9和14.5个月(P=0.056),中位PFS分别为4.1和4.2个月(P=0.30),三阴性亚组中,艾立布林组患者OS较对照组延长5个月,死亡风险降低29.8%。美国临床肿瘤学会2020公布的(RU011201I)研究显示,一线或二线使用艾立布林与紫杉醇比较治疗HER-2阴性晚期乳腺癌的疗效相当,但艾立布林组患者外周神经病变出现更晚且持续时间短,具有一定优势。本研究结果显示,接受艾立布林治疗晚期乳腺癌患者的中位PFS和疗效与以上研究相似。
本研究显示,艾立布林治疗晚期乳腺癌常见不良反应为中性粒细胞下降、疲乏、周围神经异常、胃肠道反应及脱发。化疗期间部分患者肝功能异常可能由于肝转移瘤导致,并非药物性肝炎;周围神经异常发生率为24.7%,多数患者在第4个周期化疗后出现,程度较轻,一般不影响日常生活。一项韩国研究中,学者对比了吉西他滨+艾立布林与紫杉醇+吉西他滨治疗晚期HER-2阴性乳腺癌的疗效和安全性,结果显示,118例患者中,两组治疗疗效相似,但艾立布林能延迟并减少神经不良反应,30%的患者出现神经病变,低于紫杉醇组(90%)。本研究显示,艾立布林不良反应可控,患者可耐受,与文献报道一致。
综上,艾立布林治疗各种分子亚型、多线化疗失败的晚期乳腺癌仍有显著疗效,不良反应可控,具有一定的应用价值和前景。
免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate











 苏公网安备32059002004080号
苏公网安备32059002004080号


