HER2扩增或过表达是胃癌的重要治疗靶点之一,对于HER2阳性晚期胃癌,一线治疗方案为抗HER2靶向治疗联合化疗±免疫治疗,但是目前二线治疗仍然乏善可陈。上海交通大学医学院附属瑞金医院黎皓教授分享1例HER2阳性晚期胃癌二线治疗病例。患者为老年女性,食管胃连接部癌根治术后肺转移,体力较差,化疗耐受较差。在免疫+抗HER2靶向治疗+化疗一线治疗进展后,使用靶向HER2的抗体偶联药(ADC)单药二线治疗达到部分缓解(PR),无进展生存期(PFS)已经达到5个月,患者体力和生活质量得到显著改善。
病例介绍
上海交通大学医学院附属瑞金医院肿瘤科
瑞金医院舟山分院肿瘤科执行主任
中国研究型医院学会精准医学与肿瘤MDT专业委员会委员
中华医学会肿瘤姑息治疗委员会青委委员
中华医学会肿瘤学分会早诊早治学组委员
上海市医学会临床流行病学和循证医学分会委员
上海市医学会临床药学专科分会抗肿瘤专业学组委员
上海市抗癌协会肿瘤精准治疗专业委员会委员
上海市抗癌协会癌症康复与姑息治疗专业委员会青委委员
《内科理论与实践》杂志编委
病例介绍
基本情况
患者女,79岁,因“胃癌切除术后肺转移”入院。
查体:神清,精神可,无皮疹及出血点,巩膜无黄染,无颈静脉怒张,无浅表淋巴结肿大。心律齐,未闻及病理性杂音。腹平坦,见陈旧性手术疤痕,愈合良好,压痛(-),无反跳痛,肝脾肋下未及,移动性浊音阴性,Murphy's征(-),肠鸣音正常。
既往诊疗经过
2018.11 外院胃镜:食管下端粘膜见隆起溃疡性病变,贲门见隆起溃疡性病变。胃镜病理示腺癌。
2018.11 上腹部CT:胃贲门区胃壁不规则增厚,伴周围肿大淋巴结。
2018.11 外院予以奥沙利铂+替吉奥化疗3疗程,后因IV度白细胞减少暂停化疗,疗效评估疾病稳定(SD)。
2019.3 我院行胃癌根治术,术后病理:pT3N2M0。术后辅以化疗SOX方案,累计7次,末次化疗2021.3.23。此后规律随访,CT未见活动性病变。
2020.10 PET-CT:吻合口局部壁增厚伴代谢增高,考虑吻合口复发可能 ,左颈部VI区,纵隔及双肺门多发高代谢淋巴结显示,纵隔内肿大淋巴结致肺下叶支气管闭塞伴左肺下叶不张,考虑转移病变。
患者因为高龄,个人因素抗拒化疗而未接受一线治疗。
本次诊疗经过
2021.11.29 患者出现明显乏力,纳差,当地医院检查,支气管镜提示左主新生物,免疫组化(IHC)提示:HER2(2+),pMMR,考虑胃转移。
2022.4 荧光原位杂交(FISH): HER2基因扩增(+)。
2022.4.11-2022.5.26 外院予以曲妥珠单抗360mg d1+替雷利珠单抗200mg d1+替吉奥40mg bid d1-14 q3w。
2022.6.17完善皮质醇检查后,暂停免疫治疗,予曲妥珠单抗360mg d1+替吉奥40mg bid d1-14 q3w。
2022.7.1 腹部CT:吻合口稍厚,残胃癌侵及浆膜层外考虑;肝膈顶低密度灶,较前新发,转移可能;脾脏多发低密度灶,转移可能,较前相仿(图1)。
患者出现明显消瘦,纳差,活动后气促,KPS评分60分,体重40kg,考虑对化疗不耐受。
2022.7.7 维迪西妥单抗100mg,q2w,6周期。
患者生活质量明显改善,正常进食,体力明显好转,KPS评分80分。
2022.10.18 腹部CT:胃切除术后,残胃癌侵及浆膜层外考虑,腹膜后小淋巴结显示;膈顶低密度灶,较前强化减低,转移可能(图1)。

图1 二线治疗前后腹部CT
疗效评价:部分缓解(PR)
患者生活质量明显改善,正常进食,体力明显好转,KPS评分80分。
诊疗经过见图2。
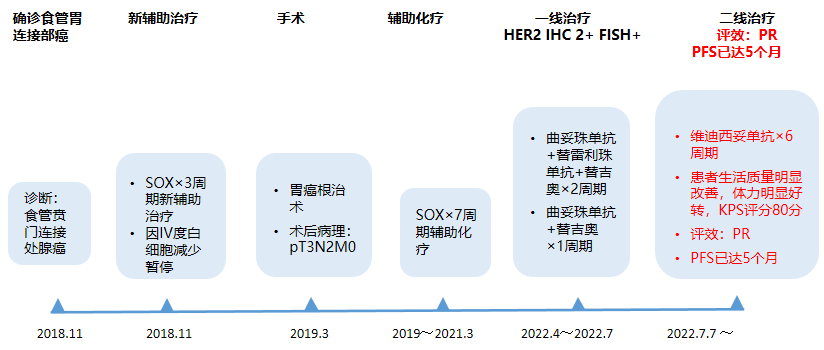
图2 诊疗经过
病例点评
迎刃而解,ADC药物有望破解HER2阳性晚期胃癌患者二线化疗耐受性差难题
在胃癌和食管胃连接部癌患者中,超过20%存在HER2扩增或过表达[1]。ToGA研究[2]首次证实抗HER2治疗联合化疗可显著改善HER2阳性晚期胃癌患者的预后,曲妥珠单抗联合化疗由此成为HER2阳性患者的首选一线治疗方案。KEYNOTE-811研究[3]表明,在抗HER2治疗联合化疗基础上加上PD-1单抗可以进一步提高疗效,帕博利珠单抗+曲妥珠单抗+化疗也因此进入2022版《CSCO胃癌诊疗指南》推荐[4],丰富了HER2阳性晚期胃癌一线治疗选择。但是在二线治疗上,虽然新版CSCO指南重新按HER2分层,以化疗为主,新增化疗联合抗血管生成药物,但仍缺乏可用的抗HER2药物,曲妥珠单抗联合化疗仅适用于既往未接受过曲妥珠单抗的患者 (II/III级推荐)[4]。对于不能耐受系统化疗的患者来说,二线治疗存在巨大未被满足的需求。近年来,ADC药物发展迅速并备受关注,2022版《CSCO胃癌诊疗指南》针对晚期转移性胃癌治疗中以HER2为靶点的药物注释中标注,新一代抗HER2的ADC类药物针对曲妥珠单抗治疗失败的晚期HER2阳性胃癌患者显示出了良好的肿瘤缓解率和生存获益。
该病例为老年女性,体力较差,对化疗耐受较差,既往因IV度白细胞减少暂停SOX新辅助化疗。二次手术复发后,IHC示HER2(2+)。外院FISH示HER2基因扩增阳性,予以曲妥珠单抗+替雷利珠单抗+替吉奥一线治疗,患者自诉症状缓解不明显,当地医生评估病灶缓解不明显。考虑患者难以耐受化疗,给予ADC单药治疗。患者在接受靶向HER2的ADC单药二线治疗后达到PR,无明显毒副反应,体力和生活质量显著改善,KPS评分由60分提高到80分,目前PFS已经达到5个月。
ADC药物为曲妥珠单抗治疗失败HER2阳性晚期胃癌患者带来强效缓解
我国自主研发的抗HER2 ADC药物关键研究C008[5]纳入了125例≥2线标准治疗失败的HER2 IHC2+/3+晚期胃癌患者,研究结果显示,抗HER2 ADC药物治疗的客观缓解率(ORR)达到24.8%,中位PFS为4.1个月,中位总生存期(OS)达到7.9个月。进一步分析发现,对于既往接受过曲妥珠单抗治疗的患者(n=72),抗HER2 ADC药物治疗的ORR达到27.8%,中位PFS为4.1个月,中位OS达到8.1个月;对于既往未接受过曲妥珠单抗治疗的患者(n=53),抗HER2 ADC药物治疗的ORR为20.8%,中位PFS为4.0个月,中位OS达到7.5个月。安全性方面,最常见不良事件为血液学毒性和乏力,对症支持治疗后可获得缓解。基于C008研究结果,2021年6月,国家药品监督管理局(NMPA)批准该抗HER2 ADC药物用于HER2过表达(IHC 2+/3+)晚期胃癌的三线或以上治疗,是目前针对晚期转移性胃癌抗HER2的后线治疗唯一中国可及的新一代ADC药物[6]。2022年CSCO指南也在晚期胃癌后线治疗推荐纳入该抗HER2 ADC药物,改写HER2阳性人群定义[4]。既往HER2阳性人群被定义为HER2 IHC2+和3+的同时存在基因扩增的患者,C008研究则证明,HER2 IHC2+的患者不论其基因是否扩增,均可从抗HER2 ADC药物治疗中获益[5]。
既往研究表明,在CSCO指南推荐的二线标准治疗中,紫杉醇、多西他赛、伊立替康、雷莫芦单抗+紫杉醇二线治疗晚期胃癌的ORR分别为20.9%、7.0%、13.6%、28%,中位PFS分别为3.6个月、12.2周、2.3个月和4.4个月,中位OS分别为9.5个月、5.2个月、8.4个月和9.6个月[7-10]。尽管不同研究入组患者不同,但仅从数值上看,抗HER2 ADC药物三线治疗的ORR较指南推荐的二线单药化疗方案显著提高,中位OS与二线标准治疗方案相当,且安全性更好。
ADC药物在HER2阳性晚期胃癌前线治疗中展现良好前景
很多晚期胃癌患者为高龄且合并多种基础疾病,在一线治疗进展后,身体状况更差,往往难以耐受化疗,但是当前HER2阳性晚期胃癌治疗仍然以化疗为主。虽然抗HER2 ADC药物在HER2阳性晚期胃癌二线治疗中的探索并不顺利,T-DM1二线治疗Ⅲ期研究为阴性结果,但是研究者并未放弃ADC药物用于胃癌前线治疗的尝试,目前已经取得初步成果。期待未来ADC药物不断向治疗前线推进,让更多晚期胃癌患者更早从创新药物中获益。
[1] Van Cutsem E, Bang YJ, Feng-Yi F, et al.HER2 screening data from ToGA: targeting HER2 in gastric and gastroesophageal junction cancer. Gastric Cancer. 2015 Jul;18(3):476-84.
[2] Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010;376(9742):687-97.
[3] Janjigian YY, Kawazoe A, Yañez P, et al. The KEYNOTE-811 trial of dual PD-1 and HER2 blockade in HER2-positive gastric cancer. Nature. 2021 ;600(7890):727-730.
[4] 2022版《CSCO胃癌诊疗指南》.
[5] Peng Z, Liu T, Wei J, et al. Efficacy and safety of a novel anti-HER2 therapeutic antibody RC48 in patients with HER2-overexpressing, locally advanced or metastatic gastric or gastroesophageal junction cancer: a single-arm phase II study. Cancer Commun (Lond). 2021;41(11):1173-1182.
[6] https://www.nmpa.gov.cn/index.html
[7] Hironaka S, Ueda S, Yasui H, et al. Randomized, open-label, phase III study comparing irinotecan with paclitaxel in patients with advanced gastric cancer without severe peritoneal metastasis after failure of prior combination chemotherapy using fluoropyrimidine plus platinum: WJOG 4007 trial. J Clin Oncol. 2013;31(35):4438-44.
[8] Thuss-Patience PC, Shah MA, Ohtsu A, et al.Trastuzumab emtansine versus taxane use for previously treated HER2-positive locally advanced or metastatic gastric or gastro-oesophageal junction adenocarcinoma (GATSBY): an international randomised, open-label, adaptive, phase 2/3 study. Lancet Oncol. 2017 ;18(5):640-653.
[9] Ford HE, Marshall A, Bridgewater JA, et al. Docetaxel versus active symptom control for refractory oesophagogastric adenocarcinoma (COUGAR-02): an open-label, phase 3 randomised controlled trial. Lancet Oncol. 2014 ;15(1):78-86.
[10] Wilke H, Muro K, Van Cutsem E, et al. Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomised phase 3 trial. Lancet Oncol. 2014;15(11):1224-35.
排版编辑:肿瘤资讯-Ivy












 苏公网安备32059002004080号
苏公网安备32059002004080号


