
中华医学会肿瘤学分会早诊早治学组. 中国食管癌早诊早治专家共识[J]. 中华肿瘤杂志, 2022, 44(10):1066-1075.
DOI: 10.3760/cma.j.cn112152-20220220-00114
电脑端:
https://share.weiyun.com/qu2QCm3D
手机端:

中国食管癌发病率有下降趋势,但中国仍是食管癌高发国家,且食管癌发病有明显的地区差异。近年来,中国食管癌的5年生存率有明显提高,但因早期食管癌缺乏典型的临床症状,早期发现率偏低,与发达国家相比还有较大差距。目前国外尚无指南对食管鳞状细胞癌筛查目标人群进行界定,寻找和实施有效的筛查方案和早诊早治是降低食管癌死亡率、提高生存率和生存质量的关键手段。早期食管癌的治疗措施为内镜治疗,包括内镜黏膜下剥离术、内镜下黏膜切除术、内镜下射频消融术等,若肿瘤侵犯程度较深或怀疑有淋巴结转移,需采取手术治疗,同时放射治疗也可作为一种可选择的治疗方式。无论哪种方式的治疗,均需规律随访和监测,积极处理复发性病变和异时性新发肿瘤。中华医学会肿瘤学分会早诊早治学组根据国内外循证医学依据,结合目前中国食管癌治疗的临床实践与应用经验,以多学科诊疗模式为基础,就食管癌的筛查和诊断方案、早期食管癌及癌前病变的内镜和外科处理以及术后监测和辅助治疗等达成专家共识,供临床医师参考。
【关键词】食管肿瘤;早诊早治;专家共识;中国
食管癌的流行病学趋势
食管癌是一种常见的恶性肿瘤。全球范围内,食管癌新发病例数在男性、女性中分别位居恶性肿瘤第7位和第13位,死亡例数在男性、女性中分别位居第6位和第9位,其中,中国发病和死亡人数分别占全球的53.7%和55.3%。我国食管癌发病率存在明显的地区差异,在食管癌高发地区,如河北省磁县、河南省林州市,发病率高达70/10万左右,我国东部地区食管癌的发病率和死亡率分别为19.48/10万和15.64/10万,中部地区为19.34/10万和14.36/10万,西部地区则为18.87/10万和13.88/10万。随着人们生活水平的不断提高以及生活方式的改变,我国食管癌的发病率有降低趋势,目前居城市地区恶性肿瘤发病率第9位(14.24/10万)、死亡率第6位(11.29/10万),农村地区恶性肿瘤发病率第5位(24.42/10万)、死亡率第4位(18.47/10万)。在过去40年里,不同病理类型的食管癌发病率有了很大的变化。北美、欧洲的许多西方国家以及澳大利亚的食管鳞状细胞癌发病率呈现明显的下降趋势,食管腺癌的发病率则有所上升。而在我国和大部分亚洲地区以及撒哈拉沙漠以南的非洲地区,食管癌的病理类型多以鳞状细胞癌为主。
食管癌是预后较差的恶性肿瘤之一。近年来,我国的食管癌患者总体5年生存率有了很大提高,已经达到29.7%,高于美国(20.0%)和德国(20.8%)等发达国家。然而,1项基于2011—2013年国内医院的多中心研究显示,我国食管癌患者确诊时,Ⅰ期患者仅占17.00%,Ⅱ期、Ⅲ期和Ⅳ期患者分别占32.42%,30.27%和20.31%,而同时期日本的Ⅰ期患者占比高达39.9%,表明我国食管癌临床早期诊断率仍然较低。由于食管癌Ⅰ期患者治疗后5年生存率可以达到90%左右,而Ⅲ期和Ⅳ期患者分别为32.80%和26.17%,因此继续推动我国食管癌的早诊早治工作尤为迫切。
食管癌的筛查
早期食管癌缺乏典型的临床症状。患者因进行性吞咽困难或转移性症状就诊时,多已属于中晚期,临床治疗效果不佳且花费大。而在中晚期癌发生之前,存在长达5~10年的癌前状态、癌前病变及早期癌阶段,这为食管癌筛查提供了重要的窗口期。因此,对食管癌高危人群进行筛查和早诊早治,是食管癌防治的重要策略与途径。
(一)筛查人群
目前国外尚无指南对食管鳞状细胞癌筛查目标人群进行界定。国内《上消化道癌筛查及早诊早治技术方案(2020年试行版)》建议将食管癌高发地区40~69岁的人群列为高危人群进行筛查,对于其他食管癌相对低发地区,如果同样开展人群筛查,则需要耗费巨大的医疗和社会资源。因此推荐在食管癌高发地区开展机会性筛查,即将日常内镜门诊诊疗与食管癌筛查相结合,通过食管癌高危因素评估和识别,将符合标准的目标人群列为高危人群进行筛查,以期提高早期病变的检出。
食管癌筛查的高危人群判定标准为≥40岁,并符合下列标准任意1条者:(1)出生或长期居住于食管癌高发地区;(2)患有上消化道癌前疾病或癌前病变[如低级别上皮内瘤变(low-grade intraepithelial neoplasia, LGIN)、Barrett食管];(3)一级亲属有食管癌病史;(4)患有头颈部和(或)呼吸道鳞状细胞癌;(5)具有食管癌高危因素(如重度吸烟、重度饮酒、进食过快、热烫饮食等不良生活习惯,室内空气污染,牙齿缺失)。
(二)筛查目标
食管癌筛查的主要目的是降低人群发病率和死亡率,因此应将早期食管癌和癌前病变作为筛查的主要目标。食管癌的发生发展是一个长期的过程,经过炎症、癌前病变、早期癌逐渐演进至中晚期浸润癌。癌前病变主要指食管鳞状上皮细胞的异型增生,根据细胞异型增生的程度和(或)异型上皮累及的层次,分为LGIN和高级别上皮内瘤变(high-grade intraepithelial neoplasia, HGIN)。2002年消化道肿瘤巴黎分型及2005年巴黎分型标准更新版中,根据肿瘤浸润深度将浅表食管癌进行分期:肿瘤局限于黏膜层为M期(T1a期),浸润至黏膜下层、未达固有肌层为SM期(T1b期);对M期和SM期食管癌又进行细分:病变局限于黏膜上皮层为M1期,浸润至黏膜固有层为M2期,浸润至黏膜肌层但未突破黏膜肌层为M3期,浸润至黏膜下层的上、中、下1/3分别为SM1期、SM2期及SM3期。由于早期食管癌淋巴结转移情况在未行系统性淋巴结清扫的患者中难以确定,因此,可将影像学检查未见明显肿大淋巴结和远处转移的T1a期和T1b期统称为浅表食管癌(cT1期)。
(三)筛查技术方案
1. 初筛方案:20世纪我国曾在食管癌高发区广泛开展食管拉网细胞学检查,但该方法灵敏度低,目前已不再推荐使用。我国学者开展的全基因组关联性研究发现多个食管癌易感位点,但尚难以用于食管癌目标人群的筛查。目前尚无公认的血清学检查方法和分子标志物可用于早期食管癌及癌前病变的筛查。
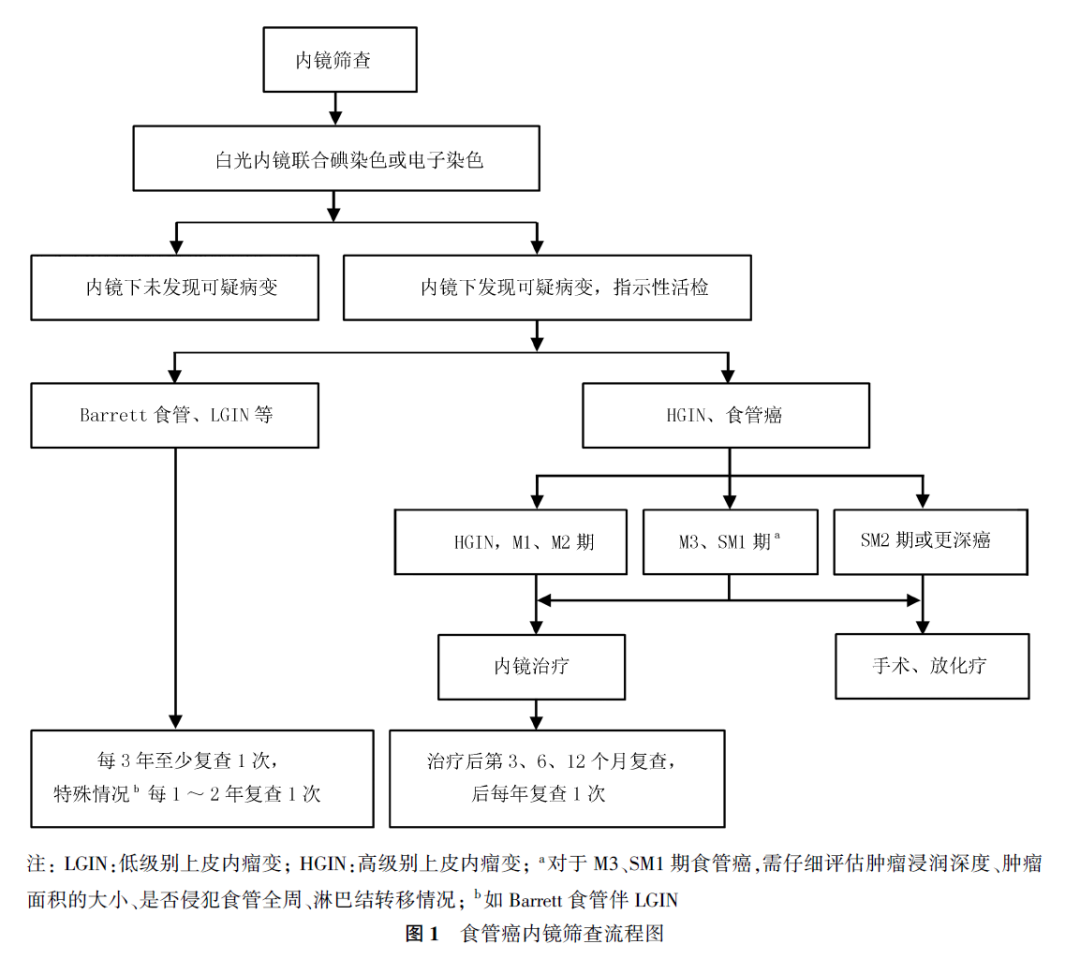
2. 内镜筛查:内镜筛查是发现食管早期病变的有效手段。大量的筛查实践及临床观察均证实,在食管癌高危人群中开展内镜筛查可以发现早期食管癌及癌前病变。内镜下食管黏膜碘染色及指示性活检技术灵敏度高、特异度强,可同时完成筛查及早期诊断。有条件者可予以电子染色内镜、放大内镜(magnifying endoscopy, ME)、共聚焦内镜等检查,以进一步提高早期食管癌及癌前病变的检出率。电子染色内镜包括窄带成像(narrow band imaging, NBI)、蓝光成像、光学增强、聚谱成像和光电复合染色成像技术等。
内镜筛查中如果发现任何食管黏膜可疑病灶,应在相应区域分别咬取组织进行活检,同时强调活检的精准性。所有病变诊断和转归的判定均以组织病理学检查为依据,对发现的HGIN及早期癌患者进行相应治疗。对Barrett食管、LGIN患者,应至少每3年复查1次,特殊情况如Barrett食管伴LGIN时可缩短随访间隔,每1~2年复查1次(图1)。随访时无论内镜下表现是否异常,原诊断病变部位均要活检,新发现病变也需要活检。如果内镜表现比病理活检结果更严重,建议行电子染色内镜或ME等对可疑病变进一步观察,以评估病变情况。
(四)筛查工作实施
1. 筛查工作实施:(1)拓展健康宣教工作,提高大众特别是食管癌高危人群的“三早意识(早发现、早诊断、早治疗)”,提高其对筛查的依从性和配合度;(2)推荐开展筛查工作的医疗单位建立多学科、多科室协调机制,制定工作制度,确定筛查工作流程,组织医务人员进行相关学习和培训,特别要注重对基层医疗卫生人员进行规范化培训;(3)为保证筛查工作顺利实施及达到预期目标,应对筛查各环节进行详细的质量控制,包括制定明确的筛查、治疗及随访方案,定期进行工作考核等。
2. 筛查技术方案推荐:(1)推荐食管癌高发地区筛查对象为年龄40~69岁的目标人群;(2)建议在食管癌低发地区对日常内镜门诊诊疗的患者进行食管癌高危因素评估,将符合标准的目标人群列为高危人群,据此进行食管癌的筛查工作;(3)推荐将内镜下碘染色结合异常区域指示性活检作为早期食管癌及癌前病变筛查的标准方法。
食管癌的早期诊断
(一)内镜检查
上消化道内镜检查结合组织病理学是诊断早期食管癌及癌前病变的金标准。内镜检查应由受过系统训练的内镜医师进行,检查前应详细询问病史和用药史,评判有无禁忌证,禁食6 h、禁水2 h以上,检查前20 min服用祛泡剂及祛黏液剂(如西甲硅油、二甲硅油及链霉蛋白酶等),检查前5 min给予1%利多卡因5 ml或利多卡因胶浆10 ml含服或咽部喷雾麻醉,有条件的地区可使用镇静麻醉。
1. 白光内镜(white light image, WLI):WLI是食管早期病变检查的基础技术。在进镜过程中应仔细观察黏膜色泽、光滑度、蠕动及内腔的形状等,及时冲洗黏液、唾液或气泡。注意对未经内镜摩擦的食管黏膜原始状态及对下咽部和食管胃结合部黏膜的观察,如发现病变,需详细描述其具体部位、范围及形态,同时拍照记录。早期食管癌及癌前病变的WLI表现为黏膜颜色呈斑片状,发红或发白,形态微隆起或凹陷,少数呈完全平坦,表面粗糙,可伴有糜烂或结节样改变,黏膜下血管模糊或消失。早期食管癌及癌前病变的内镜下分型依照2005年巴黎分型标准更新版:早期食管癌及癌前病变(Type 0)分为隆起型(0~Ⅰ)、平坦型(0~Ⅱ)和凹陷型(0~Ⅲ)。0~Ⅰ型又分为有蒂型(0~Ⅰp)和无蒂型(0~Ⅰs)。0~Ⅱ型根据病灶轻微隆起、平坦、轻微凹陷分为0~Ⅱa、0~Ⅱb和0~Ⅱc 3个亚型。0~Ⅰ型与0~Ⅱa型病变的界限为隆起高度达到1.0 mm,0~Ⅲ型与0~Ⅱc型界限为凹陷深度达0.5 mm。通常,T1a期表现为0~Ⅱa型、0~Ⅱb型及0~Ⅱc型,病灶表面光滑或呈规则的小颗粒状;而T1b期表现为0~Ⅰ型及0~Ⅲ型,病灶表面呈不规则粗颗粒状或凹凸不平小结节状。
2. 色素内镜:很多早期食管癌及癌前病变在WLI下表现不明显,影响其检出率,故当前对于食管癌高危人群的内镜检查,原则上必须为色素内镜检查,其中以1.2%~1.5%的碘液染色最为常用。完成WLI观察后,经活检管道插入喷管,自上而下或自下而上从喷管注入碘液,使碘液均匀喷洒在全食管黏膜上,观察食管黏膜染色情况。如果染色不满意,可再喷洒碘液,强化染色。染色后,病变处黏膜异型增生细胞与碘结合减少,呈现不同程度的黄色(不着色);若1~2 min后病灶呈粉红色改变,则高度提示癌性病变(“粉色征”)。“粉色征”在NBI模式下可被强化呈现亮银色,称为“银色征”。这些特征均有助于对病变部位的识别及指示性活检。碘液的刺激会给受检者带来不适,观察完毕后应吸净残余液体,局部喷洒3.2%~3.8%硫代硫酸钠溶液或者2%维生素C溶液,以降低碘液引起的刺激症状。内镜下碘染色结合异常区域指示性活检是目前诊断早期食管癌及癌前病变的标准方法,操作简单,花费低廉,并发症少,染色后可疑区域显示直观,但由于炎症病变也可表现为浅染区,因此诊断早期食管癌特异度较低。
3. 电子染色内镜及ME:有条件时可予以电子染色内镜、ME等检查。其中,NBI联合ME(ME-NBI)临床应用较为广泛,该方法不仅在诊断早期食管癌及癌前病变时准确度和特异度优于WLI,还可以通过观察食管上皮乳头内毛细血管袢(intraepithelial papillary capillary loop, IPCL)异常来判断肿瘤的浸润深度,指导指示性活检,判别内镜微创治疗的适应证与禁忌证。正常黏膜表面的IPCL几乎不可见,当黏膜表面发生异型增生时,NBI模式下病灶呈现为棕色,IPCL形态表现为扩张、延长或扭曲等异常改变。对IPCL的分型推荐采用日本食道协会的AB分型系统(表1)。

4. 内镜活检标本的处理:将展平的黏膜平贴在滤纸上固定,包埋时需注意要将展平的黏膜垂直于包埋盒底面,切片时要求每张玻片含6~8个连续组织片。病理诊断需明确病变性质和类型,即肿瘤或非肿瘤、良性或恶性、癌前病变或癌、癌的组织学类型和组织学分级。食管癌组织学分型参考2019版消化系统肿瘤WHO分类。
(二)超声内镜(endoscopic ultrasound, EUS)
EUS适用于早期食管癌患者,用以评估食管壁层次结构的改变、肿瘤的浸润深度、周围有无异常增大的淋巴结以及有无周围脏器侵犯,推荐在治疗前通过EUS对早期食管癌进行临床分期。对于可疑淋巴结,推荐使用EUS引导下细针穿刺抽吸术,可明显提高诊断准确率。但因超声波穿透力有限,EUS难以用于肿瘤远处转移的评估,推荐结合CT、磁共振成像(magnetic resonance imaging, MRI)、正电子发射计算机体层摄影(positron emission tomography-computed tomography, PET-CT)等影像学检查联合评估早期食管癌的临床分期。
(三)影像学检查
CT是目前进行食管癌临床分期最常用的影像学手段,主要用于判断食管癌位置、浸润深度、肿瘤与周围结构及器官的相对关系、淋巴结转移以及远处转移等情况。推荐行胸、腹部增强CT检查,其中距环咽肌<5 cm的颈段或胸段食管癌推荐加行颈部增强CT检查。如果患者有CT静脉造影的禁忌证,可以考虑行胸部平扫CT结合颈部及腹部(盆腔)超声等。MRI易受心脏、大血管搏动及呼吸运动影响产生伪影,可能影响食管癌的分期,故一般不作为早期食管癌的首选检查。但临床CT检查怀疑肝转移时,推荐行腹部增强MRI以明确是否为肝转移瘤。推荐颈部超声用于两侧颈部及锁骨上区淋巴结转移灶的诊断与鉴别诊断,怀疑颈部淋巴结转移时,可行淋巴结穿刺证实。PET-CT可同时评价病变的解剖结构和代谢功能异常,其在检测食管癌转移方面具有明显优势。当患者存在可疑淋巴结转移或远处转移时,建议行PET-CT检查。
早期食管癌的治疗
(一)癌前病变及cT1N0M0期食管癌的内镜下治疗
1. 内镜治疗的适应证
(1)确定临床分期:推荐内镜治疗前综合应用EUS、CT、MRI等影像学检查以及黏膜下注射是否有抬举征来确定临床分期,排除区域淋巴结转移或远处转移的患者。
(2)按分期划分:食管M1、M2期病变的淋巴结转移率仅为0~5%,术前评估无可疑淋巴结转移为内镜治疗的绝对适应证;M3、SM1期食管癌的淋巴结转移率为10%~20%,术前评估无可疑淋巴结转移为内镜治疗的相对适应证;因SM2、SM3期食管癌淋巴结转移率达19%~56%,不推荐行内镜治疗。
(3)按范围划分:累及食管3/4周以上的食管病变,应充分评估,若行内镜治疗,为预防术后食管狭窄,应尽可能保留正常黏膜;如需环周切除,应向患者充分告知术后狭窄风险、预防措施及替代治疗方案。术前需准确评估环周切除长度,如果切除长度>5 cm,术后顽固性狭窄的风险则高达85%,应慎重考虑;术后应给予口服糖皮质激素等措施预防狭窄。
2. 内镜治疗的禁忌证
(1)患者不同意或不配合;(2)有严重出血倾向;(3)严重心肺功能异常不能耐受治疗;(4)有食管静脉曲张或静脉瘤,无有效的出血预防对策;(5)术前评估有淋巴结转移;(6)已确诊的低分化癌及未分化癌。
3. 内镜治疗方法
(1)内镜黏膜下剥离术(endoscopic submucosal dissection, ESD):ESD可以将病变组织完整切除,有利于术后的病理评估,更好地确定疗效以及是否需要进一步治疗。食管ESD操作步骤依次为:标记病变范围,黏膜下注药,黏膜切开,黏膜下剥离,创面处理。术者操作时需考虑患者体位、食管管壁结构的特殊性等因素,调整预切开位置、黏膜下注射深度、标记时电凝功率等技术参数,以提高治疗效率,减少出血、穿孔等并发症的发生。ESD在切除病灶大小、整块切除率、完全切除率及病灶的复发率等方面均优于其他内镜治疗方法,但技术难度较大,须由有资质的专科医师实施。
(2)内镜下黏膜切除术(endoscopic mucosal resection, EMR):不推荐EMR作为早期食管癌的首选治疗方法,如食管病变长径<2.0 cm,评估可一次整块切除者可以采用EMR切除,作为不具备条件开展ESD技术的医院的备选治疗方法。
(3)内镜下射频消融术(endoscopic radiofrequency ablation, ERFA):ERFA属于内镜下非切除治疗技术,原理为利用电磁波的热效应使组织脱水、干燥和凝固坏死达到治疗目的,其作用均匀、治疗深度可控,降低了穿孔和术后狭窄的发生率,缺点在于无法获得术后样本对病灶进行组织病理学诊断。对早期食管癌及癌前病变散在多发病灶、病变范围较长、累及食管全周不能耐受内镜手术或其他原因放弃手术治疗的患者,在充分医患沟通后可考虑ERFA。
4. 内镜切除标本的规范化处理
标本需充分展平,在标本边缘用不锈钢针固定,标注标本方位,尽快浸泡在4%中性甲醛溶液中,标本须采用一种或多种颜料对基底切缘和侧切缘进行标记。如有条件可采用自动化ESD取材仪或专用取材台。切割前要确定肿瘤距离标本切缘最近的位置,垂直于最近切缘每隔2~3 mm平行切割标本,将分割组织条按顺序放入包埋盒。如肉眼难以识别病灶及其范围,可借助碘液均匀喷洒黏膜面,协助判断病灶范围和边界。标本切割前后需要进行多节点拍照,以便必要时制作病变复原图和病变位置溯源等。规范化的病理报告应包括病变肉眼分类及大小、组织学类型及分级、肿瘤组织生长方式及食管腺导管累及情况、肿瘤组织浸润层次[当肿瘤组织浸润黏膜下层时,应评估黏膜肌破坏状态(摧毁式或渗透式)并测量癌组织浸润深度]、肿瘤出芽分级(适用时)、有无淋巴管或血管侵犯、神经侵犯、两端切缘及基底切缘情况、肿瘤周围食管黏膜情况。
5. 追加治疗原则
遇以下情况之一时,需考虑追加手术治疗或放化疗:(1)肿瘤浸润至黏膜下层深度≥200 μm;(2)切除标本切缘阳性;(3)伴有血管或淋巴管侵犯;(4)切除后诊断为低分化或未分化癌。
6. 内镜切除术后处理及随访
(1)术后处理:治疗后当日禁食,可进水,次日可进流食,逐渐增加食量;给予黏膜保护剂和质子泵抑制剂;治疗后的并发症主要为出血、穿孔和狭窄,处理原则为首选内镜下处理,内镜下难以解决者选择外科手术治疗。
(2)术后随访:在治疗后第3、6、12个月复查,后续每年复查1次。对于多发食管癌灶及食管碘染色多部位不染者,因异时性食管癌发生率高,建议治疗1年后仍持续每6个月复查1次。每次内镜复查应予碘染色,发现可疑病变时予以活检。随访过程中如发现病变残留、局部复发或新发病灶,可再次予以内镜下治疗,治疗失败者可追加外科手术或放化疗。
(二)cT1期食管癌的外科处理
1. 外科手术指征
所有SM2期及浸润更深的患者,所有术前检查高度怀疑有淋巴结转移的患者,所有不适于内镜下切除的浅表食管癌患者,如经术前评估认为可根治性切除且可耐受手术切除,均推荐行手术切除。即使肿瘤为HGIN、T1a或SM1期,但患者希望行食管癌根治术者,内镜下切除术后需追加治疗者,以及出现顽固性狭窄和复发、患者拒绝再次行镜下治疗者,均可手术切除。对于颈段食管癌,环咽肌以下应预留足够的切除吻合长度。
2. 外科术式选择
(1)开放及腔镜辅助下McKeown食管癌切除术:McKeown术式拥有更好的上纵隔视野,使胸腹部淋巴结扩大清扫成为可能,能够进行更大范围的食管切除,同时颈部吻合相对来说更为简单方便,学习曲线较短。近年来,随着腔镜技术的普及,全胸腹腔镜下McKeown食管癌切除术应用越来越多,且被视为传统开放食管癌手术的替代选择。对于初学者,杂交式McKeown食管癌切除术(主要指胸腔镜+开腹手术)学习曲线更短,可在基层医院逐步开展。鉴于食管癌的淋巴结转移特点,推荐所有可切除的食管癌患者行McKeown食管癌切除术,优先推荐全胸腹腔镜McKeown食管癌切除术。
(2)开放及腔镜辅助下Ivor-Lewis食管癌切除术:与McKeown手术比较,Ivor-Lewis手术在兼顾上纵隔淋巴结清扫的同时,可能降低吻合口瘘的发生率,但缺点是食管切除范围有限,有可能影响上纵隔淋巴结,特别是左喉返神经周围淋巴结的清扫高度。另外,胸腔镜下胸内吻合技术难度大,学习曲线长。Ivor-Lewis手术主要适用于无上纵隔淋巴结转移的下段食管癌。
(3)经颈部及膈肌裂孔食管癌切除术(transhiatal esophagectomy, THE):THE的突出优势是不进入胸腔操作,术后心肺并发症发生率较低,因此对心肺功能差、不能耐受单肺通气的患者以及有严重胸膜疾病的患者适用。采用纵隔镜联合腹腔镜食管内翻切除术,可使THE更直观、更安全,而且也可以对食管周围的淋巴结进行一定程度的清扫。由于经纵隔手术术中出血处理困难,患者选择不当可能造成严重后果,建议THE主要用于胸腔广泛致密粘连且肿瘤局限、瘤体较小的早期食管癌患者。
(4)左开胸食管癌切除术:由于左胸入路不能进行完全的胸腹两野淋巴结清扫,因此,除右位主动脉弓畸形或全内脏转位外,左胸入路不宜作为cT1期患者的标准手术入路。当患者存在右胸入路禁忌且影像学提示上纵隔无明显淋巴结肿大时,可考虑经左胸入路行食管癌切除术。
(5)机器人辅助食管癌切除术:近年来,机器人技术发展迅速,其优势是有10倍放大的稳定的3D视野和灵活稳定的操作系统。在术中能够更加清晰地分辨细微的神经、血管及淋巴管结构,有利于细微结构的分离和保护,尤其在淋巴结清扫方面具有突出优势,术后并发症也更少,患者生活质量更高,建议在有条件的医院积极开展。
(6)可采用的替代器官:胃是最常用的替代食管器官,经右胸入路时通常制作成管状胃来替代食管和重建消化道,其次可依据患者情况选择结肠或空肠。
3. 术后辅助治疗
(1)术后辅助化疗:术后是否需要进行辅助化疗需根据术后pTNM分期情况决定。对于pT1N0M0期患者不推荐术后辅助化疗。对于pT1N+M0期的鳞状细胞癌患者,辅助化疗可延长无病生存时间,但对总生存无明显改善。对于腺癌患者,则推荐术后辅助化疗。
(2)术后辅助放疗:对于pT1N0M0期患者不推荐术后辅助放疗。而对于pT1N+M0期患者,术后辅助放疗可能提高生存率。
(3)术后辅助治疗时间:如果患者术后恢复良好,辅助治疗一般在术后4周以后开始;如果患者术后恢复欠佳,可适当延迟辅助化疗,但不宜超过术后2个月;对于高龄(>70岁)患者,要注重个体化治疗。
(4)曾行新辅助放化疗食管癌患者的辅助治疗及维持治疗:对于分期为cT1N+的浅表食管癌患者,推荐术前新辅助放化疗+食管切除术,而术前同期放化疗的长期生存获益是否优于术前化疗尚无定论。新辅助放化疗后,推荐的手术时机是在患者身体条件允许情况下,放化疗结束后4~8周进行。若术后病理学评估显示原发病灶和所有切除淋巴结均无肿瘤细胞残存,即病理完全缓解(pathologic complete response, pCR),推荐进行观察随访;若病理学评估显示存在肿瘤细胞残存(非pCR),无高级别证据显示术后辅助治疗的生存获益,但术后辅助免疫治疗(纳武利尤单抗)可延长无病生存时间。对于腺癌患者,可给予术后辅助化疗。
4. 外科手术切除标本的病理评估
外科手术切除的标本应按照《食管癌诊疗规范(2018年版)》进行规范化处理和报告。病理报告应详细列出与患者治疗和预后相关的所有内容,包括标本类型、肿瘤部位、大体分型、肿瘤大小及数目、组织学类型、亚型及分级、浸润深度、脉管和神经侵犯、壁内转移、周围黏膜情况、新辅助治疗后肿瘤退缩分级、淋巴结情况、环周及两端切缘情况等。推荐病理报告注明pTNM分期。建议注明肿瘤距两端切缘的距离,并采用0、0~0.1 cm及>0.1 cm注明距环周切缘的距离。癌旁组织需描述有无上皮内瘤变或异型增生及程度,是否伴有Barrett食管、食管炎、胃炎及类型。淋巴结转移情况需报告转移癌侵及淋巴结被膜外的数目。
5. 早期食管癌的外科处理推荐
对于胸上段早期食管癌或颈部可疑肿大淋巴结患者,推荐行Mckeown术式并三野淋巴结清扫。如颈部区域无可疑转移淋巴结,则推荐对早期胸中、下段食管癌行胸、腹完全二野淋巴结清扫,即常规胸腹二野+上纵隔区域淋巴结,特别是双侧喉返神经链周围的区域淋巴结清扫。当腔镜手术中因操作造成出血或因组织粘连造成手术难度增大时,出于降低手术风险的考虑可转为传统开胸手术。还应充分考虑患者的主观意愿与价值观,在患者或其家属充分知情的情况下共同进行术式选择。
(三)cT1期食管癌的根治性放疗和放化疗
对于cT1a期食管癌患者,如不能耐受或拒绝行内镜和(或)根治性手术治疗,或有相关治疗禁忌证,可行根治性同期放化疗,放疗剂量为50~60 Gy;不能耐受化疗者,可行根治性放疗,单纯放疗剂量为60~66 Gy。对于肿瘤位置较高或无法行根治手术的cT1b期患者,推荐同期放化疗。cT1a期患者内镜切除后残留或T1b期患者无论是否内镜下切除,均需行追加治疗,可以考虑将放化疗作为保留器官的一种治疗选择。
食管癌根治术术后复发早期监测及治疗
1. 随访:对各分期食管癌手术后无肿瘤残留的患者均应规律随访,以期尽早发现复发和(或)异时性新发肿瘤,并通过及时干预改善患者长期生存。随访内容包括:(1)病史及体格检查;(2)胸、腹部增强CT检查,颈段或胸段食管癌距环咽肌<5 cm者建议行颈、胸、腹部增强CT检查;(3)内镜随访;(4)颈部超声;(5)对已有或怀疑有复发及远处转移的患者,可考虑行PET-CT检查。
2. 随访频率:术后2年内每3~6个月复查1次,术后第2~5年每6个月复查1次,5年后每年复查1次。
3. 处理措施:术后患者如有症状或通过其他检查发现可疑吻合口或胸腔胃复发,建议行内镜检查以明确诊断。上消化道造影不作为常规检查手段,可用于有相关吞咽不适症状的患者。如果造影发现吻合口近端食管新发病变、吻合口狭窄或充盈缺损,需要行内镜检查。目前常用于食管癌预后判断的肿瘤标志物有细胞角蛋白19片段、癌胚抗原、鳞状上皮细胞癌抗原、糖类抗原19-9等,可提高随访观察的准确性,但对早期食管癌灵敏度较低,不推荐作为常规检查手段。液体活检技术有望成为治疗监测和预后评估的新手段,主要包括循环肿瘤细胞、循环肿瘤DNA及其全基因组或全外显子组高通量测序分析,对于无法进行传统活检的患者,可以考虑行液体活检,但是仍需要更多高级别循证医学证据来支持其临床应用价值。
4. 早期发现局部转移灶的治疗:对于可手术切除的患者,如果复发部位未接受过放疗,建议行根治性放化疗或根治性手术;如果接受过放疗,建议行挽救性手术或化疗。对于不可手术切除的患者,如果复发部位未接受过放疗,建议行化放疗(同期或续贯)或放疗;如果复发部位接受过放疗,建议行化疗或放化疗。
本刊出版日为每月23日,网站和数据库更新有时间差。附件链接易失效,欢迎正式出版后下载全文:
1. 机构用户IP:中华医学期刊全文数据库(http://www.yiigle.com/)右上角IP登录,正常检索/查看/下载即可
2. 个人帐号:绑定中华医学期刊机构用户后,直接登录本刊官网(http://www.chinjoncol.com/)检索/查看/下载全文(通过万方、知网检索也将跳转至本刊官网)
3. 年卡或单期购买用户:详询中华医学期刊网会员服务
4. 纸质版期刊订阅:中国邮政网上营业厅(https://11185.cn/)检索“中华肿瘤杂志”在线订购,或到全国各地邮局订阅,邮发代号2-47。需提前预定。

免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate











 苏公网安备32059002004080号
苏公网安备32059002004080号


