编译者:血液科那条鱼
急性早幼粒细胞白血病(APL)在临床上较为罕见,可导致致命性凝血功能障碍,预后较差。目前,APL病理生理机制已基本探明,而且患者可经靶向治疗实现治愈。20世纪70年代,基于蒽环霉素类的治疗方案进入公众视野,随后于1985年引入维甲酸和1994年引入三氧化二砷,均提高了疾病治愈率。近年来的研究表明,超过90%的患者可实现治愈,治疗周期不超过5年,而且不伴基于DNA损伤化疗药物的维甲酸联用三氧化二砷方案越来越受到青睐。
与其他类型癌症不同的是,APL发病率并不随着年龄增长而增长,提示遗传因素是诱发疾病的重要方面,其中PML-RARA基因易位和融合在APL细胞中最为常见,其他还包括NRAS突变,FLT3激活和MYC过表达。
体内和体外的试验表明,维甲酸可促使APL细胞分化成粒细胞(如图1所示)。临床研究表明,患者经维甲酸治疗需维持3-5周,但大多数为一过性症状缓解,仅少部分可经维甲酸治愈,而维甲酸与蒽环类药物联用后,治愈率可提高至70%。需要注意的是,维甲酸和三氧化二砷均可诱发分化综合征。
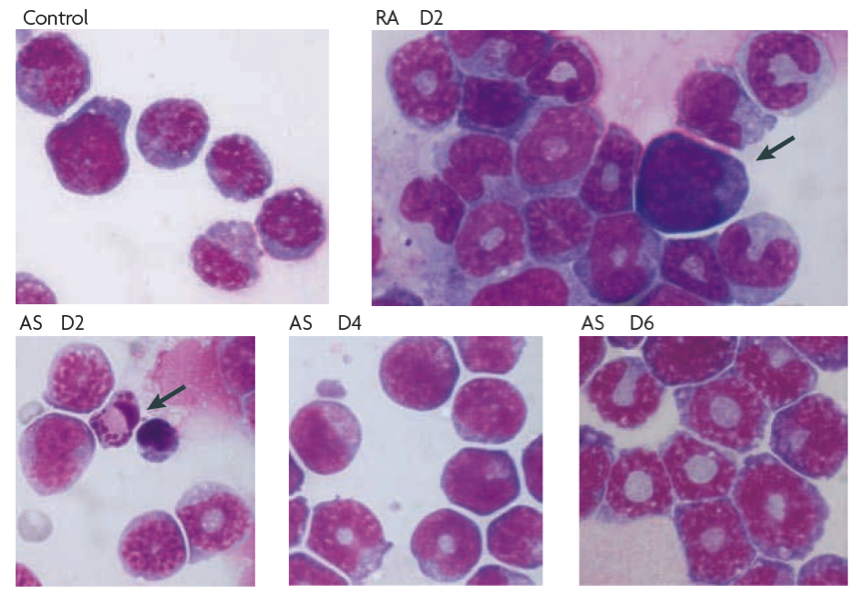
图1.经维甲酸和三氧化二砷诱导后出现变化的小鼠APL细胞。可见与对照组相比,维甲酸可迅速促进细胞分化,并呈正常细胞形态(箭头所示)。三氧化二砷诱导APL细胞在第2天出现细胞凋亡(箭头所示),在第6天呈部分分化。
APL的发病机制模型
目前观点认为,由于RARA信号通路可以介导髓系分化,PML-RARA融合蛋白保留了RARA和PML基因的所有功能结构域,可通过RARA靶向基因的转录抑制,因此可影响造血干细胞的生理功能(如图2所示)。
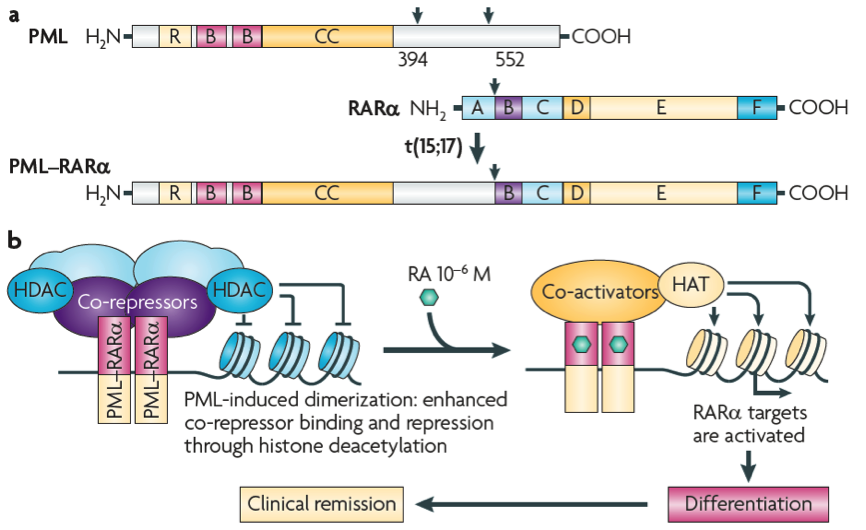
图2.APL发病机制的经典模型。A为PML蛋白、RARA蛋白和PML-RARA融合蛋白。B为PML-RARA同源二聚体通过增强偕同抑制作用,结合并抑制RARA靶向基因。而维甲酸将PML-RARA转变为活化因子,恢复细胞分化功能,实现临床症缓解。
而维甲酸可以将PML-RARA转变成转录活化因子,因此可增强RARA靶向基因的表达,恢复正常的细胞分化功能。近年来的研究对数个PML-RARA融合基因的关键特征进行辨别,并因此丰富了APL的发病机制模型(如图3所示)。
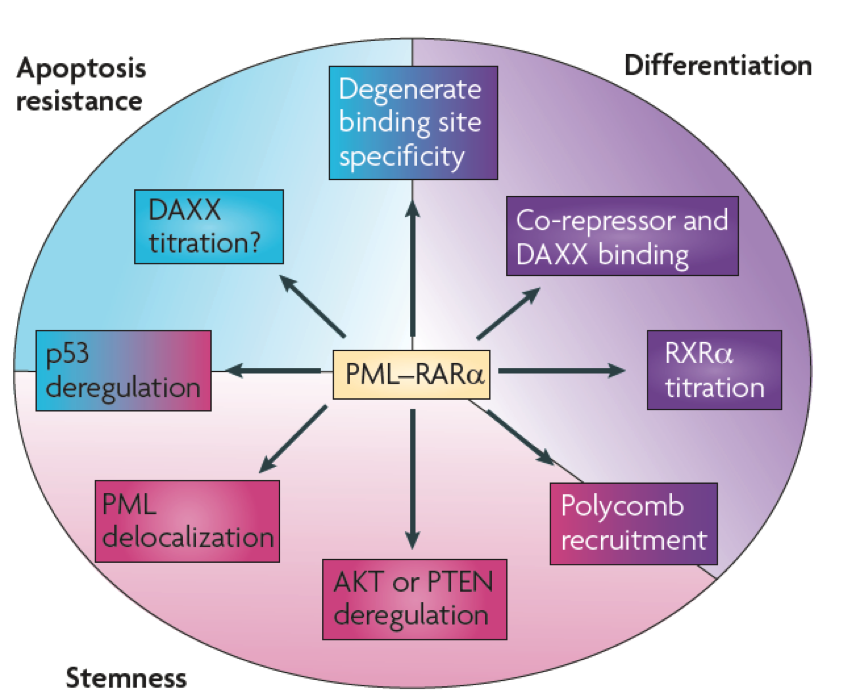
图3. PML-RARA的生理功能,主要为抑制髓系细胞的细胞分化和自我更新和抑制细胞凋亡。
治疗诱发性PML-RARA蛋白水解
PML-RARA融合基因可表达一类多能融合蛋白,调节许多关键的细胞通路,从而诱发白血病,而维甲酸和三氧化二砷均可以起到降解作用。
目前研究认为PML-RARA有3种途径,第一种,维甲酸诱导的细胞分化激活某种蛋白酶,进而切除PML-RARA融合基因中PML基因部分,启动PML-RARA降解通路。第二种,降解通路直接将维甲酸诱导的转录活化与蛋白酶体介导的RARA降解相结合,该通路在原始细胞中较为活跃,可以解释RARA的维甲酸诱导降解和所有APL相关的RARA融合。第三种降解途径涉及到自噬小体的形式。近年来的研究发现,通过化学生物学方法可以对RARA和PML-RARA结构起到稳定作用的分子进行探测,而这将会成为体内检测某些靶向药物疗效的有效工具。
相比之下,三氧化二砷降解PML-RARA是以PML部分为靶点,同时降解正常的PML蛋白。三氧化二砷首先在降解之前,诱导核质中的PML或PML-RARA进入核小体。其机制涉及到2方面,一方面三氧化二砷诱导生成活性氧(ROS),导致PML分子间以二硫键形式相互聚合,继而在泛素缀合酶9(UBC9)作用下造成PML类泛素化。
另一方面,三氧化二砷直接结合PML半胱氨酸,促使UBC9与PML环指(RING finger)区域结合,导致PML类泛素化(如图4所示)。SUMO结合的PML与PML的SUMO结合域之间的分子作用力促使核小体形成,然而在UBC9阳性细胞中,PML类泛素化并不是形成核小体的必要因素。
因此,PML多聚体和三氧化二砷结合,以及随后的PML泛素化降解,共同构成了三氧化二砷可治愈APL的基本药理机制。此外,cAMP还能促APL和非APL细胞对维甲酸诱导的分化作用更为敏感 ,可对基因上维甲酸耐受的许多细胞系起到逆转作用。cAMP提高治疗诱导的PML-RARA降解,促进APL根除。
什么是早幼粒细胞白血病锌指结构(PLZF)-RARA调控型APL?
PLZF-RARA调控型APL为一类罕见易位类型,占APL总数的1-2%,可对维甲酸治疗耐受,系PLZF出现额外的共抑制结合位点、抑制维甲酸靶向基因活性所致。
与PML-RARA APL相比,PLZF-RARA表达阳性的白血病干细胞对维甲酸的敏感性更低,因此在治疗过程中应采用高剂量维甲酸,以达到PLZF-RARA降解水平。而白血病干细胞对维甲酸的耐受,或可是由PLZF-RARA高表达或稳定性、MYC高表达、或PRC1致染色质不可逆改变所致。
小结
通过近25年来的临床和基础研究,目前可使大部分APL患者实现治愈。维甲酸与三氧化二砷联用的一线治疗方案不仅提高了疾病治愈率,还可保证患者的生活质量,缩短患者住院时间。然而存在的问题就是,在部分国家,三氧化二砷的治疗价格过于昂贵,从而增加了治疗成本。
在疾病的病理生理机制探究上,近年来的结果表明,诱导分化疗法在APL治愈上仍有不足,然而PML-RARA降解仍是治愈APL的关键。目前还尚未探明PML-RARA诱发白血病干细胞自我更新和移植髓系分化的关键基因。此外,肉瘤或其他类型白血病中的融合蛋白亦可作为APL治疗的潜在靶点。对于慢性髓系白血病,三氧化二砷诱导BCR-ABL1融合基因实现降解和泛素化,被认为可以在治疗上与伊马替尼产生协同作用。
I型人类T淋巴细胞白血病病毒(HTLV-1)TAX反式激活因子是HTLV-1相关性成人T细胞白血病(ATL)的驱动致癌基因,降解TAX癌蛋白的治疗策略在ATL患者中体现出满意效果。许多抗雌激素可降解雌激素受体-α,而该受体在某些类型乳腺癌增殖中表现出超活化作用。因此,癌蛋白降解或可作为常规治疗策略,应用于融合蛋白并不是肿瘤增值驱动因子的肿瘤治疗上。
责任编辑:Dr.q
欲了解更多血液肿瘤、淋巴瘤相关资讯,与全国各地血液肿瘤、淋巴瘤医生交流与讨论,请扫描以下二维码,添加肿瘤资讯小助手-Dinna微信,备注“血液肿瘤”!
参考文献
Acute promyelocytic leukaemia: novel insights into the mechanisms of cure.
Nat Rev Cancer. 2010 Nov;10(11):775-83. doi: 10.1038/nrc2943. Epub 2010 Oct 22.
http://www.nature.com/nrc/journal/v10/n11/full/nrc2943.html














 苏公网安备32059002004080号
苏公网安备32059002004080号


