备受瞩目的2020年美国临床肿瘤学会(ASCO)年会于5月29~31日在线上召开,新冠疫情虽然改变了会议形式,但没有改变医学工作者交流学习的热情。本届会议上依旧是新研究结果频出,尤其一些少见或是难治肿瘤的诊疗取得了很多突破性进展,晚期不可切除肝癌就是其中最大的亮点之一。【肿瘤资讯】撷取了不可切除肝癌诊疗中最具代表意义的3项研究结果,与您一同分享。

【摘要4585】网状meta分析:阿替利珠单抗联合贝伐珠单抗一线治疗肝细胞癌完胜现有治疗[1]
靶向治疗索拉非尼和仑伐替尼是晚期肝细胞癌(HCC)的一线标准治疗,近两年来,免疫治疗也已进入肝癌领域,但靶向和免疫治疗单药使用的疗效还是相对有限。基于基础研究显示的协同作用,免疫和靶向联合治疗已成为当前的研究热点并取得了非常有前景的成果。如IMbrave150研究中,阿替利珠单抗联合贝伐珠单抗与索拉非尼头对头比较用于晚期HCC的一线治疗,取得了无进展生存(PFS;中位PFS 6.8个月vs 4.3个月,HR=0.59,P<0.0001)和总生存(OS;中位OS 未达到vs 13.2个月,HR=0.58, P=0.0006)的双重获益,降低死亡风险42%,降低疾病进展风险41%,“T(阿替利珠单抗)+A(贝伐珠单抗)”疗法因此获FDA批准用于治疗晚期不可切除HCC,并获得中国国家药监局优先审评资格。本次ASCO大会上,德国、英国、美国、瑞士、法国、中国和意大利的多位专家联手进行了一项网状meta分析,旨在进一步明确“T+A”疗法一线治疗晚期HCC的临床价值。结果显示,阿替利珠单抗联合贝伐珠单抗一线治疗晚期不可切除HCC,无论与靶向还是免疫单药相比,患者OS和PFS均显著获益。
通过系统性文献回顾,研究者挑选出在未经系统治疗的成人局部晚期或转移性HCC患者中开展的随机对照研究,自2007年索拉非尼上市后,所有获批的HCC治疗只要是作为一线治疗的研究均符合纳入标准。对8783份记录筛选后纳入了55项研究,其中9项研究符合证据网络。从已发表的研究中提取OS和PFS的风险比(HR),IMbrave150、REFLECT和CheckMate 459研究的入组人群相似,可以比较。
结果显示,阿替利珠单抗+贝伐珠单抗的OS改善优于仑伐替尼(HR=0.63,阿替利珠单抗+贝伐珠单抗优于仑伐替尼的概率为93.7%),阿替利珠单抗+贝伐珠单抗的OS改善优于纳武利尤单抗(HR=0.68,阿替利珠单抗+贝伐珠单抗优于纳武利尤单抗的概率为90.3%),阿替利珠单抗+贝伐珠单抗的OS改善优于索拉非尼(HR=0.58,阿替利珠单抗+贝伐珠单抗优于索拉非尼的概率为97.6%)。见表1。
表1.阿替利珠单抗+贝伐珠单抗分别与仑伐替尼、纳武利尤单抗、索拉非尼单药间接比较OS结果
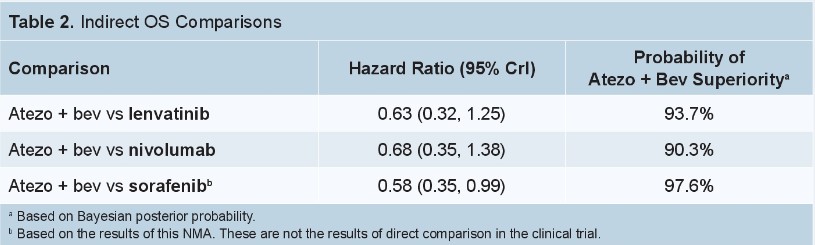
阿替利珠单抗+贝伐珠单抗的PFS改善优于仑伐替尼(HR=0.91,阿替利珠单抗+贝伐珠单抗优于仑伐替尼的概率为61.5%),阿替利珠单抗+贝伐珠单抗的PFS改善优于纳武利尤单抗(HR=0.63,阿替利珠单抗+贝伐珠单抗优于纳武利尤单抗的概率为85.5%),阿替利珠单抗+贝伐珠单抗的PFS改善优于索拉非尼(HR=0.59,阿替利珠单抗+贝伐珠单抗优于索拉非尼的概率为92.3%)。见表2。
表2. 阿替利珠单抗+贝伐珠单抗分别与仑伐替尼、纳武利尤单抗、索拉非尼单药间接比较PFS结果
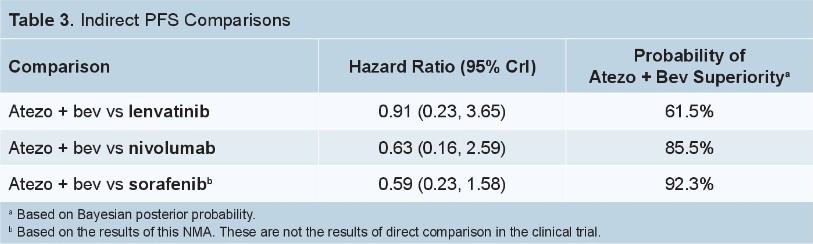
阿替利珠单抗+贝伐珠单抗与仑伐替尼的安全性相似。见表3。
表3. IMbrave150与REFLECT研究的安全性结果
该研究提示,与其他获批用于不可切除HCC的治疗相比,一线阿替利珠单抗+贝伐珠单抗治疗的OS和PFS获益更多且安全性可控,进一步支持“T+A”疗法的一线临床应用。
【摘要4596】IMbrave150:阿替利珠单抗联合贝伐珠单抗,CR不受临床不良预后因素和病因影响[2]
上述网状meta分析明确显示,阿替利珠单抗联合贝伐珠单抗一线治疗晚期不可切除HCC,患者生存获益最多,那么这些获益是否会受某些因素影响呢?本次ASCO大会上,一项针对IMbrave150研究的进一步分析完美地解答了这个问题。研究者通过对IMbrave150研究中获得完全缓解(CR)患者的基线特征分析发现,阿替利珠单抗联合贝伐珠单抗治疗的疗效不受预后不良因素或是病因的影响,疗效更可能与免疫治疗的作用机制相关。
IMbrave150研究中,由独立评审中心(IRF)按RECIST 1.1标准评估,阿替利珠单抗+贝伐珠单抗组的客观缓解率(ORR)为27%,18例(6%)患者获CR,索拉非尼组ORR为12%,CR为0;根据IRF-mRECIST标准评估,阿替利珠单抗+贝伐珠单抗组ORR为33%,有33例(10%)患者获CR,索拉非尼组ORR为13%,有3例(2%)CR患者。CR患者的基线特征列于。见表4。
表4.CR患者的基线特征

结果提示,初治不可切除HCC患者采用阿替利珠单抗+贝伐珠单抗治疗,能否获得CR与不良预后因素和病因无关。此外这项研究还显示,阿替利珠单抗+贝伐珠单抗组的ORR和CR率均明显优于索拉非尼组,6个月时大部分CR患者仍处于CR状态,中位CR持续时间仍未达到。
【摘要3531】GO30140:动态监测ctDNA可预测阿替利珠单抗联合贝伐珠单抗治疗HCC的治疗反应[3]
一直以来,如何筛选免疫治疗获益人群,减少不获益人群的治疗曝露,是免疫治疗研究领域的热点与重点。GO30140研究采用最具前景的循环肿瘤DNA(ctDNA)动态监测作为预测阿替利珠单抗联合贝伐珠单抗治疗不可切除HCC疗效的指标,结果提示循环肿瘤DNA由阳性转为阴性患者的治疗反应更优,生存更优。
GO30140为多臂多瘤种研究,其中A组为104例HCC患者,接受阿替利珠单抗+贝伐珠单抗治疗,有48 例纳入本分析。IRF根据RECIST 1.1标准评估,10例CR,11例部分缓解(PR),12例疾病稳定(SD),15例进展(PD)。收集如下时间段血浆标本:基线第1周期(C1)第1天(D1)、治疗期间C2D1和C4D1、疾病进展时。收集治疗前肿瘤组织或新鲜活检标本,采用全外显子测序测定肿瘤体细胞突变。通过动态ctDNA对47/48例患者的肿瘤突变特征进行个体化的分析(SignateraTM16-plex multiplex PCR下一代测序)。
C1D1时2ml血浆标本中可抽提到中位值25.7ng的游离DNA(cfDNA),45/47例(96%)患者检测到ctDNA,血浆中位平均肿瘤分子为70.6MTM/ml,中位平均变体等位基因频度(平均VAF)1.8%。
C1D1时更高水平的ctDNA与肿瘤负荷增加相关,PD患者的基线ctDNA水平较CR患者增加,治疗后ctDNA水平的动态变化与C4D1时的治疗反应相关,多数治疗获缓解患者在C4D1时不能检测到ctDNA或ctDNA减少,其中7/10 CR(70%)、3/11 PR(27%)、1/11 SD(9%)和0/12(0) PD患者的ctDNA状态由基线时的阳性转为阴性,疾病进展时ctDNA水平较基线或最低值增高,早在C2D1时ctDNA更低患者的PFS和OS即表现为更长,治疗后不能检测到ctDNA的患者的PFS和OS更长,C4D1时ctDNA阳性和阴性患者的中位PFS分别为6.54个月和未达到(HR=0.08, P<0.000292),OS均尚未达到。见图1。
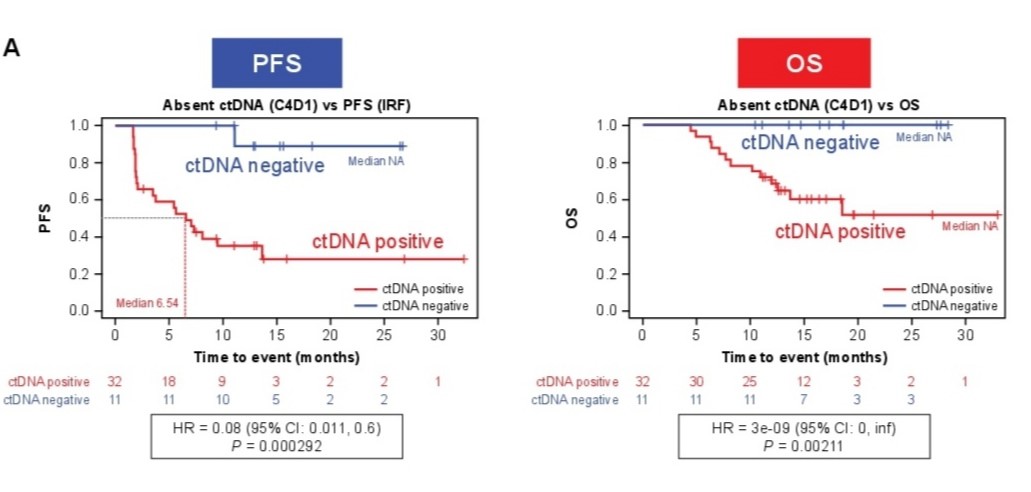 图1. 治疗后ctDNA阴性和阳性患者的PFS和OS
图1. 治疗后ctDNA阴性和阳性患者的PFS和OS
这项研究表明,ctDNA是一种非常有前景的生物标志物,可能有助于监测HCC患者的治疗反应和疾病进展。
总结
阿替利珠单抗是免疫治疗的代表药物,贝伐珠单抗是抗血管生成药物的翘楚,二者分别代表着目前肿瘤治疗领域最具实践意义的两种治疗手段,其联合治疗肝癌产生了1+1>2的疗效并不意外,免疫治疗独特的作用机制以及抗血管生成治疗对免疫微环境的调节作用,使得二者联合治疗疗效突破了肝癌传统预后不良因素的限制亦在情理之中。因此阿替利珠单抗联合贝伐珠单抗治疗正在改变晚期不可切除肝癌的治疗格局,为患者带来更长生存和更好生活质量。随着对优势获益人群的甄别和疗效预测预后生物标志物的探索,相信这一治疗的临床应用会越来越成熟,也期待TA组合继FDA获批之后早日在中国上市惠及更多中国患者,为肝癌患者带来更多希望。
[1] Vogel A, Rimassa L, Sun H C, et al. Clinical value of atezolizumab + bevacizumab for first-line unresectable hepatocellular carcinoma (HCC): A network meta-analysis. 2020 ASCO, abstract 4585.
[2] Finn R S, Qin S K, Ikeda M, et al. Complete responses (CR) in patients receiving atezolizumab (atezo) + bevacizumab (bev) versus sorafenib (sor) in IMbrave150: A phase III clinical trial for unresectable hepatocellular carcinoma (HCC). 2020 ASCO, abstract 4596.
[3] Hsu C H, Lu S, Abbas A, et al. Longitudinal and personalized detection of circulating tumor DNA (ctDNA) for monitoring efficacy of atezolizumab plus bevacizumab in patients with unresectable hepatocellular carcinoma (HCC). 2020 ASCO, abstract 3531.
排版编辑:Dylan











 苏公网安备32059002004080号
苏公网安备32059002004080号


