受全球COVID-19疫情影响,美国癌症研究协会(AACR)今年决定不举办线下年会,改为两次AACR在线年会。美国东部时间2020年4月27-28日,AACR在线年会Ⅰ隆重召开。在乳腺癌治疗专场,多项临床进展百花齐放。

CT071:Talazoparib(TALA)用于gBRCA1/2突变HER2阴性晚期乳腺癌的Ⅲ期临床研究(EMBRACA)最终OS结果
EMBRACA研究既往结果证实,TALA对比研究者选择的化疗,可以显著改善gBRCA1/2突变HER2阴性晚期乳腺癌患者的PFS(HR 0.54 [95% CI 0.41-0.71]; P < 0.001)和患者报告的结局(PRO)。本次报道最终OS结果(次要终点)。
在当前这项研究中,患者随机2:1分配接受TALA或化疗。采用分层Cox回归模型(治疗作为协变量)分析OS HR,采用分层log-rank检验计算P值。
共431例患者参与随机(287例TALA/144例化疗),412例患者接受治疗(286例TALA/126例化疗)。截至2019年9月30日,共观察到TALA组216例患者死亡(75.3%),化疗组108例患者死亡(75.0%)。两组的中位随访时间分别为44.9个月和36.8个月。OS HR为0.85(95% CI 0.67-1.07; P = 0.17);接受TALA治疗的患者24、36和48个月的生存概率更高(表1)。根据既往是否接受过铂类药物治疗以及激素受体状态进行亚组分析,各个亚组患者的OS结果一致。大多数患者在研究药物之后接受了相关治疗:化疗组患者中,32.6%接受了进展后的PARP抑制剂治疗,TALA组相关患者比例为4.5%。3-4度不良事件发生率,在TALA组和化疗组分别为69.6%和64.3%。因为不良事件导致治疗终止(排除疾病进展)的患者分别为5.9%和8.7%。延长随访观察到TALA组对比化疗组有统计学意义的总体改善,包括延缓生活质量恶化以及乳腺相关症状恶化时间(P值均< 0.01),与最初的生活质量数据分析一致。
表1:OS数据以及研究后治疗(ITT)
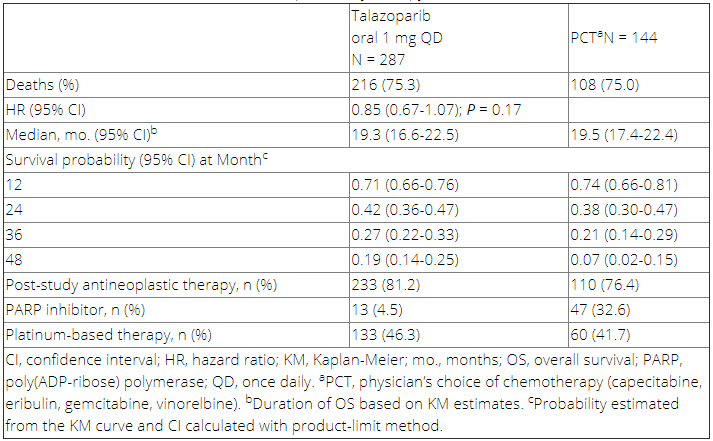 研究结果显示,在gBRCA1/2突变的HER2阴性晚期乳腺癌中,TALA相比于研究者所选择的化疗并不能显著改善OS(HR 0.85; 95% CI 0.67-1.07; P = 0.17),本次分析未校正后续治疗。TALA总体耐受性较好,未观察到新的不良事件。患者报告的数据提示TALA组更优。
研究结果显示,在gBRCA1/2突变的HER2阴性晚期乳腺癌中,TALA相比于研究者所选择的化疗并不能显著改善OS(HR 0.85; 95% CI 0.67-1.07; P = 0.17),本次分析未校正后续治疗。TALA总体耐受性较好,未观察到新的不良事件。患者报告的数据提示TALA组更优。
CT072:肿瘤BRCA杂合性和基因杂合性缺失(gLOH)对Talazoparib(TALA)治疗gBRCA1/2突变HER2阴性晚期乳腺癌的影响(EMBRACA Ⅲ期临床研究)
涉及同源重组修复相关的基因若发生功能缺失突变,如BRCA1/2突变,或将影响到与肿瘤对PARP抑制剂的敏感性。EMBRACA研究证实,PARP抑制剂Talazoparib(TALA)对比研究者选择的化疗,用于gBRCA1/2突变的HER2阴性晚期乳腺癌,可以显著延长PFS(研究主要终点)(HR 0.54 [95% CI 0.41-0.71], P < 0.001)。
在当前这项研究中,研究人员通过FoundationOne CDx对ITT人群中的308例(71%)患者的肿瘤标本(原发灶或转移灶)进行基因检测。分析致病性的单核苷酸变异、插入、缺失或重排。其他探索性研究涉及对同源重组缺陷相关的基因特征的分析,以及对体细胞-胚系-杂合性(SGZ)与基因杂合性缺失(LOH)的分析。
在308例可评估的患者中,296例(96%)观察到≥1个肿瘤BRCA突变,BRCA1和BRCA2突变表现为互斥,仅4例/308例(1%)患者同时携带BRCA1和BRCA2突变。12例患者未观察到明显的BRCA突变,7例患者表现为肿瘤BRCA拷贝数变化,认为与致病性相关,2例患者表现为致病性未明的BRCA单核苷酸变异。236例BRCA突变患者中,195例(83%)可以评估BRCA LOH状态,并通过SGZ分析BRCA LOH。研究采用Cox比例风险模型,对122例携带BRCA LOH和27例未携带BRCA LOH患者进行比较,探索性分析了肿瘤BRCA突变杂合性对TALA治疗PFS的影响。这一分析未观察到两类患者的PFS有显著差异(HR 1.152 [95% CI 0.680-1.951]; P = 0.597)。总体人群中,gLOH评分不等,大多数表现为高评分,TALA组和化疗组的gLOH评分中位数(范围)分别为21.8%(0.0, 52.7)和20.5%(0.2, 40.5)。研究同时探索了gLOH评分与疗效的相关性。在两组患者中,取得临床获益(CR、PR或SD≥24周)和未取得临床获益患者,gLOH评分无显著差异 (P值分别为0.976和0.492)。在两组患者中,gLOH评分≥中位数与gLOH评分小于中位数的患者相比,PFS也无显著差异,TALA组PFS HR为1.247 [95% CI 0.828-1.879];化疗组PFS HR为1.238 [95% CI 0.693-2.211]。
研究结果显示,基于gBRCA突变状态,我们可以有效的筛选可从PARP抑制剂治疗中潜在获益的HER2阴性晚期乳腺癌患者。与此同时,肿瘤BRCA杂合性和gLOH并不影响gBRCA突变亚组患者中的治疗结局。研究将会继续进行其他探索性分析。
CT073:帕博利珠单抗联合新型免疫激动剂Imprime PGG治疗二线或以上转移性三阴性乳腺癌,疗效颇具前景
免疫检查点抑制剂单药用于转移性三阴性乳腺癌(mTNBC)显示出一定的临床获益,尤其是用于二线或以上患者(ORR ~5-6%, mOS 9个月)。近期发布的Ⅲ期Keynote-119研究在二线或三线化疗耐药的mTNBC患者中也显示出较好的疗效,帕博利珠单抗单药取得9.9个月的中位OS,9.6%的ORR,对比研究者选择的化疗,中位OS为10.8个月,ORR为10.6%。Imprime PGG(Imprime)是靶向Dectin受体的β-葡聚糖激动剂,可以激活免疫系统重新编码免疫抑制性肿瘤微环境,激活抗原提呈细胞并刺激抗原特异性T细胞活化。在临床前模型中,Imprime能够显著增强免疫检查点抑制剂的抗肿瘤疗效。基于此,本研究旨在探索Imprime用于mTNBC患者二线或以上治疗,是否可以增强免疫检查点抑制剂帕博利珠单抗的疗效。
IMPRIME 1是一项开放、Simon 2 阶段研究(阶段1入组12例患者,阶段2入组32例患者),研究于2019年12月完成入组。患者接受Imprime(4 mg/kg IV,第1, 8, 15天用药,每3周一个周期)联合帕博利珠单抗(200 mg,每个周期第1天用药)方案。分别在基线,治疗每6周进行一次CT扫描,直至疾病进展。主要研究终点为ORR(RECIST v1.1标准)和安全性。次要终点包括PFS和OS。进行组织活检,采集外周血标本,评估免疫活化状态。从机制上而言,Imprime介导的免疫细胞活化需要抗β-葡聚糖抗体。因此,研究要求入组患者有足够的ABA IgG (≥20mcg/ml)。
表2:Imprime 1研究临床疗效数据
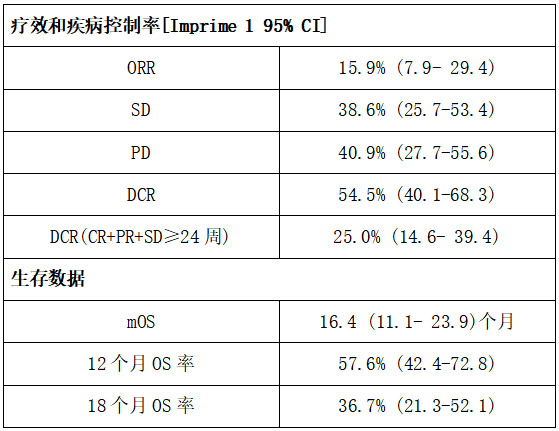
研究结果显示,在既往接受过内分泌治疗的mTNBC(既往为ER/PR+患者)中观察到更为明显的临床获益。在治疗3周后,就观察到外周血标本显示出免疫活化(如循环单细胞CD86水平升高)和CD8 T细胞活化(PD1+/Ki67+/HLA-DR+)。这些改变与更好的PFS和OS相关。配对肿瘤标本显示出较多的活化髓系细胞(Imprime+/PD-L1+/CD80+)以及活化的CD4、CD8 T细胞(Ki67+/granzyme B+)浸润。联合方案的耐受性好。在44例患者中,3例观察到3/4度不良事件。最常见的不良事件为输液相关不良反应,多为1-2度。
IMPRIME 1研究结果表明,Imprime联合帕博利珠单抗能够为当前研究患者带来分子和临床获益。这一有前景的数据,支持后续继续在mTNBC患者中进行这种新型免疫联合治疗临床研究。
CT074:原发ESR1突变与早期乳腺癌内分泌耐药和更差的预后有关
超过3/4的乳腺癌为雌激素受体α(ERα,由ESR1基因编码)阳性型,而ER状态也是抗雌激素内分泌治疗最重要的预测因子。ESR1突变是介导内分泌耐药的机制,在既往接受过内分泌治疗的转移性乳腺癌中,ESR1突变率达到12-55%,但ESR1突变在原发性乳腺癌中的疗效预测价值未知。
基于SCAN-B研究,当前这项研究分析了3217例真实世界、早期原发性乳腺癌病例(NCT02306096)。在患者未开始任何治疗之前获取组织标本,采用RNA测序分析ESR1突变。并采用SAGAsafe ddPCR验证突变。
研究结果表明,在30例(0.9%)患者中发现ESR1耐药突变,其中29例(1.1%)为ER阳性。在ER阳性的病例中,ESR1突变与更差的RFS和OS显著相关(p值分别为0.011和0.019)。此外,在接受内分泌治疗的患者中,ESR1突变同样与更差的RFS和OS相关(p值分别为0.007和0.010)。
当前研究结果提示,在未经治疗的原发性乳腺癌中,ESR1突变非常罕见,但研究结果首次证实原发ESR1突变可用于预测辅助内分泌治疗的耐药。若这一研究的结果后续得到验证,则可以考虑在ER阳性原发性乳腺癌患者中进行ESR1突变筛查。若存在该种突变,可以考虑选择ER受体下调剂,如氟维司群等治疗。
CT075:禁食模拟饮食法(FMD)联合内分泌治疗可通过调节代谢因子促进乳腺癌患者肿瘤消退,并降低治疗副作用
乳腺癌是女性最常见的恶性肿瘤,全球每年有170万新发确诊患者,并有超过45万的患者死于乳腺癌。2/3的乳腺癌患者表达雌激素或孕激素,推荐接受内分泌治疗。内分泌治疗在大多数患者中有效,但也会引发耐药,产生副作用,限制了其应用。生长因子信号通路PI3K/AKT/mTOR和MAP激酶信号途径能够增强ER活性,并且介导内分泌耐药。仅饮水的禁食法或仅摄取蔬菜的低卡路里、低碳水化物、低蛋白的禁食模拟饮食法(FMD)可以降低循环生长因子,如胰岛素和IGF1的水平。
基于此,当前这项研究假定利用饮食干预可以增强内分泌治疗活性,并且延迟耐药的发生。在体外实验中,研究者采用HR阳性乳腺癌细胞系(MCF7、T47D以及ZR-75-1)以及HR阳性乳腺癌患者转移灶类器官模型进行试验。同时采用人乳腺癌细胞鼠转移瘤模型进行体内实验。6-8周的雌性NOD/SCID或无胸腺Nude-FoxN1鼠接受内分泌联合或不联合48-72小时禁食。监测肿瘤生长以及小鼠存活时间,收集肿瘤标本和外周血检测一些循环生长因子、脂肪因子和细胞因子的水平。体内实验检测禁食相关的因子下降,包括IGF1、胰岛素和瘦素蛋白。研究同时检测了36例HR阳性乳腺癌患者外周血标本的循环生长因子和脂肪因子。这36例患者均为入组了评估癌症患者周期性FMD安全性和可行性的两项临床研究的患者。在当前临床研究中,同时监测患者的营养状况和疗效。
当前这项研究发现,在HR阳性乳腺癌动物模型中,周期性禁食或FMD可通过降低循环IGF1、胰岛素和瘦素水平,同时通过上调EGR1和PTEN实现AKT-mTOR信号通路下调,从而增强他莫昔芬和氟维司群的活性。当同时使用氟维司群和哌柏西利时,增加周期性FMD周期,可以促进肿瘤缩小,逆转耐药。此外,禁食和FMD都可以预防他莫昔芬诱导的子宫内膜增生。在接受内分泌治疗的HR阳性乳腺癌患者中,周期性FMD可以导致代谢改变,与小鼠动物模型中观察到一致的结果,此外,瘦素和IGF1水平也同时出现降低,并且在后续的治疗周期中保持在较低的水平。在小鼠中,还观察到长期的抗肿瘤效果。
总体而言,这一研究提示后续可以通过进一步的临床试验,验证禁食模式在HR阳性乳腺癌内分泌±CDK4/6抑制剂方案中的辅助作用。
排版编辑:Nathan
1. Jennifer K. Litton, Sara A. Hurvitz, Lida A. Mina, et al. Talazoparib (TALA) in germline BRCA1/2 (gBRCA1/2)-mutated human epidermal growth factor receptor 2 negative (HER2-) advanced breast cancer (ABC): Final overall survival (OS) results from randomized Phase 3 EMBRACA trial[EB/OL].2020 AACR, abstract CT071.
2. Jennifer K. Litton, A. Douglas Laird, Hope S. Rugo, et al. Exploration of impact of tumor BRCA zygosity and genomic loss-of-heterozygosity (gLOH) on efficacy in Phase 3 EMBRACA study of talazoparib in patients (pts) with HER2-negative (HER2−) advanced breast cancer (ABC) and a germline BRCA1/2 (gBRCA1/2) mutation[EB/OL].2020 AACR, abstract CT072.
3. Steven J. O'Day, Virginia F. Borges, Bartosz Chmielowski, et al. IMPRIME 1 (NCT02981303): A novel phase 2 study in second-line +, metastatic triple negative breast cancer patients shows promising clinical benefit for the combination of the immune checkpoint inhibitor, pembrolizumab (pembro), with the novel innate immune activator, Imprime PGG[EB/OL].2020 AACR, abstract CT073.
4. Malin Dahlgren, Anthony M. George, Christian Brueffer, et al. Pre-existing ESR1 mutations in early-stage primary breast cancer predict failure of endocrine therapy and poor survival[EB/OL].2020 AACR, abstract CT074.
5. Irene Caffa, Vanessa Spagnolo, Pamela Becherini, et al. Fasting-mimicking diet and hormone therapy modulates metabolic factors to promote breast cancer regression and reduce side effects[EB/OL].2020 AACR, abstract CT075.











 苏公网安备32059002004080号
苏公网安备32059002004080号


