受全球COVID-19疫情影响,美国癌症研究协会(AACR)今年决定不举办线下年会,改为两次AACR在线年会。美国东部时间2020年4月27-28日,AACR在线年会Ⅰ隆重召开。在肺癌领域,有多项Ⅲ期临床试验结果公布。

CT213——PACIFIC研究探索性分析:吸烟对于不可切除Ⅲ期NSCLC同步放化疗后度伐利尤单抗维持治疗的影响[1]
Ⅲ期PACIFIC研究确立了同步放化疗(cCRT)后度伐利尤单抗维持治疗作为不可切除Ⅲ期NSCLC的标准治疗地位。在本项探索性分析中,研究者评估了患者吸烟状态对于治疗疗效的影响。
在纳入的713例患者中,64例(9%)从不吸烟。患者基线特征均衡,无论哪个研究小组,与吸烟者相比,从不吸烟患者中女性、亚洲人群、非鳞癌患者的比例更高。在从不吸烟患者中,安慰剂组和度伐利尤单抗组相比,ⅢB期患者的比例更高(52% vs 40%),并且有更多患者接受了诱导化疗(33% vs 21%)。
疗效分析显示,不论患者吸烟与否,相比安慰剂,度伐利尤单抗显著改善了患者的无进展生存期(PFS)和总生存期(OS),同时从HR值来看,似乎从不吸烟患者从度伐利尤单抗治疗中的PFS(0.29 vs 0.59)和OS(0.35 vs 0.72)获益要大于吸烟患者(表1)。
表1.根据患者吸烟状态评估的PFS和OS结果
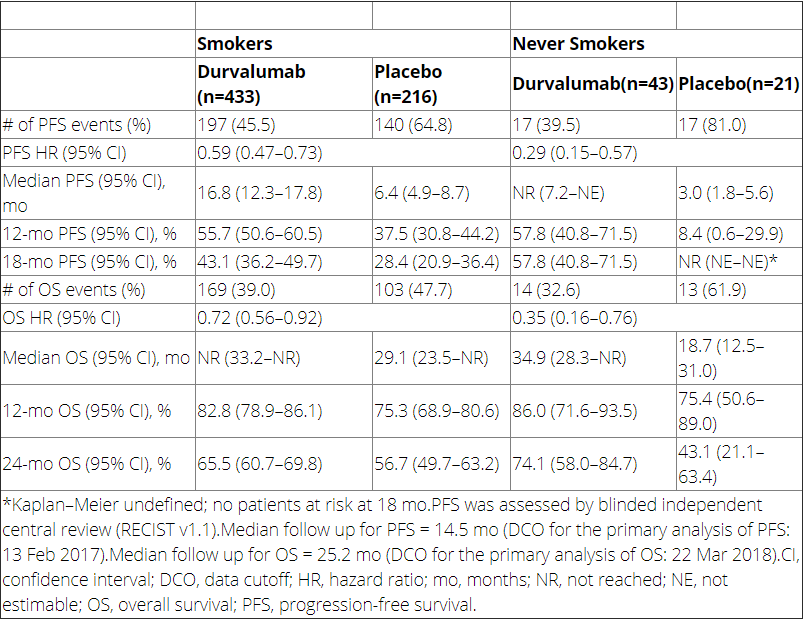 安全性方面,与从不吸烟者相比,吸烟患者在度伐利尤单抗组(34% vs 23%)和安慰剂组(30% vs 14%)中3-4级不良事件的发生率更高。与此相反,相比于吸烟患者,从不吸烟者在度伐利尤单抗组(56% vs 32%;3-4级:7% vs 3%)和安慰剂组(48% vs 23%;3-4级:5% vs 2%)中任何级别的肺炎/放射性肺炎的发生率要更高。
安全性方面,与从不吸烟者相比,吸烟患者在度伐利尤单抗组(34% vs 23%)和安慰剂组(30% vs 14%)中3-4级不良事件的发生率更高。与此相反,相比于吸烟患者,从不吸烟者在度伐利尤单抗组(56% vs 32%;3-4级:7% vs 3%)和安慰剂组(48% vs 23%;3-4级:5% vs 2%)中任何级别的肺炎/放射性肺炎的发生率要更高。
本项探索性分析结果表明,与意向治疗(ITT)人群一致,度伐利尤单抗改善了接受同步放化疗之后未出现疾病进展的不可切除Ⅲ期NSCLC吸烟和从不吸烟患者的PFS和OS。从不吸烟患者的样本量较小,同时患者基线特征的不平衡排除了先前关于亚组间临床结果存在差异的可靠结论。
CT214——CANOPY-1:canakinumab或安慰剂联合帕博利珠单抗+铂类为基础化疗一线治疗晚期或转移性NSCLC患者的Ⅲ期研究安全性导入部分研究结果[2]
炎症细胞因子白细胞介素-1β(IL-1β)对肿瘤微环境具有多种促肿瘤作用,从而促进癌变、肿瘤侵袭和免疫抑制。canakinumab是一种选择性的IL-1β抑制剂,可靶向肿瘤炎症反应并减少免疫抑制,从而增强PD-1抑制剂(如帕博利珠单抗)的免疫治疗效果。Ⅲ期CANTOS研究表明,canakinumab与动脉粥样硬化患者的肺癌发病率降低和肺癌死亡率降低有关,CANTOS研究作为首个Ⅲ期临床研究支持抑制IL-1β可减少肺癌发生和死亡风险,为研究canakinumab在肺癌中的治疗作用提供了理论依据。
CANOPY-1(NCT03631199)是一项随机、双盲、安慰剂对照的Ⅲ期临床试验,旨在评估帕博利珠单抗+铂类为基础化疗±canakinumab用于初治ⅢB/ⅢC-Ⅳ期鳞状和非鳞状NSCLC的疗效和安全性。该研究包括两个部分,第1部分是开放标签安全性导入部分,分为3个队列,每组约9例患者,用以确定Ⅲ期研究中canakinumab方案的安全性。第2部分是Ⅲ期随机双盲临床研究,评估canakinumab联合组和安慰剂组的有效性和安全性。安全性导入部分的主要目标:推荐的canakinumab联合组在Ⅲ期临床研究中的给药方案(图1)。
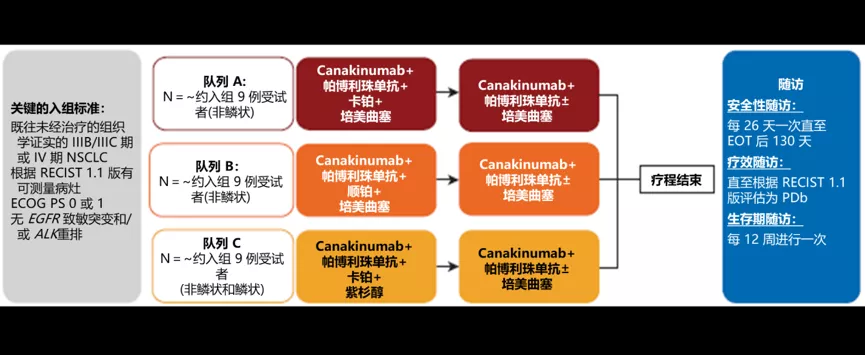
图1.CANOPY-1研究第1部分设计
截止2019年5月14日(从C1D1起≥42天的随访,除非患者较早终止治疗),共治疗了30例患者(队列A,n=10;队列B,n=11;队列C,n=9),其中73%为男性;患者中位年龄为63岁。数据截止时,80%(24/30)的患者仍在接受治疗,终止治疗的主要原因是疾病恶化(队列A中3例,队列B和C组中为1例),另有1例被认定与canakinumab有关。1例患者在研究的前42天出现了剂量限制性毒性(DLT;队列C:3级肝炎,与canakinumab无关)。
基于贝叶斯逻辑回归模型(BLRM),在Ⅲ期临床研究联合组中确定的canakinumab给药方案为200mg,皮下注射,Q3W。无论是否有因果关系,8例(27%)患者出现严重不良事件(队列A中2例,队列B和C中各3例),均被认为未与canakinumab相关。
在所有队列(n=30)中,最常见的不良事件(≥20%,任何级别)为恶心(37%)、呕吐(30%)、便秘(23%)、疲劳(23%)和中性粒细胞减少(20%)。14例(47%)患者经历3级不良事件,1 例患者经历4级不良事件(心包填塞[无关的]),没有报道致命的严重不良事件。有3例(10%)患者因不良反应(肝炎,周围神经病变和多发性神经病)而停止其中一种研究药物,但与canakinumab无关。不良事件导致研究药物之一的剂量减少和剂量中断的患者数分别为3例(10%)和5(17%)例。
初步的安全性分析结果表明,canakinumab联合帕博利珠单抗+铂类为基础化疗仅出现1例剂量限制性毒性。基于BLRM和所有相关临床数据,Ⅲ期临床研究联合组中canakinumab(200mg,皮下注射,Q3W)被认为是安全且耐受性良好的。目前研究第二部分已完成注册。
CT215——ramucirumab或安慰剂+厄洛替尼在未经治疗的EGFR突变阳性转移性NSCLC中的应用:RELAY研究下一代测序(NGS)结果
RELAY研究(NCT02411448)结果表明,与安慰剂+厄洛替尼相比,ramucirumab+厄洛替尼显示出更长的无进展生存期(中位PFS:19.4 vs 12.4个月,HR=0.59,P<0.0001)。在本项研究中,基于NGS检测结果,研究者探索了潜在的基线生物标志物和治疗中出现的(treatment emergent,TE)改变。
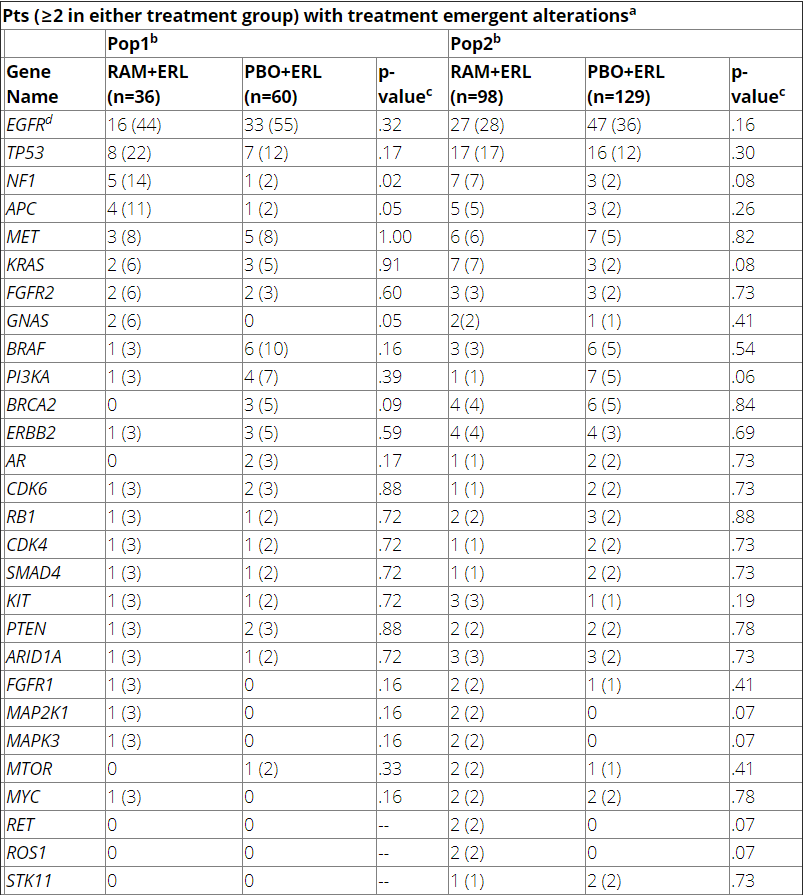
对患者基线情况进行分析发现,与EGFR 19del和21 L858R在基线同时发生改变(突变、基因融合或拷贝数改变)的69个基因中包括ALK、MET和TP53基因。同时基线时ALK和MET的改变似乎并未影响PFS和缓解持续时间(DoR),然而,基线时有TP53突变与不良预后相关(P<0.001),并且ramucirumab+厄洛替尼呈现出有更好疗效的趋势。
为了评估TE改变情况,患者被分为两组:Pop1为在治疗30天后出现疾病进展的患者,并且在基线和随访30天中可检测到19del/L858R突变;Pop2为在治疗后30天因任何原因终止研究治理,并且在基线和30天随访中有检测到任何的基因异常。Pop2涵盖了Pop1人群。
通过分析两组人群的疾病进展和ctDNA脱落情况发现,在30天的随访样本中,ramucirumab+厄洛替尼组和安慰剂+厄洛替尼组具有相似的TE改变(表2)。虽然样本量有限,但治疗组之间TE改变的类型和频率相似。
表2.患者TE改变情况
CT216——IMpower150最终分析:阿替利珠单抗联合贝伐珠单抗和化疗一线治疗转移性非鳞NSCLC
Ⅲ期IMpower150研究显示,与贝伐珠单抗联合化疗(BCP组)相比,阿替利珠单抗联合贝伐珠单抗和化疗(ABCP组)一线治疗转移性非鳞NSCLC能够显著延长PFS和OS,并且在EGFR突变和ALK阳性人群中也观察到临床获益。
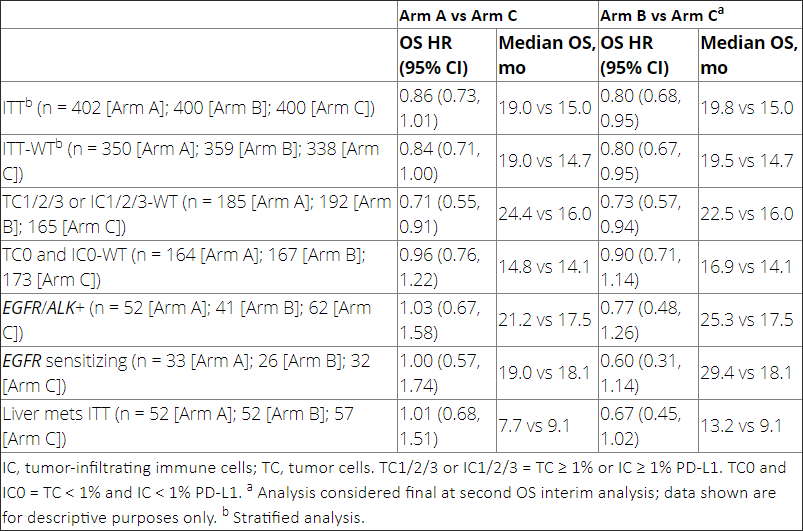
本次更新的数据显示(表3),截止2019年9月13日,在意向性治疗人群野生型(ITT-WT)患者中,ABCP组和BCP组的OS获益与中期分析时保持一致,两组的中位OS分别为19.5个月和14.7个月(HR=0.80,95%CI:0.67~0.95,P=0.01)。阿替利珠单抗联合化疗(ACP)组和BCP组的中位OS分别为19.0个月和14.7个月(HR=0.84,95%CI:0.71~1.00,P=0.05)。
在EGFR敏感突变的患者中,ABCP组对比BCP组,中位OS提高了11.3个月(中位OS:29.4 vs 18.1个月,HR=0.60,95%CI:0.31~1.14);但ACP组较BCP组未观察到OS获益。
在肝转移亚组中,ABCP组较BCP组的OS延长了4.1个月,中位OS分别为13.2个月和9.1个月(HR=0.67,95%CI:0.45~1.02)。而ACP组对比BCP组,未见显著OS差异(9.1 vs 7.7个月,HR=1.01,95%CI:0.68~1.51)。
表3.IMpower150研究最终分析结果
1.Planchard D,Özgüroğlu M,Daniel D,et al.Impact of smoking on outcomes with durvalumab following chemoradiotherapy in unresectable Stage Ⅲ NSCLC(PACIFIC)[EB/OL].2020 AACR,abstract CT213.
2.Johnson BE,Kim TM,Hiltermann TJN,et al.CANOPY-1:Safety run-in results from phase(ph) 3 study of canakinumab(CAN) or placebo(PBO) in combination(comb) with pembrolizumab(PEM) plus platinum-based doublet chemotherapy(Ctx) as 1st line therapy in patients(pts) with advanced or metastatic NSCLC[EB/OL].2020 AACR,abstract CT214.
3.Garon E,Reck M,Nishio K,et al.RELAY,ramucirumab plus erlotinib(RAM+ERL) versus placebo plus erlotinib(PBO+ERL) in previously untreated EGFR mutation-positive metastatic NSCLC:Next generation sequencing(NGS) results[EB/OL].2020 AACR,abstract CT215.
4.Socinski MA,Mok TSK,Nishio M,et al.IMpower150 final analysis:Efficacy of atezolizumab(atezo)+ bevacizumab(bev) and chemotherapy in first-line(1L) metastatic nonsquamous(nsq) non-small cell lung cancer(NSCLC) across key subgroups[EB/OL].2020 AACR,abstract CT216.
排版编辑:Zack















 苏公网安备32059002004080号
苏公网安备32059002004080号


