HR阳性HER2阴性乳腺癌是最常见的乳腺癌类型,由于这类患者对新辅助化疗敏感性较低,临床需要继续探寻有效方案。近日,由来自复旦大学附属肿瘤医院的邵志敏教授发起,多位专家参与的CBCSG-036研究成果在《癌症》(Cancer)杂志发表,这项研究评估了新辅助治疗联合雌激素剥夺用于ER阳性HER2阴性乳腺癌患者新辅助治疗的疗效。肿瘤资讯特邀空军军医大学西京医院张聚良教授对该研究进行解读与点评。

空军军医大学西京医院甲乳血管外科
中华医学会肿瘤学分会乳腺学组青年委员
中国医师协会乳腺疾病专业委员会委员
中国医药教育协会乳腺专业委员会委员
中国研究型医院学会乳腺疾病专业委员会委员

《新见》是由中华医学会肿瘤分会乳腺肿瘤学组组织的国际会议期刊文献解读与点评。
研究背景
新辅助治疗已经成为局部晚期乳腺癌的标准治疗模式,因其可以提高手术切除率和保乳率。根据患者的分子分型来选择新辅助治疗方案可以显著提高临床和病理缓解率。HR阳性HER2阴性是最常见的乳腺癌类型(约占70%),这类患者对新辅助化疗敏感性较低,客观缓解率(ORR)约为65%,病理缓解率(pCR率)较低,仅为5%~10%。因此,对于这类患者,亟需探寻新的新辅助治疗方案以提高总体肿瘤缓解率。
目前,卵巢功能抑制(使用GnRH-a)联合芳香化酶抑制剂(AI)是绝经前HR阳性HER2阴性乳腺癌患者辅助治疗的标准方案,且一些研究提示这一方案用于ER阳性乳腺癌患者新辅助治疗也显示出一定疗效。然而,目前尚无研究探索雌激素剥夺联合新辅助治疗是否可以取得更高的肿瘤缓解率。一项回顾性研究报道,来曲唑联合GnRH-a和新辅助化疗用于绝经前激素敏感的乳腺癌患者高度有效。另一项研究显示,来曲唑联合新辅助化疗相比于单纯化疗用于绝经后ER阳性局部晚期乳腺癌,可以显著改善肿瘤缓解率。然而,上述研究均为小样本量的回顾性分析,有必要进行一项随机试验以探索新辅助化疗联合内分泌治疗用于ER阳性HER2阴性乳腺癌的疗效。基于此,研究者发起了CBCSG-036研究,以评估新辅助治疗联合雌激素剥夺用于ER阳性HER2阴性乳腺癌患者新辅助治疗的疗效。
研究方法
这是一项开放、多中心、随机对照研究,入组了ER阳性HER2阴性,可手术或局部晚期(AJCC分期ⅡB~ⅢC期)患者。入组标准为ⅡB~ⅢC 期,ER阳性、HER2阴性,既往未接受过化疗和内分泌治疗,ECOG PS评分0~2分,有可测量和可评估的肿瘤原发灶,病理确诊为浸润性导管爱,年龄18~70岁,单侧乳腺癌。临床评估为cN0的可手术患者,需满足以下危险因素才可以入组:大肿瘤(≥cT2)、高级别(WHO 3级)或Ki-67指数高(>20%)。
符合入组标准的患者1:1随机分配接受新辅助化疗联合内分泌治疗(NCET)或单纯新辅助化疗(NCT)。分层因素包括研究中心、患者年龄(>60岁或≤60岁)、临床评估的肿瘤大小(cT1-2或cT3-4)和临床淋巴结状态(cN0、cN1和cN2-3)。新辅助化疗联合内分泌治疗组患者接受来曲唑联合(绝经前)或不联合(绝经后)亮丙瑞林治疗直至手术,同时给予同步化疗。在完成新辅助治疗后,患者接受手术治疗。术后患者根绝月经状态继续接受来曲唑联合(绝经前)或不联合(绝经后)亮丙瑞林治疗,临床医生决策患者是否接受辅助化疗和放疗。在新辅助治疗过程中常规2个周期评价1次疗效。分别根据术前和术后的肿瘤组织标本进行基线和新辅助治疗后的病理评估,包括ER、PR、HER2和Ki-67。主要研究终点为基于影像学评估的ORR,包括CR和PR。次要终点包括2组患者Ki-67增殖指数变化、病理肿瘤缓解率、pCR、PFS和安全性。
研究结果
1. 入组患者和基线特征
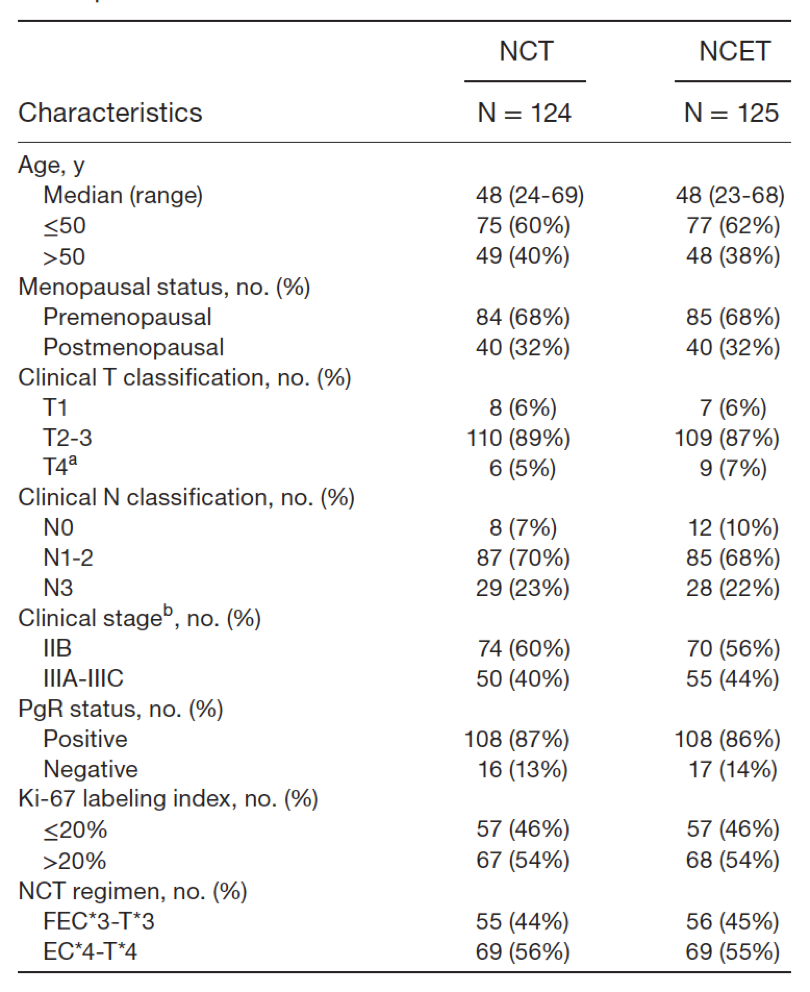
2013年5月—2017年2月,共249例患者随机分配至2组,NCET组和NCT组分别为125和124例(图1)。在符合方案人群(PP人群)中,两组分别有115和116例患者完成了所有既定治疗周期。两组的基线特征均衡,总结见下表1。
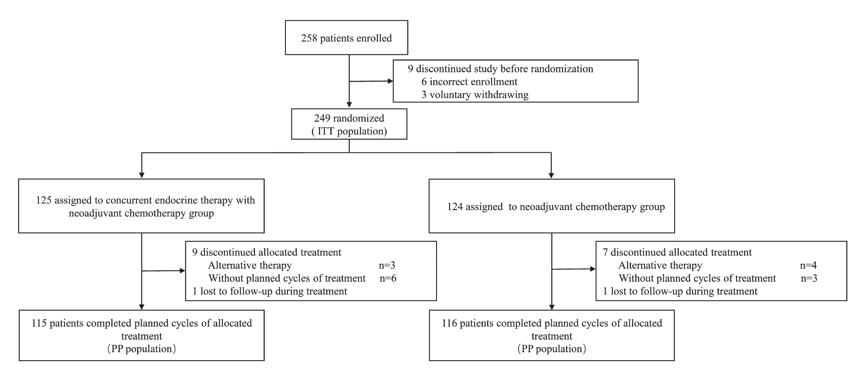
图1. 研究入组流程图
表1. 入组患者的基线特征
2. 主要研究终点(ITT人群的ORR)
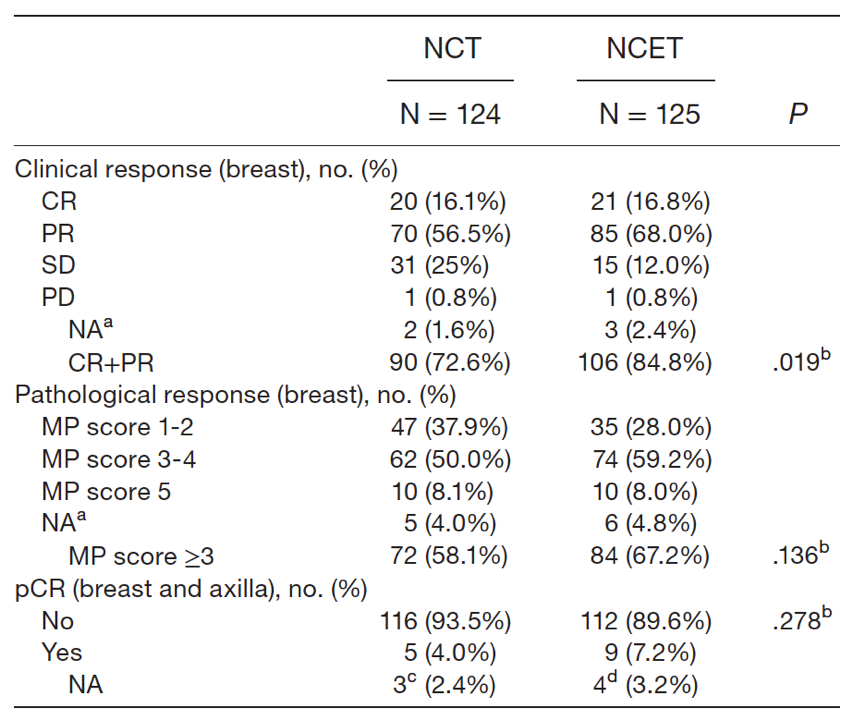
NCET组的125例患者,21例取得CR,85例取得PR。NCT组的124例患者,20例取得CR,70例取得PR。最终两组分别有3例和2例患者无法进行疗效评估,mITT人群中排除了这些患者。总体而言,NCET组对比NCT组,ORR显著更高,分别为84.8% vs 72.6%(P=0.19);OR为2.11(95%CI 1.13~3.95,P=0.02)。调整了年龄(≤40 vs 41~60 vs >61岁)、绝经状态(绝经前 vs 绝经后)、临床肿瘤分期(Ⅱvs Ⅲ期)、基线Ki-67水平(≤20% vs >20%)、NCT方案(FEC×3-T×3 vs EC×4-T×4)后,OR为2.16(95%CI 1.14~4.09,P=0.18)。在mITT人群和PP人群中,NECT组对比NCT组,ORR均显著更高。
表2. ITT人群的疗效评估
3. 两个治疗组的Ki-67改变
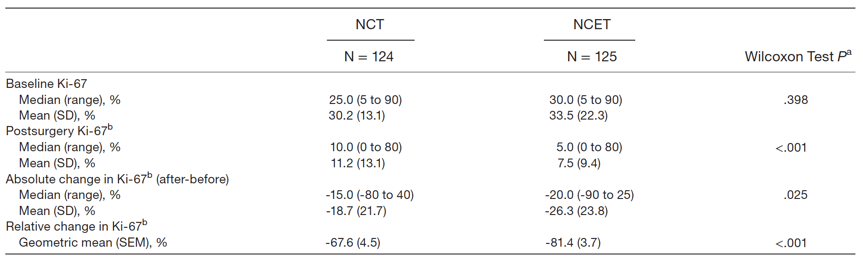
两组患者基线Ki-67水平无显著差异(P=0.398),组排除8例手术标本无法进行Ki-67评估的患者后,NCET组对比NCT组,手术标本Ki-67中位值显著更低,分别为5.0% vs 10.0%(P<0.001)。从基线开始,Ki-67的绝对值变化,NCET组对比NCT组显著更高(-10.0% vs -15.0%,P=0.025)。此外,Ki-67的相对值变化,两组也存在显著差异(-81.4% vs -67.6%,P<0.001)。
表3. 两个治疗组的Ki-67变化
4. pCR率
NECT组和NCT组分别有7.2%(9/125)和4.0%(5/124)的患者取得pCR(P=0.278),见表2。相似的,NECT组的病理缓解率在数值上也更高,分别为67.2% vs 58.1%(P=0.136)。
5. 根据绝经状态和基线Ki-67水平进行既定亚组分析
在绝经后和绝经前患者中均观察到NCET组的疗效优于NCT组。然而,进展Ki-67>20%的患者中观察到NCET组显著更优的临床缓解率(91.2% vs 68.7%,P=0.001),见表4。
表4. 亚组分析
6. 安全性分析
患者对所有治疗方案的耐受性均良好,未观察到治疗相关性死亡或威胁生命的事件。白细胞减低和中性粒细胞减低是最常见的化疗相关性血液学毒性,两组的发生率相当。两组最常见的≥3度毒性为粒缺性发热和胃肠道反应,两组发生率也相当(表5)。与内分泌治疗相关的常见毒性为潮热和肌肉骨骼疼痛,均为轻度到中度。
7. PFS分析
中位随访26个月后,两组的PFS无显著差异(P=0.188,图2)。基线Ki-67水平高(>20%)的患者更高有可能过从NCET治疗中取得PFS获益,NCET和NCT组2年PFS率分别为 91.5% vs 76.5%(P=0.058);而Ki-67水平低的患者未观察到两组PFS差异的趋势(P=0.317),见图3。
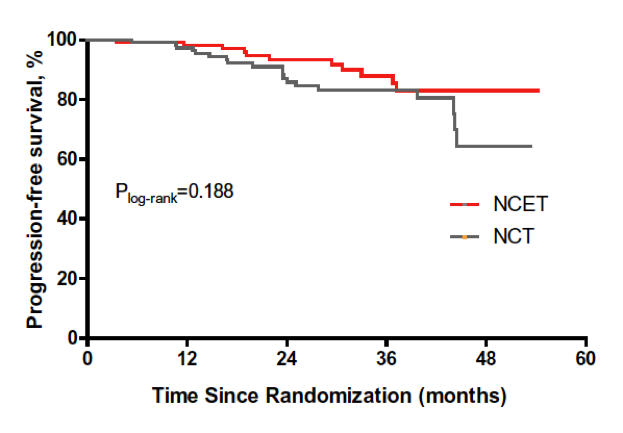
图2. 两组的PFS对比
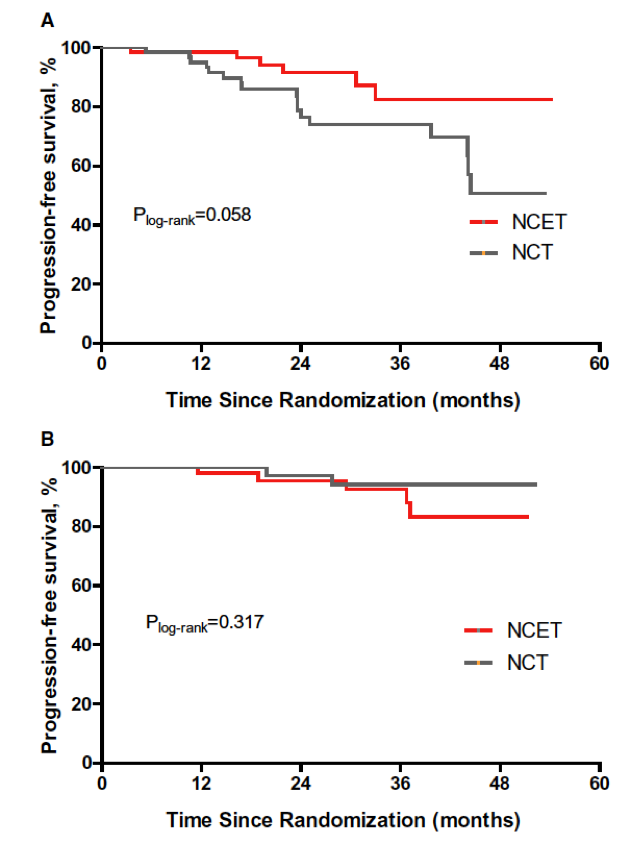
图3. 根据基线Ki-67水平进行两组的PFS对比
研究讨论
这一研究在ER阳性HER2阴性乳腺癌患者中评估了在NCT基础上联合雌激素剥夺可以改善ORR,且不影响治疗耐受性。NCT组ORR为60%~70%于既往在ER阳性患者中报道的结果相似。同步NCET治疗的ORR为84.8%,较既往小样本量研究报道的ORR>90%现对更低,这可能是因为研究入组人群的差异。两组在pCR率上无显著差异。在NSABP B-52研究在ER阳性HER2阳性的患者评估了新辅助内分泌治疗联合化疗和双靶抗HER2治疗,显示pCR率在数值上有改善。此外,NCT组和NCET组的pCR分别为4.0%和7.2%,较NSABP B-27研究报道的更低。本研究与上述两项研究的差异可能是因为入组人群不同,上述两项研究均纳入了ER阳性HER2阴性患者。在ER阳性HER2阴性患者中,pCR率并不是OS的替代终点,因此本研究也选择了ORR作为主要终点,可以更好的反映内分泌治疗的疗效。此外,研究发现,新辅助内分泌治疗的更高的ORR预示着患者在辅助治疗阶段可以取得更好的生存。
总体而言,这一研究是目前第一项随机对照研究,在一定样本量的患者中证实了NCT联合雌激素剥夺对比单纯NCT治疗ER阳性HER2阴性患者。毫无疑问,这一研究结果将会挑战既往的观念,即序贯化疗和内分泌治疗优于同步治疗,这将改变这类患者的治疗模式。
研究结论
这一研究显示,对于ER阳性HER2阴性的乳腺癌,在NCT基础上联合雌激素剥夺相比于单纯化疗,更为有效;尤其是Ki-67水平较高的患者,可以取得显著更高的ORR。尽管这一研究仍需进行后续随访以评估生存获益,但NCET组在ORR上的优势,已经证实了这一方案可以用于局部晚期患者的新辅助治疗,尤其是在基线Ki-67水平较高的患者。
研究点评
内分泌治疗和化疗都是早期乳腺癌有效的系统治疗手段,EBCTCG的多项荟萃分析已明确,即使对于激素受体阳性的患者,化疗联合内分泌治疗相较单纯内分泌治疗更能带来生存获益。尽管近年来一些临床研究提示部分激素受体阳性的患者通过进一步的多基因检测评估风险后,可能不需要接受化疗,如TAILORx,WSG PlanB,MINDACT研究等,但对多数的HR阳性乳腺癌,还是需要接受辅助化疗和内分泌治疗。
1、化疗和内分泌治疗可以同时应用吗?
在化疗和内分泌治疗的应用方面,一个较为公认的观点是:内分泌治疗不应和化疗同时应用,而应在化疗结束后序贯使用。在机制上的一个解释是内分泌治疗可能会使更多的癌细胞进入增殖停滞状态,从而影响化疗的疗效,在一些体外试验中,确实也有类似的发现。但是,作用机制上的可能性不能代替临床实践,奠定化疗和内分泌治疗应该序贯应用的临床研究是SWOG8814临床试验,在这项研究中,1400多例HR阳性LN阳性的绝经后乳腺癌患者随机分为 TAM 单用组 ;CAF联合TAM组, CAF后序贯TAM组,最终结果发现,序贯组相较于联合组,DFS和OS具有明显改善。但这个研究至少有几点值得商讨:研究进行的时间较早,并没有评估HER2的状态,HER2阳性比例在各组间是否均衡并不知道;研究采用的是他莫昔芬,AI类药物是否也是如此仍是未知。而且,在这方面临床证据也并不一致,意大利的两项临床研究MIG-1 及MIG-5入组了1096例乳腺癌患者,随机分为化疗联合TAM及化疗序贯TAM两组,结果表明10年总生存两组并无差异(83% vs 80%),在年轻乳腺癌中,联合应用还显示出轻度的生存获益。美国的一项多中心三期随机对照研究纳入431例淋巴结阳性乳腺癌患者,随机接受化疗联合TAM或化疗序贯TAM,中位随访12.3年,显示联合组OS为66%,而序贯组为65%,毒副反应方面二者也未显示出差异。当然,这几项研究同样存在时间较早,分子分型概念尚未确立等缺点。但至少从目前来看,化疗与内分泌治疗的联合应用并非禁区。
2、一些临床试验证实了化疗与内分泌治疗的可行性
事实上,一些经典的临床研究中,也是化疗及内分泌治疗同时应用的。如在辅助内分泌治疗的TEXT研究中,化疗是与OFS同时应用的,并未显示出对生存获益的影响。在CREATE-X研究中,HR阳性的患者在辅助治疗阶段,同时接受了卡培他滨化疗联合内分泌治疗,同样未显示出生存的差异。一些晚期的研究中,探讨了节拍化疗联合内分泌治疗,显示出更高的ORR。当然,节拍化疗更多地表现为抗血管生成的机制,因此并不能完全说明化疗与内分泌治疗的联合应用在晚期乳腺癌中的的优效。
NSABP B-52是一项针对HR阳性/HER-2阳性乳腺癌新辅助治疗的临床试验,纳入了315例患者,比较了多西他赛+卡铂+曲妥珠单抗+帕妥珠单抗(TCbHP)联合或不联合内分泌新辅助治疗的疗效,结果显示标准治疗基础上同时联合内分泌治疗后,虽然数值上PCR率有提高,但并未显示出统计学差异,但作者也指出,至少联合内分泌治疗并没有带来害处。
本文的CBCSG-036研究,探讨了在HR阳性,HER-2阴性乳腺癌中,化疗同时联用雌激素剥夺内分泌治疗(NCET)相比单纯化疗(NCT)能否带来更高的ORR,结果表明,在标准化疗的基础上同时联用内分泌治疗可以显著提升ORR,特别是对于基线Ki67>20%的患者而言,获益更明显。文中也提到了之所以没有采用PCR作为主要研究终点,是因为HR阳性乳腺癌往往具有较低的PCR率,而且对于这一类型的乳腺癌,PCR也并非一个好的预后指标,而ORR更能反映治疗的疗效。事实上,在中位随访26个月时,两组PFS未见明显差异,但在基线Ki-67水平高(>20%)的患者更高有可能过从NCET治疗中取得PFS获益,NCET和NCT组2年PFS率分别为 91.5% vs 76.5%(P=0.058),显示出获益的趋势,期待更进一步的随访结果。
笔者以为,基于现有证据,化疗与内分泌治疗的同时应用并非不可行。由于乳腺癌本身即存在很大的异质性,同一患者的癌组织中存在着多种分子亚型的亚群。理论上说,化疗药物有助于杀灭高增殖性的细胞,可能更多地表现为三阴性亚群,而内分泌治疗则促进了相对增殖较差的受体阳性亚群的凋亡。因此,化疗和内分泌治疗的联用可能具有增效的作用。但在具体临床实践中,仍要区别治疗类型,个体化对待。对于辅助治疗,由于内分泌治疗至少长达5年,无论联合还是序贯使用,相差也仅仅只有几个月的时间,而序贯使用相对用药单一,副反应更小,也更适宜。而晚期患者强调的是细水长流,延年益寿,首先从治疗理念上来说并不建议联合用药,对于受体阳性的乳腺癌患者,也不主张先用化疗手段,更无需说化疗联合内分泌治疗了,当然对于一些需要快速控制病情的患者,二者联用也未尝不可。在新辅助治疗中,由于治疗目的不同,很多患者是为了降期,更好地进行手术,因此,新辅助治疗强调强化的理念,以达到快速抑瘤的目的,通过二者的联用提高疾病的控制率可能是一个值得探索的模式,而文章也确实给我们提示了二者联用具有更好的疗效,值得深入研究和随访。
Shao ZM, Yu KD, Wu SY, et al. Concurrent Neoadjuvant Chemotherapy and Estrogen Deprivation in Patients With Estrogen Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative Breast Cancer (CBCSG-036): A Randomized, Controlled, Multicenter Trial.[J]. Cancer 2019.
精彩回顾
【新见】徐莹莹教授&邢鹏教授:剂量密集型化疗在靶向治疗时代的价值
【新见】马力教授:Aplelisib 治疗激素受体阳性、PIK3CA突变的晚期乳腺癌
【新见•ASCO特刊】余科达教授:NSABP乳腺癌研究60年奥德赛之旅
【新见•ASCO特刊】郑亚兵教授:PALOMA-3:ER+晚期乳腺癌患者在氟维司群联合/不联合哌柏西利治疗中早期进展的基因组标记物
【新见•ASCO特刊】叶松青:GeparOLA Ⅱ期临床研究: 奥拉帕利联合紫杉醇对比紫杉醇/卡铂并序贯表阿霉素/环磷酰胺用于HRD阳性,HER2阴性的早期乳腺癌患者新辅助治疗的疗效
【新见•ASCO特刊】史艳侠教授:TALA in Breast Cancer
【新见•ASCO特刊】李兴睿教授:晚期乳腺癌患者的手术意义探讨
【2126】徐莹莹教授:探寻阿喀琉斯之踵--乳腺癌诊疗四十年
【新见ASCO特刊】宋东教授:精准诊疗时代乳腺癌治疗亟需生物标志物的精准选择
【新见•ASCO特刊】陈前军教授&许锐教授:HER2阳性乳腺癌的升阶治疗和降阶治疗的热点
【新见】马力教授:Aplelisib 治疗激素受体阳性、PIK3CA突变的晚期乳腺癌
【新见】吕志栋教授:HER2阳性早期乳腺癌4年DFS数据更新:6个月曲妥珠单抗辅助治疗疗效并不劣于12个月












 苏公网安备32059002004080号
苏公网安备32059002004080号


