
第63例
HER2阳性乳腺癌素来被称为“最凶险的乳腺癌”,因此临床工作中应秉承“尽早明确HER2,尽早临床获益”的理念,对于HR+/HER2+的晚期乳腺癌患者,需充分告知及时全程、规范地抗HER2治疗的重要意义。

现任浙江大学医学院附属第一医院肿瘤分子靶向诊治中心主任
美国ASCO 会员
国家自然基金评审专家
在浙大一院从医30余年,主要从事肿瘤的药物治疗,化疗,内分泌治疗,靶向治疗及免疫治疗等。追随于诊治肿瘤的先进国际理念,针对手术前,手术后及复发或晚期的各类患者,精准化,个体化及治疗过程的全程管理有效地降低了肿瘤早期病人的复发率,并且让晚期病人能够带瘤生存且拥有良好的生活质量!

浙江大学医学院附属第一医院肿瘤内科
2015年毕业于第二军医大学,获肿瘤学硕士学位
以第一/共同第一作者发表学术论文10余篇,其中SCI收录4篇
病史简介
杨某,女性,46岁,未绝经。2012年7月因“发现左乳肿物1月”就诊绍兴某医院,查体:左乳外上象限可触及一“花生米”大小的肿块,边界不清,质硬,可推动,左腋窝可触及多枚肿大淋巴结。乳腺超声示:左乳可探及一大小约4cm×3cm低回声团块,BI-RADS 5类,左腋窝可探及数个肿大淋巴结。既往史、个人史、家族史无特殊,否认慢性病、传染病史。
治疗经过
手术治疗
2012年8月1日在绍兴某医院行“左乳腺癌改良根治术”,术后病理示:大小4cm×3cm×3cm,大部分为导管内癌,部分为浸润性导管癌,SBR II级,冰冻示肿块旁少量肿瘤残存,肿瘤未侵及乳头及皮肤,基底切缘阴性,清扫淋巴结转移情况:腋前2/4,腋中0/6,腋后0/6,胸小肌区域0/4,胸内侧0/2,肩胛下0/2,免疫组化: ER(-),PR(-),HER2(2+),未进一步行FISH检测。术后诊断:左乳腺浸润性导管癌 pT2N1M0 IIIA期,HR(-),HER2(-)。
术后给予CEF-D方案(环磷酰胺0.8g,阿霉素70mg,氟尿嘧啶0.75g,序贯多西他赛120mg)化疗6周期,化疗完成后给予胸部局部放疗,定期复查未见明显转移或复发。
一线治疗
2013年9月患者复查肿瘤标记物提示:CEA 29.77μg/mL,同时复查 PET-CT示:①左乳腺癌术后;②肝占位,转移可能性大;③右侧附件区囊样影;④肝内钙化灶。无病生存期(disease-free survival,DFS)为14个月。患者将手术标本送至我院,病理会诊示:(左)乳腺浸润性导管癌(II~III级),见较多导管内癌成分。免疫组化示:淋巴结转移灶,ER(+,约1%~2%),PR(++,约5%),HER2(3+),Ki-67(+,10%)。后患者于同年12月11日在上海某医院行“左半肝切除+胆囊切除+右肝转移灶毁损术”。术后诊断:左乳腺浸润性导管癌 pT2N1M1 IV期,分子分型HR阳性HER2阳性型。
2013年12月在绍兴某医院予以一线TH方案(多西他赛120mg,曲妥珠单抗440mg,q3w)化疗联合靶向治疗1周期,治疗期间出现Ⅳ度骨髓抑制。后患者因不能耐受该方案治疗,于2014年1月就诊于我院,经与患者商议后,遂行6个周期GP+H方案(吉西他滨1.4g d1,顺铂35mg d1~3,曲妥珠单抗330mg d1,q3w)化疗结束后,给予曲妥珠单抗维持治疗共1年,期间定期复查未见明显转移或复发征象。2015年6月复查骨扫描(ECT)示:①胸11椎体、腰2椎体骨质代谢活跃。②左髋臼骨质代谢活跃,建议进一步检查,排除肿瘤骨转移。结合患者复查结果,综合疗效评价为病情进展(progressive disease,PD),PFS约18个月。
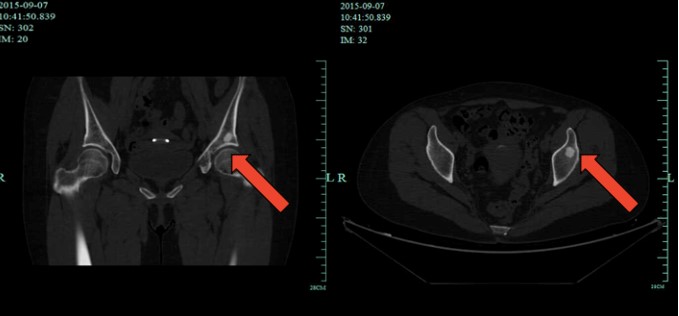
图1 2015年9月7日CT
2015-09-07 CT:左侧髋臼局部骨质破坏及左髂骨类圆形高密度影,结合病史首先考虑转移。对比2015-6-5CT片病灶成骨开始形成。
二线治疗
2015年6月至2016年12月共接受11周期XH方案(卡培他滨1000mg bid d1~14,曲妥珠单抗负荷剂量440mg,维持剂量330mg d1,q3w)同时联合唑来磷酸抗骨转移治疗。2017年1月复查头颅MRI示:小脑蚓部占位,转移瘤考虑。综合疗效评价为PD,PFS为18个月。
三线治疗
2017年1月患者于我院神经外科行颅内转移瘤伽玛刀分次治疗,周边剂量15Gy,等剂量线:50%,最高剂量30Gy。
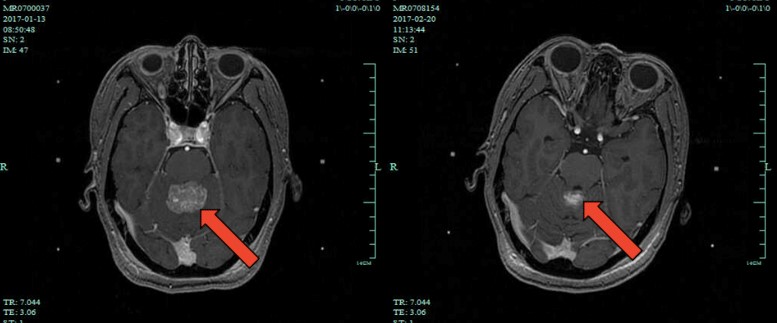
图2 2017年1月13日MRI与2017年2月20日MRI对比
同时于2017年1月起在我科接受PH方案(紫杉醇+曲妥珠单抗)并维持治疗共1年,后与卡培他滨单药维持治疗。2018年9月复查头颅MRI示:小脑蚓部转移性肿瘤考虑,对比2017-11 MR片病灶明显增大。2018年9月腹部CT示:左半肝切除+胆囊切除术后改变,肝脏术区多发结节,肿瘤复发考虑。T11椎体及右侧附件、左侧髂骨、右侧髂骨骶髂关节面、左侧髋臼及两侧耻骨坐骨多发骨质密度异常,考虑转移。ECT示:骨骼骨质代谢活跃,对照2017年11月病灶数目有所增多,结合病史及相关检查,肿瘤骨转移首先考虑。综合疗效评价为PD,PFS约为20个月。
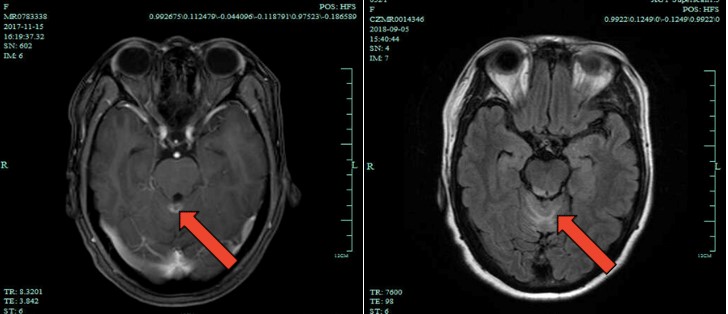
图3 2017年11月15日MRI与2018年9月5日MRI对比
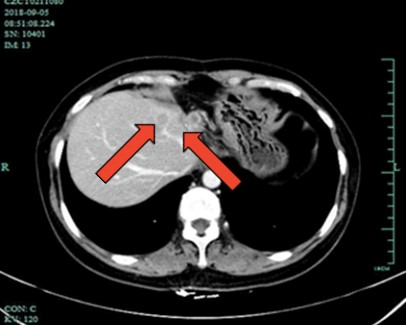
图4 2018年9月腹部CT示:左半肝切除+胆囊切除术后改变
四线治疗
2018年9月患者在我院神经外科行颅内转移瘤伽玛刀治疗。同时在我科接受3周期XB方案(卡培他滨1000mg bid po d1~14 q3w+吡咯替尼320mg po qd)治疗,主要不良反应:腹泻和手足综合征。2019年1月腹部CT示:左半肝切除术后改变,右肝包膜下小结节,考虑转移灶。对照2018年9月影像病灶缩小。头颅MR示:小脑蚓部及导水管周围转移瘤。对照2018年10月病灶明显增大。综合疗效评价PD,PFS约为4个月。
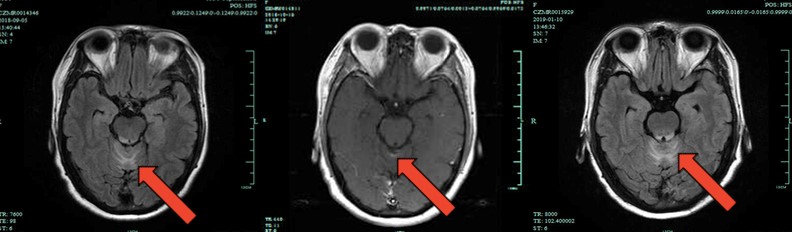
图5 2018年9月5日、2018年10月16日、2019年1月10日MRI对比
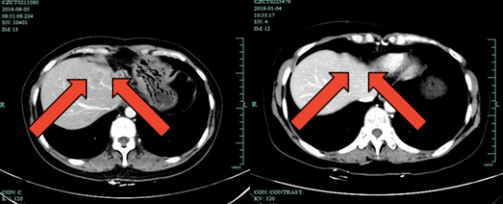
图6 2018年9月5日与2019年1月10日腹部CT对比
总结
这是一例HER2阳性乳腺癌出现复发转移的患者。患者在早期治疗阶段未充分评估HER2状态错失1年辅助抗HER2治疗,导致患者后续出现复发转移,发展为难治愈的疾病。在发展到晚期疾病后,患者坚持全程抗HER2治疗的理念,一线和二线均接受曲妥珠单抗联合化疗,取得了持久的疾病缓解。进展后三线治疗再次尝试曲妥珠单抗,并治疗有效,疾病得到控制。四线治疗继续抗HER2治疗,并继续获益。我们的临床实践充分验证了曲妥珠单抗治疗进展后再使用的疗效。
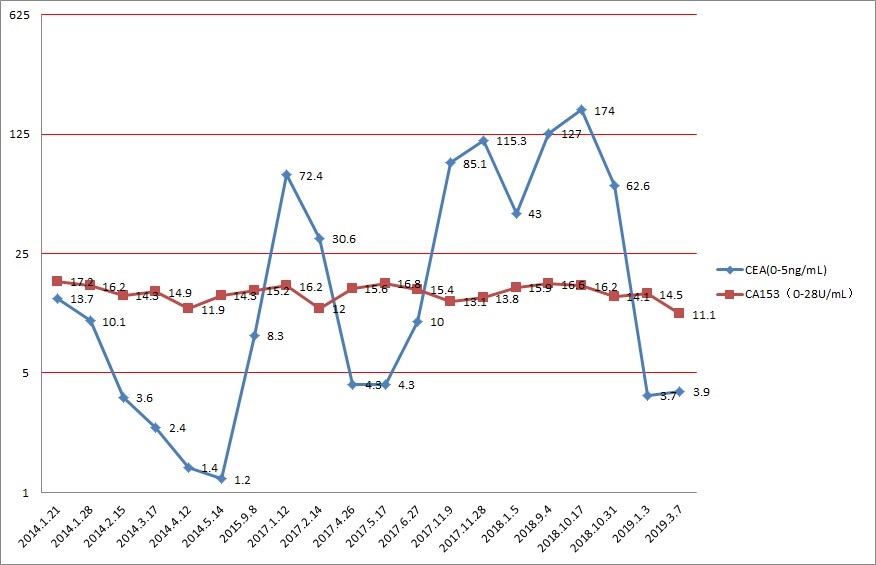
图7 治疗过程中肿瘤标志物变化趋势
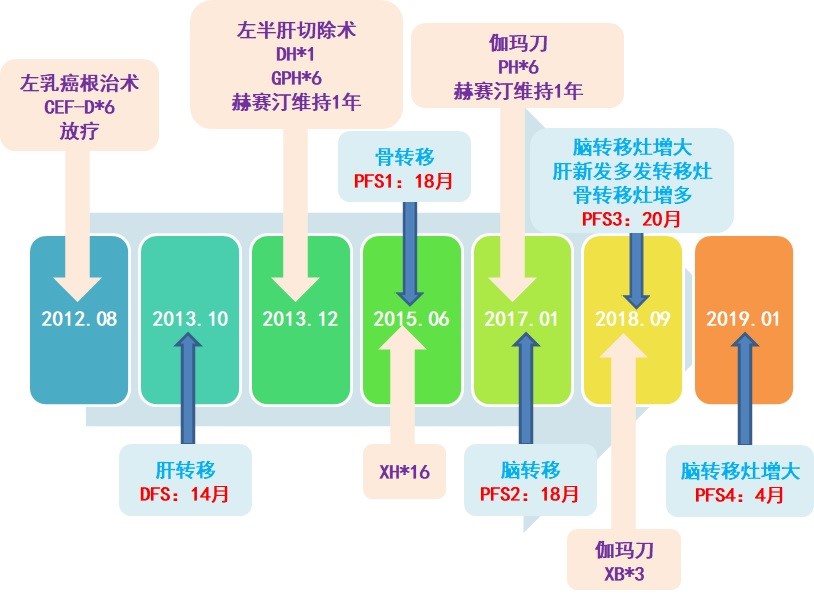
图8 治疗过程总结
点评专家

空军军医大学西京医院肿瘤科副主任
北京乳腺病防治学会肿瘤免疫治疗分会副主委
陕西省抗癌协会青年委员会副主委
陕西省抗癌协会生物治疗专业委员会副主委
陕西省抗癌协会肿瘤热疗专业委员会副主委
中国医药教育协会乳腺疾病专业委员会委员
中国生物医学工程学会肿瘤分子靶向分会委员
中国医师协会肿瘤医师分会青年委员
点评
患者46岁,绝经前女性,诊断为左侧乳腺癌术后肝、骨、脑转移。该患者病史较长,确诊至今近7年,复发转移后生存也近6年。患者系HER2阳性乳腺癌,既往经过手术、放疗、化疗及靶向治疗多种治疗手段,整体治疗合理、有效,患者也在复发转移后长期生存。但整个病例中,仍有很多环节需要进一步完善。
1、明确HER2状态对于患者的预后及治疗至关重要
2012年患者行左乳腺癌术后,免疫组化提示HER2(2+),应进一步行ISH(原味杂交)检测HER2基因是否扩增或者换另一个标本重新行HER2免疫组化。如果HER2基因扩增,那么就属于HER2阳性乳腺癌,应该在辅助治疗阶段给予抗HER2治疗。遗憾的是,当时并未对HER2状态行进一步验证,使得患者错失了术后辅助治疗阶段及早应用抗HER2治疗的机会,复发转移风险也就明显增高。
曲妥珠单抗是最主要的抗HER2靶向药物,多项辅助治疗研究包括NSABP B31、N9831、HERA、BCRIG006均表明,对于HER2阳性乳腺癌,曲妥珠单抗辅助治疗可以明显降低复发及死亡风险。因此在临床实践中,对于HER2免疫组化(2+)的患者,应及时行HER2 ISH检测明确HER2基因有无扩增,对于HER2基因扩增的患者,应按照指南推荐给予规范抗HER2治疗。
2、复发转移后再次活检问题
在怀疑肝转移后,对该患者原发灶的病理情况再次进行了确认,这点十分必要,尤其是该患者术后病理显示HER2(2+)但未行ISH检测。结果对原发灶的会诊免疫组化显示HER2(3+),证实了之前的疑问,也与患者的疾病复发特点相符。另外,建议积极对复发转移病灶(可行情况下)进行活检,一方面明确病变性质,另一方面重新评估转移灶的激素受体和HER2状态,为后续治疗选择提供依据。
3、晚期乳腺癌抗HER2治疗方案选择及持续时间
该患者既往在辅助治疗阶段,未接受过曲妥珠单抗辅助治疗,因此,以曲妥珠单抗为基础的联合化疗是这部分患者晚期一线的标准选择。H0648g和M77001研究证实在紫杉类基础上联合曲妥珠单抗治疗能够显著提高PFS和OS,确立了曲妥珠单抗联合紫杉类一线标准治疗的地位[1-2]。而基于CLEOPATRA研究,目前国内外多个乳腺癌诊疗指南推荐的晚期一线标准治疗方案是曲妥珠单抗+帕妥珠单抗+多西他赛的双靶方案。2019年ASCO年会上,CLEOPATRA研究8年随访结果公布,曲帕双靶方案与对照组的中位PFS分别为18.7个月和12.4个月,中位OS分别为57.1个月和40.8个月,HR=0.69(P<0.001)。两组8年OS率分别为37%和23%,即1/3的晚期HER2阳性乳腺癌患者或将实现10年生存。
结合该患者诊疗过程,一线治疗在1周期TH(多西他赛+曲妥珠单抗)方案后患者出现了Ⅳ度骨髓抑制,这时可以考虑减量或者换用紫杉醇,并应用集落刺激因子对症处理,不建议随意更换为GP+H方案,因为双药联合化疗的骨髓抑制及相关不良反应也不容忽视。在患者接受曲妥珠单抗联合化疗时,有效化疗应持续至少6~8个周期,时长取决于肿瘤疗效和患者对化疗的耐受程度。化疗停止后建议继续曲妥珠单抗维持治疗。该患者在一线及后线使用曲妥珠单抗满1年后停用并不合适,应维持至疾病进展。治疗过程中频繁地更换药物、抗HER2治疗没有持久,使患者未能获得足够的临床获益,这是在晚期治疗中的不足之处。当然,2019 CSCO乳腺癌诊疗指南指出,对于应用抗HER2治疗获得完全缓解的患者,HER2靶向治疗的持续时间应权衡治疗毒性、经济负担,也可以在病情完全缓解后2-3年,部分患者暂停抗HER2治疗,病情进展后可恢复使用以前曾获益的抗HER2药物治疗。
4、脑转移后的抗HER2治疗
对于HER2阳性晚期乳腺癌,脑转移的发生率高达30%~55%。对于晚期乳腺癌脑转移的治疗,需要多学科参与,可以考虑手术、立体定向放射外科、全脑放疗、立体定向适形放疗等局部治疗手段。同时,有效的全身治疗也非常重要,持续的抗HER2治疗可通过对颅外病灶的有效控制,降低了约一半由颅外转移灶进展带来的死亡风险[3]。ASCO临床实践指南中对于有关HER2阳性乳腺癌和脑转移患者疾病管理的建议指出:对于脑转移诊断时,全身疾病未进展的患者,经有效的脑转移局部治疗后,应继续抗HER2靶向治疗,此时不宜更换抗HER2治疗方案,对于脑转移诊断时,全身疾病进展的患者,临床医生应该根据治疗HER2阳性转移性乳腺癌的规则进行靶向HER2治疗[4]。
结合该患者而言,其脑转移病灶出现前,共接受了11周期XH方案,但治疗总时长达1年半,所以XH方案应该也不是规律使用。而且在脑转移发生时,未描述有颅外病灶进展表现,所以在脑转移接受局部治疗后,当继续当前抗HER2治疗方案。结合患者后续生存获益情况,其选择局部放疗并保留曲妥珠单抗抗HER2,患者获得长达20个月的PFS获益,临床疗效令人满意。但同一线治疗时类似,在使用曲妥珠单抗满1年后就停用曲妥珠单抗是不合适,结合指南推荐应维持至疾病进展。
5、抗HER2治疗应及时、规范、持久
2019 CSCO乳腺癌诊疗指南指出,应充分告知所有HER2阳性复发转移乳腺癌患者,及时接受抗HER2靶向治疗的获益及必要性。晚期乳腺癌的抗HER2治疗不仅要及时,更要规范和持久,甚至贯穿全程。抗HER2治疗一线应以曲妥珠单抗为基础,对于曲妥珠单抗的再应用,指南认为在新辅助治疗有效、辅助治疗结束1年以后复发、解救治疗有效后停药,这三种情况均可应用。因此在一线曲妥珠单抗进展后推荐二线继续使用抗HER2靶向治疗,持续抑制HER2通路能够给患者带来持续的生存获益[5-6]。
综上所述,该病例是基于指南规范,同时又基于临床现实合理调整的病例,很有启示。对于HER2阳性乳腺癌患者来说,强调了抗HER2治疗的早期性、必要性和重要性。在临床工作中应充分认识到及时接受抗HER2靶向治疗的重要性及必要性。
1. Kataoka K, Tokunaga M, Mizusawa J, et al. A randomized Phase II trial of systemic chemotherapy with and without trastuzumab followed by surgery in HER2-positive advanced gastric or esophagogastric junction adenocarcinoma with extensive lymph node metastasis: Japan Clinical Oncology Group study JCO[J]. Japanese Journal of Clinical Oncology, 2015, 45(11):1082-1086.
2. Slamon D J, Leylandjones B, Shak S, et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2.[J]. N Engl J Med, 2001.
3.Yau T , Swanton C , Chua S , et al. Incidence, pattern and timing of brain metastases among patients with advanced breast cancer treated with trastuzumab[J]. Acta Oncologica, 2006, 45(2):196-201.
4. Ramakrishna Naren,Temin Sarah,Chandarlapaty Sarat et al. Recommendations on Disease Management for Patients With Advanced Human Epidermal Growth Factor Receptor 2-Positive Breast Cancer and Brain Metastases: ASCO Clinical Practice Guideline Update.[J] .J. Clin. Oncol., 2018, 36: 2804-2807.
5. Extra J M, Antoine E C, Vincentsalomon A, et al. Efficacy of Trastuzumab in Routine Clinical Practice and After Progression for Metastatic Breast Cancer Patients: The Observational Hermine Study[J]. Oncologist, 2010, 15(8):799.
6. Verma S, Miles D, Gianni L, et al. Trastuzumab emtansine for HER2-positive advanced breast cancer.[J]. New England Journal of Medicine, 2013, 368(25):1783-91.











 苏公网安备32059002004080号
苏公网安备32059002004080号


