
第62例
HER2扩增阳性乳腺癌约占乳腺癌总数的20%~30%,素来被称为“最凶险”乳腺癌,与肿瘤侵袭性强、复发率高有关,患者预后不良。本例患者在接受围手术期双靶联合化疗后疾病复发,再次行抗HER2治疗取得了明显的临床获益。

中山大学肿瘤防治中心内科
2004年获中山大学肿瘤内科博士学位
2011—2014年先后前往美国哈佛医学院丹娜法伯癌症中心及美国MD 安德森癌症中心做访问学者
获2014美国国家癌症基金美中抗癌协会年度转化医学奖
中国抗癌协会青年理事
中国抗癌协会临床化疗专业委员会秘书长,青年委员会副主委
中国抗癌协会CMUP专业副主委
中国抗癌协会肿瘤微环境专业委员会常委
中国抗癌协会科普专业委员会常委
中国临床肿瘤学会(CSCO)乳腺专业委员会常委
广东省医学会肿瘤内科分会秘书长兼青委会主委
广东省胸部肿瘤防治研究会乳腺癌分会副主任委员
广东省女医师协会乳腺癌分会副主任委员

中山大学肿瘤防治中心内科副主任医师
专业特长:乳腺癌等肿瘤内科临床诊治工作
2003年—2010年:中山大学临床医学七年制
2010年—2013年:中山大学肿瘤防治中心内科 肿瘤学博士
2013年—至今:中山大学肿瘤防治中心内科工作
以第一作者发表SCI文章10余篇。主持一项国家自然科学基金青年基金,参与多项国家及省部级科研课题。学术职位:广东省化疗与姑息治疗青年委员会委员
基本病史及辅助检查
患者女性,35岁,月经规律。2016年8月主因“发现右乳肿物4年,迅速增大半年”就诊于我院。既往体健,否认慢性病、传染病史。
入院查体:右侧乳腺皮肤发红发热,可触及疼痛,右乳内上可触及多个结节,质硬、不可推动,活动度差,最大约9 cm×8cm,右腋窝及右锁骨上可分别触及大小约2cm和1cm质硬淋巴结,活动差。
影像学检查示:①乳腺超声示:右乳腺11点至3点可见实性病灶,考虑乳腺癌可能性大,BI-RADS 5类。右侧腋窝腋下组、腋中组、腋上组多发淋巴结、(图1):右乳内上象限肿块,符合乳腺癌表现,BI-RADS 5类。右腋窝可见肿大淋巴结,考虑转移。③胸部CT(图2)示:右乳多发病灶,考虑乳腺癌可能性大;右侧腋窝及右锁骨上多发肿大淋巴结,结合病史考虑转移;左肺下叶外及地段类结节灶,考虑增殖灶可能性大。
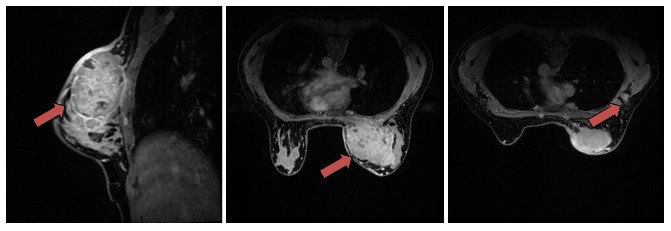
图1 乳腺MRI(2016年8月)
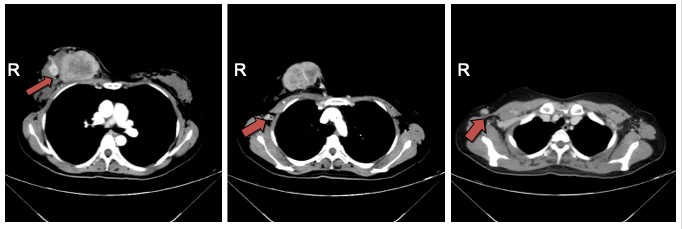
图2 胸部CT(2016年8月)
患者排除明显穿刺禁忌,行超声引导下右乳肿块穿刺活检术,病理示:(右乳肿块)浸润性导管癌。免疫组化结果:ER(-),PR(-),HER2(3+),Ki-67 (50%)。
结合患者病史、影像学检查和病理穿刺结果,目前诊断为:右侧乳腺浸润性导管癌cT4N3M0 ⅢC期,HER2阳性型。
治疗史
1.术前新辅助治疗
结合患者病史,与患者及家属沟通,行术前新辅助化疗联合双靶靶向治疗,方案为EC→TH+P(密集型)。2016年9月起行密集型EC方案化疗2周期,复查超声提示肿块较前略缩小,综合疗效评价为病情稳定(stable disease,SD)。在第3周期开始前肿块较前增大,患者要求更换治疗方案。2016年10月起行多西他赛联合曲妥珠单抗(TH)方案治疗1周期,后行多西他赛+曲妥珠单抗+帕妥珠单抗(TH+P)方案治疗4周期,具体用法为:帕妥珠单抗420mg (首剂840mg) d1,曲妥珠单抗6mg/kg(首剂8mg/kg)d1,多西他赛75mg/m2 d1。复查胸部CT提示:右乳肿物较前明显缩小,右腋窝和锁骨上淋巴结较前缩小,综合疗效评价为部分缓解(partial response,PR)。
2.手术治疗
患者于2017年2月行全麻下右乳腺癌改良根治术,病理示:(乳腺癌新辅助化疗后,右侧)浸润性导管癌,肿物大小为4cm×3cm×2.5cm ,SBR Ⅱ级,伴较多中级别导管内癌,未见明显脉管癌栓及神经侵犯。右腋下组淋巴未见转移(0/15枚),右腋中组淋巴结未见转移(0/11枚)。结合病史和手术病理,目前诊断为:右乳腺浸润性导管癌(ypT2N0M0 ⅡA期)。
3.术后治疗
患者术后2017年3月起至11月行H+P双靶治疗12周期,期间接受了右侧胸壁50GY+右侧内乳区60GY+双侧锁骨上区60GY局部放疗。治疗结束后定期复查,未见疾病明显复发或转移征象。
4.再次复发
患者2018年11月复查超声时提示:左颈部Ⅳ区颈静脉角处可见1枚淋巴结,大小约13mm×9mm,椭圆形,边界清,皮髓质分界不清处,淋巴门未探及,结合病史考虑转移。后PET/CT检查(图3)示:右乳腺癌综合治疗后,右侧胸壁及右腋窝多发条片影,代谢略活跃,考虑治疗后改变。左锁骨上淋巴结代谢活跃,考虑转移瘤,余部位未见明显异常。后行超声引导下左颈部淋巴结活检穿刺示:穿刺组织中见癌细胞,结合病史及免疫组化符合乳腺癌转移。免疫组化示:ER(-),PR(+,50%),HER2(3+),Ki-67(+70%)。综合疗效评价为病情进展(progressive disease,PD),无病生存期(disease-free survival,DFS)为20个月。
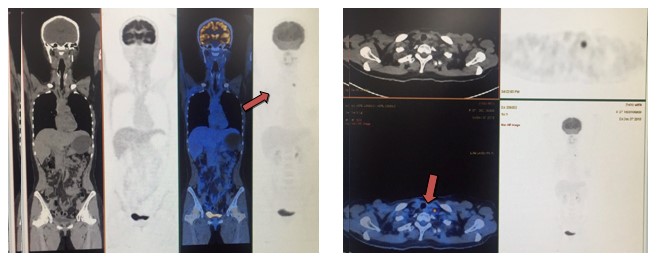
图3 PET/CT检查(2018年11月)
经与患者及家属沟通,反复告知乳腺癌中抗HER2治疗的重要意义,2018年12月起一线行长春瑞滨联合曲妥珠单抗+帕托珠单抗(NH+P)方案治疗5周期。第2、4周期治疗后颈部和胸部CT提示:双侧腋窝、锁骨上及内乳区未见明显肿大淋巴结,综合疗效评价为疾病完全缓解(complete response,CR)。患者目前P+H方案维持治疗中,定期复查未见疾病明显复发或转移征象。
总结
患者中年女性,月经规律。2016年8月主因“发现右乳肿物4年,迅速增大半年”就诊于我院。超声引导下右乳肿块穿刺示:(右乳肿块)浸润性导管癌。免疫组化:ER(-),PR(-),HER2(3+),Ki-67 (50%)。2周期ddEC方案治疗后因肿块增大,更换为TH+P方案治疗4周期。后行右乳腺癌改良根治术,病理示:(乳腺癌新辅助化疗后,右侧)浸润性导管癌,SBR Ⅱ级,右腋窝淋巴结无转移(0/26枚)。术后H+P方案12周期双靶治疗,期间联合放疗。2018年复发一线给予NT+P方案治疗5周期,疗效CR,目前P+H方案维持治疗中。
点评专家

任职于国家癌症中心、中国医学科学院肿瘤医院
承担了3项“国家自然科学基金”,1项“863” 课题。
获得中国抗癌协会科技奖一等奖、华夏医学科技奖一等奖、中华医学科技奖三等奖、北京市科学技术奖二等奖
中国抗癌协会乳腺癌专业委员会副秘书长
北京乳腺病防治学会国际医疗专业委员会主任委员
中国老年学会肿瘤专业委员会常委
中国医药教育协会乳腺疾病专业委员会常委
北京乳腺病防治学会内科专业委员会常委
M.D.Anderson 医院访问学者
点评
多项研究显示,有效的新辅助治疗,可以改善局部晚期乳腺癌、炎性乳腺癌的远期预后,同时能提高保乳率,增强患者的治疗信心。当前CSCO指南2019年版HER2阳性乳腺癌术前治疗适应证主要有以下几点:满足以下条件之一者可选择术前新辅助药物治疗:①肿块较大(>5cm);②腋窝淋巴结转移;③有保乳意愿,但肿瘤大小与乳房体积比例大难以保乳者。
在新辅助治疗方案选择方面,HER2阳性乳腺癌术前治疗目前指南Ⅰ级推荐为含曲妥珠单抗的方案和优先选择含紫杉类的方案。曲妥珠单抗联合化疗与单用化疗相比能够显著提高病理完全缓解率(pCR),既往NOAH研究奠定了曲妥珠单抗在HER-2阳性乳腺癌新辅助治疗中的标准地位。NeoSphere研究结果显示[1]曲妥珠单抗+帕妥珠单抗双靶向联合化疗显著提高pCR率并改善患者生存。APHINITY研究同样显示[2],辅助双靶治疗(曲妥珠单抗+帕妥珠单抗)进一步减少HER2阳性患者复发或死亡风险19%。在更新后的CSCO 2019年版《乳腺癌诊疗指南》中,双靶联合多西他赛(TH+P)方案作为HER2阳性术前新辅助乳腺癌治疗的1A级证据推荐。总之HER2 阳性乳腺癌患者新辅助治疗中,曲妥珠单抗是基本药物,应优先考虑含曲妥珠单抗的治疗方案,在此基础上可联合紫衫类或蒽环类药物。在标准曲妥珠单抗治疗的前提下,双靶向治疗有良好的应用前景。
该患者在新辅助治疗方面,选择EC→TH+P方案是目前新辅助治疗中标准方案之一。但实际应用中,在观察到EC方案治疗期间病情进展,根据患者的疗效评估及时调整治疗方案是非常合适的,及时给予紫杉类药物化疗与双靶联用,取得了较为理想的效果,为手术争取到了宝贵的时机,由此可见在HER2阳性乳腺癌患者中,抗HER2治疗已成为其治疗中非常重要的一部分,紫杉类和双靶的强强联合达到了控瘤、缩瘤的目前,保证了手术的顺利进行。
值得警惕的是早期HER2阳性乳腺癌复发的风险为HER2阴性患者的2~5倍,即使很小的肿瘤也可能复发转移。目前通过1年标准辅助治疗,已显著提高了HER2阳性早期乳腺癌的治疗效果,3/4的早期HER2阳性乳腺癌患者达到治愈,但同时仍有25%的患者在10年内出现复发或死亡,其中淋巴结阳性或激素受体阴性的患者具有更高的复发死亡风险,10年复发转移率超过30%。该患者DFS为20个月,此病例充分的警示我们HER2阳性乳腺癌往往比HER2阴性肿瘤更具侵袭性。
目前,以曲妥珠单抗、帕妥珠单抗为基础联合化疗的方案是晚期一线乳腺癌解救化疗的标准方案。持续抑制HER2通路能够带来持续的生存获益[3~4],故该患者病情再度复发继续使用在新辅助治疗中曾获益的抗HER2药物治疗。待其化疗病灶明显缩小后双靶联合治疗至今未见明显复发。患者在接受双靶联合化疗时,有效化疗应持续至少6~8个周期,同时取决于肿瘤疗效和患者对化疗的耐受程度可适当延长或减少化疗的周期数。目前仍建议患者继续使用帕妥珠单抗和曲妥珠单抗维持治疗。
此病例提示,在HER2阳性的各期乳腺癌中,抗HER2治疗均发挥中流砥柱的作用。该病例基于指南规范,同时又基于临床现实合理调整治疗从而获得相对较好的疗效,再次印证了诊疗规范的必要性和有效性。
1. Von Minckwitz G, Procter M, De Azambuja E, et al. Adjuvant Pertuzumab and Trastuzumab in Early HER2-Positive Breast Cancer[J]. N Engl J Med, 2017, 377(2):122-131.
2.Gianni L , Dafni U , Gelber R , et al. Treatment with trastuzumab for 1 year after adjuvant chemotherapy in patients with HER2-positive early breast cancer: a 4-year follow-up of a randomised controlled trial.[J]. Lancet Oncology, 2011, 12(3):236-244.
3. Extra J M, Antoine E C, Vincentsalomon A, et al. Efficacy of Trastuzumab in Routine Clinical Practice and After Progression for Metastatic Breast Cancer Patients: The Observational Hermine Study[J]. Oncologist, 2010, 15(8):799.
4. Verma S, Miles D, Gianni L, et al. Trastuzumab emtansine for HER2-positive advanced breast cancer.[J]. New England Journal of Medicine, 2013, 368(25):1783-91.











 苏公网安备32059002004080号
苏公网安备32059002004080号


