淋巴瘤(lymphoma)是我国最常见的恶性肿瘤之一。20世纪90年代以来,随着靶向抗肿瘤药物利妥昔单抗的应用,其缓解率和治愈率日益提高。对于治疗后达到完全缓解(CR)的淋巴瘤患者与那些达到部分缓解(PR)的患者相比有更好的预后吗?

北京大学肿瘤医院党委书记、大内科主任、淋巴瘤科主任
主要专注于恶性淋巴瘤诊断治疗
中国临床肿瘤学(CSCO)常务理事
CSCO抗淋巴瘤联盟主任委员
中国抗癌协会肿瘤靶向专业委会副主任委员
中国老年学会老年肿瘤专业委员会常委
恶性淋巴瘤的治疗目标是取得CR以期获得长期生存
取得CR以期获得长期生存是治疗恶性淋巴瘤的最终目标[1]。在一线治疗中获得完全缓解的患者才更有可能最终临床治愈。对88例初治弥漫大B细胞淋巴瘤(DLBCL)患者疗效及预后因素分析表明,DLBCL患者若能治疗达到CR并维持CR,其复发及进展少见,基本达到临床治愈[2]。
当前评效标准中CR的定义
目前,恶性淋巴瘤的疗效评价采用2014年Lugano会议修订标准[3],分为影像学缓解(CT/MRI)评效和代谢缓解(PET-CT评效),其基础是18F-FDG PET扫描结果或CT扫描上的肿瘤二维测量结果。该标准对CR的定义见表1。
表1 2014年Lugano会议修订标准对CR的定义
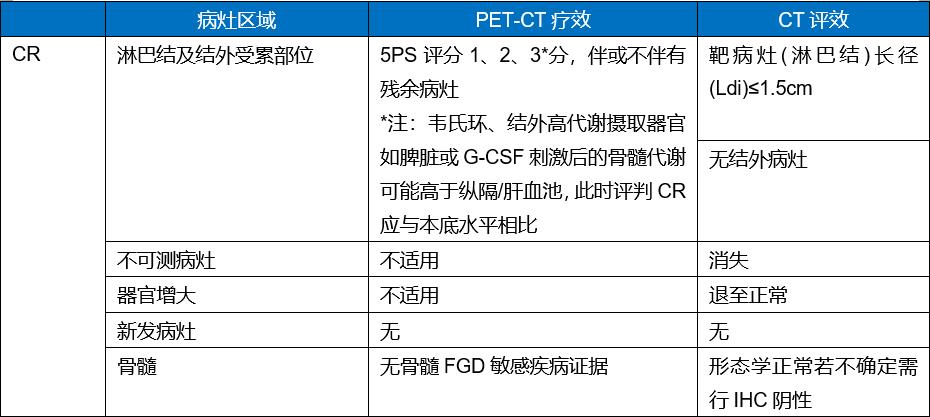
《中国临床肿瘤学会(CSCO)淋巴瘤诊疗指南2018. V1》推荐治疗期间每2~4周期进行影像学检查和疗效评价。治疗后评效:如采用CT或MRI,建议全部治疗结束后4周评价和确认最终疗效;如采用PET-CT检查,建议末次化疗后6~8周,或放疗后8~12周[4]。
CR与恶性淋巴瘤患者的预后显著相关
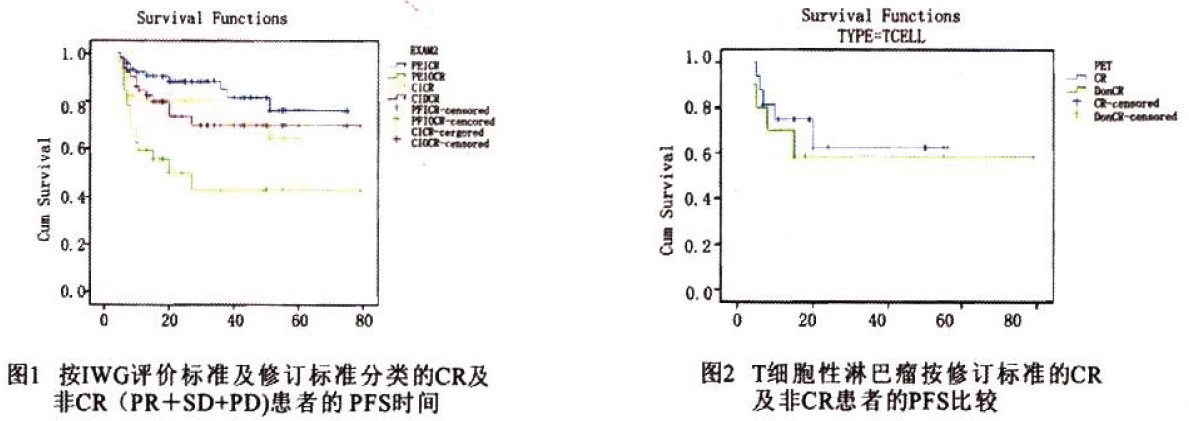
正如预期,多项研究已证实达到完全缓解(CR)患者的预后优于未完全缓解或部分缓解的患者[5]。黄岩等对113例初治恶性淋巴瘤患者(其中非霍奇金淋巴瘤102例,包括60例DLBCL,4例滤泡性淋巴瘤)的分析表明,IWG评价标准及修订标准评价的非CR患者的PFS均低于CR患者(P=0.00)。而在不同组织类型中,T细胞淋巴瘤患者按修订标准评价的CR和非CR的患者PFS无统计学差异(P=0.797)[1](图1、图2)。
Trotman J等进行的开放标签、平行对照、随机、3期试验(GALLIUM研究)纳入1202例先前未治疗的CD20+滤泡性淋巴瘤患者,评估一线免疫化疗后PET评估达到缓解患者的预后[6]。结果表明,独立审查委员会(IRC)基于IHP 2007标准,PET评估完全缓解患者(87.8%, 95% CI 83.9~90.8)的2.5年PFS率显著优于非完全缓解者(72.0%, 95% CI 63.1~79.0) (HR 0.4, 95% CI 0.3~0.6, P<0.0001);基于Lugano 2014 标准,完全代谢缓解患者(87.4%, 95% CI 83.7~90.2)的2.5年PFS率显著优于非完全代谢缓解患者(54.9%,95% CI 40.5~67.3)( HR 0.2, 95% CI 0.1~0.3, P<0.0001)。更为重要的是,诱导治疗结束时PET评估(Lugano 2014 标准,IRC)完全代谢缓解患者的OS显著优于未达完全缓解患者(图3)。
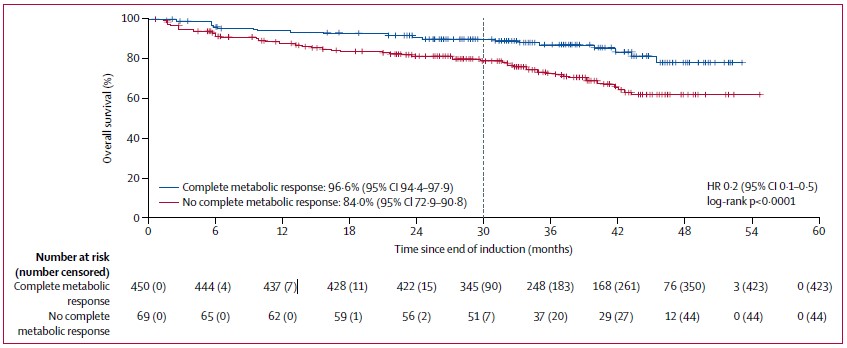
图3. Landmark分析评估诱导治疗结束时IRC评估为完全代谢缓解患者的OS
6~8个周期R-CHOP规范化治疗完全缓解率更优,预后更佳
发表在《新英格兰医学杂志》上的GEl.A LNH 98.5 Ⅲ期临床研究,纳入399例初治DLBCL患者,随机分为接受8个周期CHOP每3周治疗或8个周期CHOP+利妥昔单抗(每个疗程的第1天)治疗。比较了利妥昔单抗联合CHOP方案(R-CHOP)和CHOP方案对老年DLBCL患者的疗效,结果发现,R-CHOP方案组和CHOP组的完全缓解率分别为76% vs 63%(P=0.005),肿瘤治愈率(WHO定义的10年无病生存)从40%跨越到了60%以上[7,8]。
对于年轻DLBCL患者,MinT研究中位随访34个月也证实[9],6×R-CHOP样方案较6×CHOP样方案显著提高DLBCL患者CR/CRu率:86% vs 68%( P<0.0001); 中位随访6年[10],6×R-CHOP样方案显著提高患者3年、6年OS率(93% vs 84%,P=0.0001;90.1% vs 80%,P=0·0004)。
前瞻性、随机、开放标签、多中心、Ⅲ期(GLSG 2000)研究[11],纳入428例既往未经治疗的晚期滤泡性淋巴瘤(III~IV期),旨在评估利妥昔单抗联合化疗对比单独化疗治疗既往未治疗的晚期滤泡性淋巴瘤患者的预后,结果表明,R-CHOP组复发或进展事件发生率显著更低,使得缓解持续时间显著延长(P=0.001),R-CHOP组总生存显著优于CHOP组(P=0.016)。
为什么需要强调6~8周期的规范化免疫治疗?利妥昔单抗6~8个周期治疗后达到稳态血药浓度。PK数据显示:在整个8周期的R-CHOP治疗过程中波谷利妥昔单抗的水平持续升高,提示直至第8次利妥昔单抗给药后才能达到利妥昔单抗血清积累和坪浓度(稳态),最大程度发挥利妥昔单抗多重抗肿瘤作用[12] (图4)。
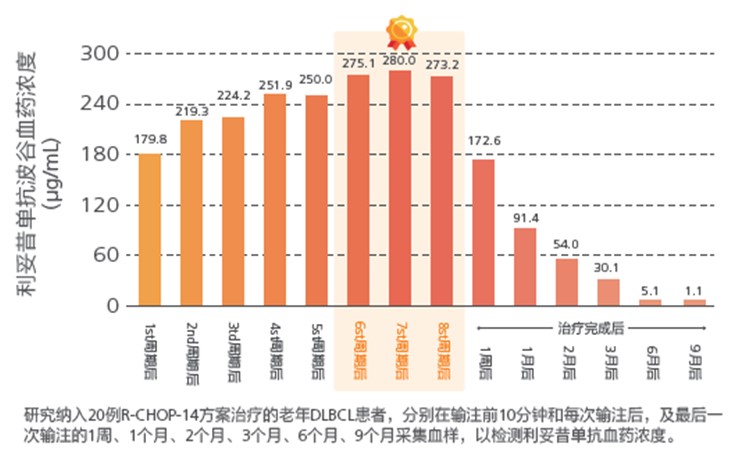
图4.整个8周期的R-CHOP治疗过程中利妥昔单抗的水平
Borel C等分析了在法国多中心地区队列中登记的380例接受R-CHOP或R-CHOP样方案一线治疗的DLBCL患者的数据[13]。采用接受剂量强度和计划剂量强度(DI)的比值来衡量治疗依从性,即根据相对DI(RDI)分为“<85%”和“≥85%”组。结果表明,与相对剂量强度(RDI)<85%的患者相比,RDI≥85%的患者2年生存率显著提高(图5)。
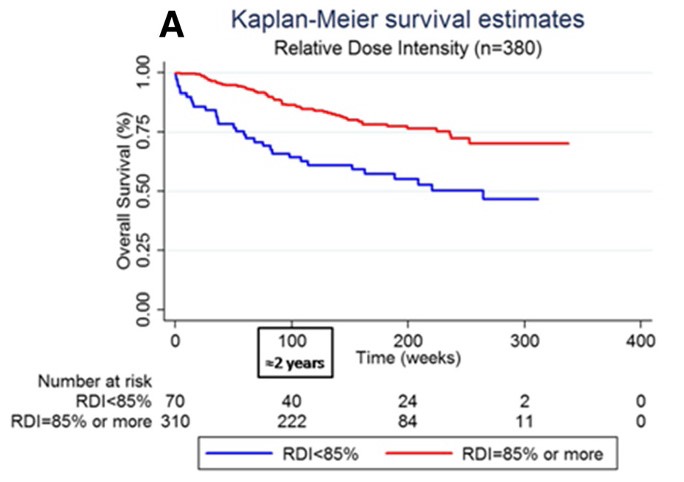
图5. 相对DI(RDI)<85%和≥85%患者的OS
综上所述,疾病缓解水平与恶性淋巴瘤患者的预后显著相关,在一线治疗中获得完全缓解的患者才更有可能最终临床治愈。6~8周期R-CHOP方案规范化治疗显著改善恶性淋巴瘤患者的CR率,且延长缓解持续时间和OS。
1. 黄岩,樊卫,曹亚兵,等.恶性淋巴瘤的疗效评价-国际工作组标准与修订标准的比较[J].肿瘤预防与治疗,2008,21(2):119-122,118,前插2.
2. 杨飞燕. 88例初治弥漫大B细胞淋巴瘤患者疗效及预后因素分析[D].广西医科大学,2011.
3. Cheson BD, Fisher RI, Barrington SF, et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification[J]. J Clin Oncol.,2014,32(27):3059-3068.
4. 中国临床肿瘤学会. 中国临床肿瘤学会(CSCO)淋巴瘤诊疗指南2018. V1[M].北京:人民卫生出版社,2018.
5. Buckstein R, Pennell N, Berinstein NL.. What is remission in follicular lymphoma and what is its relevance?[J]. Best Pract Res Clin Haematol,2005 ,18(1):27-56.
6. Trotman J, Barrington SF, Belada D, et al. Prognostic value of end-of-induction PET response after first-line immunochemotherapy for follicular lymphoma (GALLIUM): secondary analysis of a randomised, phase 3 trial[J]. Lancet Oncol. 2018,19(11):1530-1542.
7. Coiffier B, Lepage E, Briere J,et al. CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large-B-cell lymphoma[J]. N Engl J Med,2002,346(4):235-242.
8. Coiffier B, Thieblemont C, Van Den Neste E, et al. Long-term outcome of patients in the LNH-98.5 trial, the first randomized study comparing rituximab-CHOP to standard CHOP chemotherapy in DLBCL patients: a study by the Groupe d'Etudes des Lymphomes de l'Adulte[J]. Blood, 2010,116(12):2040-2045.
9. Pfreundschuh M, Trümper L, Osterborg A, et al. CHOP-like chemotherapy plus rituximab versus CHOP-like chemotherapy alone in young patients with good-prognosis diffuse large-B-cell lymphoma: a randomised controlled trial by the MabThera International Trial (MInT) Group[J]. Lancet Oncol, 2006,7(5):379-391.
10. Pfreundschuh M, Kuhnt E, Trümper L, et al. CHOP-like chemotherapy with or without rituximab in young patients with good-prognosis diffuse large-B-cell lymphoma: 6-year results of an open-label randomised study of the MabThera International Trial (MInT) Group[J]. Lancet Oncol,2011,12(11):1013-1022.
11. Hiddemann W, Kneba M, Dreyling M, et al. Frontline therapy with rituximab added to the combination of cyclophosphamide, doxorubicin, vincristine, and prednisone (CHOP) significantly improves the outcome for patients with advanced-stage follicular lymphoma compared with therapy with CHOP alone: results of a prospective randomized study of the German Low-Grade Lymphoma Study Group[J]. Blood,2005,106(12):372537-32.
12. Müller C, Murawski N, Wiesen MH, et al. The role of sex and weight on rituximab clearance and serum elimination half-life in elderly patients with DLBCL[J]. Blood,2012,119(14):3276-3284.
13. Borel C, Lamy S, Compaci G, et al. A longitudinal study of non-medical determinants of adherence to R-CHOP therapy for diffuse large B-cell lymphoma: implication for survival[J]. BMC Cancer,2015,15:288.











 苏公网安备32059002004080号
苏公网安备32059002004080号


