2019年AACR会议于当地时间3月29日-4月3日在美国亚特兰大盛大开幕,今年会议的主题是“Integrative Cancer Science • Global Impact • Individualized Patient Care”。会议火热进行,各项重磅研究相继公布,帕博利珠单抗多项研究荣登2019 AACR。2016年,基于KEYNOTE-024帕博利珠单抗单药获批在美国上市用于PD-L1 TPS ≥50%的一线治疗,但帕博利珠单抗单药在真实世界的疗效如何呢?2019 AACR上公布了一项美国真实世界的研究,【肿瘤资讯】带你走进AACR,一探究竟。
本研究为一项回顾性研究,回顾性搜集、分析Flatiron Health全国代表性数据库电子健康记录(EHR)数据。患者纳入标准为:年龄≥18岁的成年患者;经组织学确认为 IV期非小细胞肺癌(NSCLC);PD-L1 TPS ≥50%;无文件记录的EGFR/ALK突变;ECOG PS评分在0-1分;2016年12月1日后接受帕博利珠单抗治疗。研究分成2个队列,分别是HER队列和Spotlight队列。HER队列纳入2016年10月24日至2018年5月31接受一线帕博利珠单抗治疗的患者,Spotlight队列纳入的为2016年12月1日到2017年11月30日接受一线帕博利珠单抗治疗的患者。研究终点包括总生存(OS)、真实世界进展(rwP)、真实世界肿瘤反应(rwTR)、停止帕博利珠单抗治疗原因以及接下来系统治疗方式包括哪些。
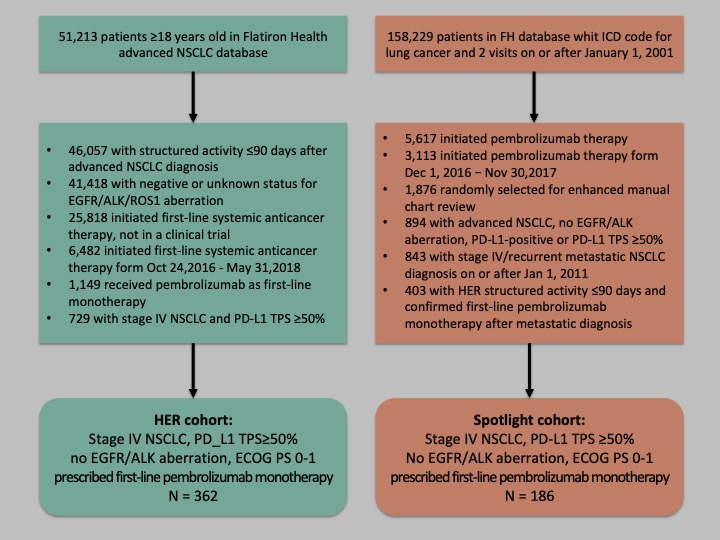
图1 患者选择流程图
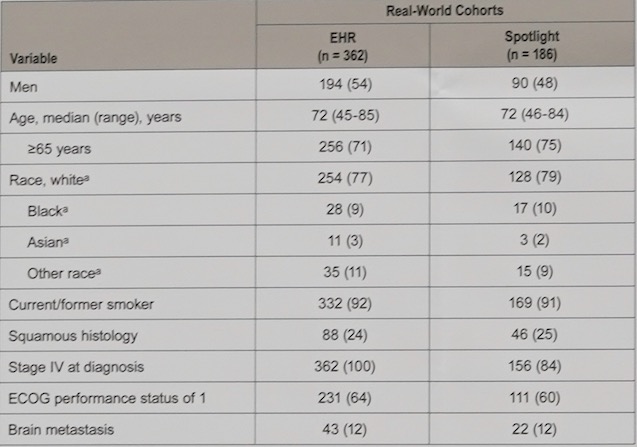
HER队列纳入了362例患者,Spotlight队列纳入了186例患者,两个真实世界队列患者基线特征基本相似,除了Spotlight队列男性患者更少以及更少的PS评分为1分的患者。两个队列患者基线特征如表1。
表1 患者基线特征
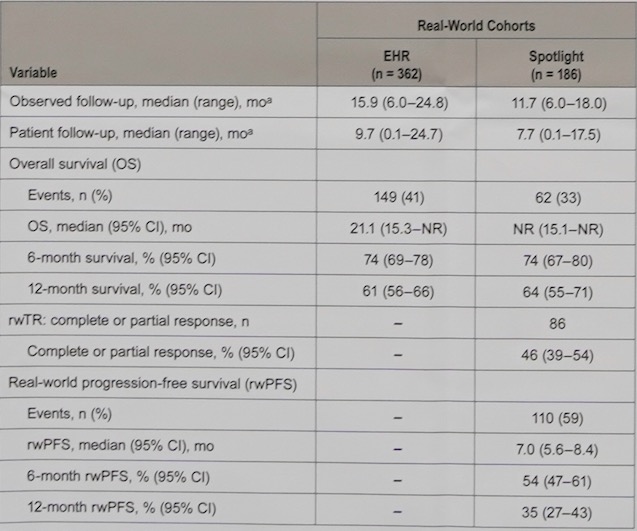
 HER队列和Spotlight队列患者的中位随访时间分别为9.7(95% CI 0.1~24.7)个月和7.7(95% CI 0.1~17.5)个月;两组达到OS终点事件的人数分别为149(41%)和62(33%),中位的OS分别为21.1(95% CI 15.3~NR)个月(图2)和NR(95% CI 15.1~NR)个月(图3)。Spotlight队列患者的中位无进展生存为7.0 (95% CI 5.6~8.4)(图4)。
HER队列和Spotlight队列患者的中位随访时间分别为9.7(95% CI 0.1~24.7)个月和7.7(95% CI 0.1~17.5)个月;两组达到OS终点事件的人数分别为149(41%)和62(33%),中位的OS分别为21.1(95% CI 15.3~NR)个月(图2)和NR(95% CI 15.1~NR)个月(图3)。Spotlight队列患者的中位无进展生存为7.0 (95% CI 5.6~8.4)(图4)。
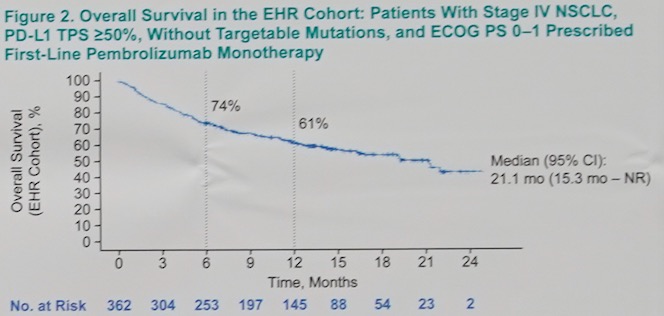
图2. HER队列患者的总生存
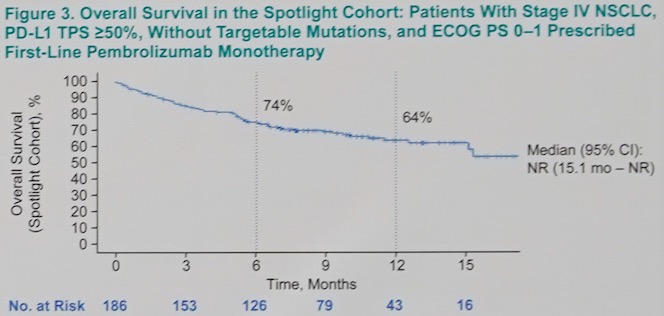
图3. Spotlight队列患者的总生存
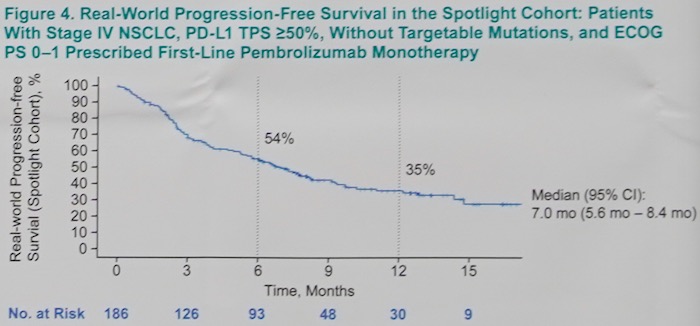
图.4 Spotlight队列患者的无进展生存
HER队列和Spotlight队列两组患者6个月和12个月的生存率分别为 74(95% CI 69~ 78)和61(95% CI 56~66)、74(95% CI 67~80)和64(95% CI 55~71)。其他患者患者生存数据如表2所示。
表2. 真实世界中接受一线帕博利珠单抗治疗的患者结局
 在Spotlight队列,有93位(50%)的患者终止帕博利珠单抗治疗,原因包括进展(42,45%)、治疗相关不良反应事件(22,24%)、疾病相关症状(与治疗无关)(17,18%)、患者要求4(4%)、经济原因(1,1%)以及其他原因(13,14%)和未知原因(0),并且每个患者能有一个以上的的原因(表3)。
在Spotlight队列,有93位(50%)的患者终止帕博利珠单抗治疗,原因包括进展(42,45%)、治疗相关不良反应事件(22,24%)、疾病相关症状(与治疗无关)(17,18%)、患者要求4(4%)、经济原因(1,1%)以及其他原因(13,14%)和未知原因(0),并且每个患者能有一个以上的的原因(表3)。
表3. Spotlight队列患者终止帕博利珠单抗的原因
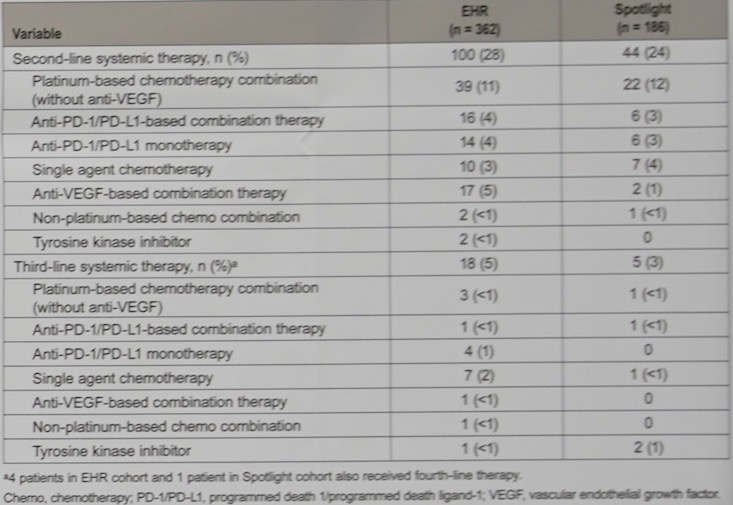
 患者在终止帕博利珠单抗一线治疗后,接下来接受的系统治疗方式如表4所示。
患者在终止帕博利珠单抗一线治疗后,接下来接受的系统治疗方式如表4所示。
表4. 患者终止帕博利珠单抗治疗后接下来采用的系统治疗方式
结论
1. 在美国肿瘤治疗真实世界中,PD-L1 TPS ≥50%晚期NSCLC接受一线帕博利珠单抗治疗患者的年龄较临床试验更大,并且有更少的男性患者;
2. 真实世界中患者获益(OS、rwPFS、rwTR)和III期临床研究的结果基本一致,也进一步证实了帕博利珠单抗在真实世界的有效性;
3. 疾病进展是真实世界中停药的最常见原因;
截止数据搜集日期之前,Spotlight队列有24%的患者二线采用的系统治疗方式为铂类为基础的化疗。
KEYNOTE-024研究回顾
KEYNOTE-024研究是一项国际化、随机、开放标签、Ⅲ期临床研究,评估了帕博利珠单抗(pembrolizumab)和铂类为基础的化疗用于未经治PD-L1肿瘤比例评分(TPS)为50%以上且无EGFR突变或ALK易位的晚期非小细胞肺癌(NSCLC)患者。在第二次中期分析时,中位随访11.2个月时,与化疗组相比,帕博利珠单抗明显改善患者的无进展生存期(PFS;HR 0.50; 95% CI, 0.37~0.68;单侧P=0.001)和总生存期(OS;HR 0.60;95% CI, 0.41~0.89;单侧P= 0.005)。两组均未达到中位OS。
中位随访25.2个月时,研究者再次更新了OS分析数据、疗效和安全性。研究者还公布了从化疗交叉到帕博利珠单抗治疗的结果,并分析了交叉治疗存在的潜在偏差,研究结果于2018年发表在Journal of Clinical Oncology杂志。
研究入组来自16个国家142个地区的305例患者,随机接受帕博利珠单抗(n=154)或化疗(n=151)。截至2017年7月10日,中位随访时间为25.2个月,235例患者已停止最初设计的研究治疗。帕博利珠单抗组和化疗组的中位治疗时间分别为7.9个月和3.5个月。化疗组中82例患者进行了交叉治疗,交叉至帕博利珠单抗治疗。另外15例患者接受了交叉治疗之外的PD-1单抗治疗,交叉治疗的比率为65.1%(97/149)。
接受帕博利珠单抗交叉治疗患者的中位治疗持续时间为3.9个月。中止治疗后,帕博利珠单抗组中有56例患者继续接受一种或多种序贯治疗,包括手术治疗、放射治疗、化疗和免疫治疗。
进行本次分析时,169例患者死亡,帕博利珠单抗组和化疗组分别为73例和96例,两组患者的中位OS分别为30个月和14.2个月(HR=0.63;95%CI,[s1] 0.47~0.86;单侧近似P=0.002),12个月时,两组患者的总生存率分别为70.3%和54.8%,24个月的总生存率分别为51.5%和34.5%(图1),在所有亚组中,与化疗组相比,均观察到帕博利珠单抗使患者获益(图2)。
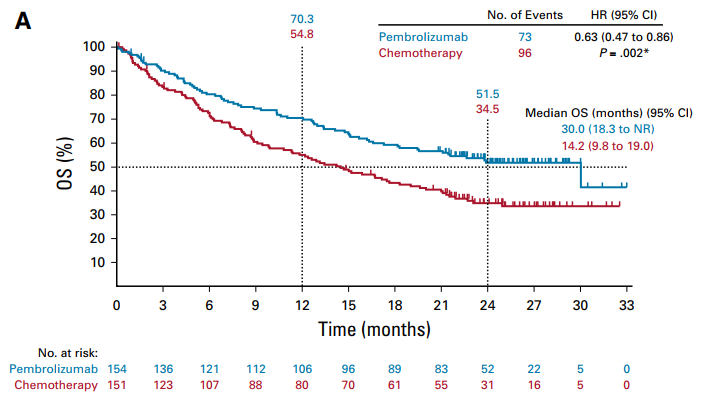
图1. OS分析图

图2. 各亚组OS分析图
82例接受交叉治疗帕博利珠单抗患者的ORR为20.7%,19例(23.2%)患者疾病稳定,中位应答时间为2个月,中位缓解持续时间(DOR)尚未达到(图3)。
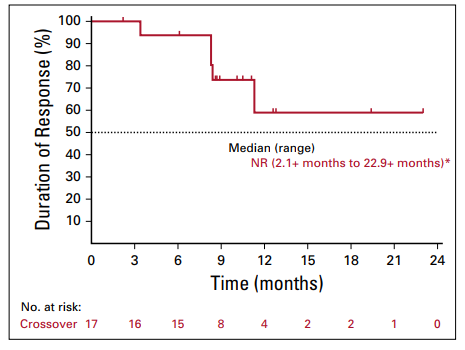
图3.交叉治疗组缓解持续时间分析
随机分配接受化疗的77例患者符合两阶段分析中第一阶段的预先规定的纳入标准(除非疾病进展,否则不停止进行化疗,进展时ECOG PS为0或1)。由于疾病进展,只有77例患者进行了交叉治疗。其中有63例患者在研究过程中交叉至帕博利珠单抗治疗;14例患者没有进行交叉治疗,其中有4例患者接受了其他PD-1单抗治疗。预计加速因子为4.00,表明与未经调整的结果相比,化疗组疾病进展后的生存期减少了75%,导致调整后的中位OS为8.7个月。
在第二阶段,化疗组调整后的OS与帕博利珠单抗组观察到的OS相比,调整后的HR为0.49(95% CI,0.34~0.69)(图5)。采用RPSFT和IPCW方法也得到相似的结果;RPSFT调整后的中位OS为11.8个月(95% CI,8.7个月~NR; 调整后HR=0.52; 95% CI, 0.33~0.75),IPCW调整后的OS为11.8个月(95% CI,8.7~21.3个月;调整后HR=0.52;95% CI,0.33~0.80)。
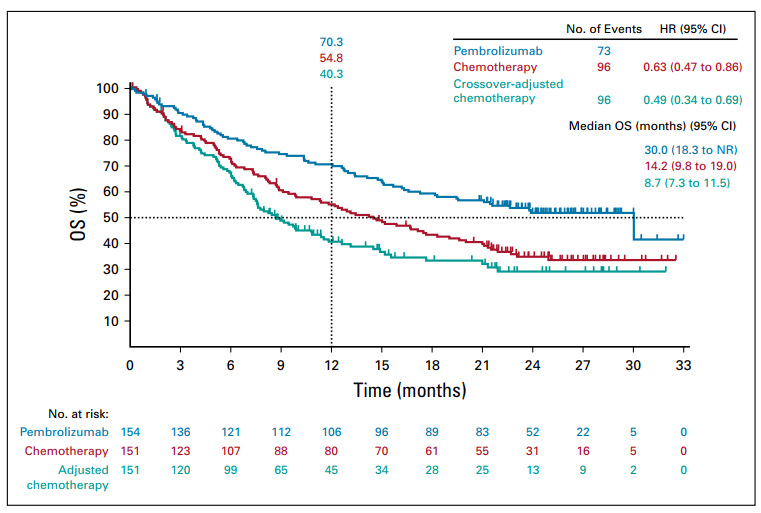
图5. 二阶段交叉试验OS分析图
在KEYNOTE-024的更新分析中,与基于铂类的化疗相比,帕博利珠单抗作为晚期NSCLC患者(PD-L1 TPS≥50%)的一线治疗,仍然使患者OS明显获益(HR,0.63;95%CI,0.47~0.86;近似P=0.002)。
在第二次中期分析中,虽然化疗组交叉治疗至帕博利珠单抗组,但仍能观察到OS的显著改善,随机分配至帕博利珠单抗组和化疗组的中位OS分别为30个月和14.2个月。这一结果优于使用铂类为基础的化疗一线治疗晚期NSCLC的疗效。交叉治疗研究显示,帕博利珠单抗作为二线治疗也显示出临床获益,ORR为20.7%,中位缓解持续时间(DOR)尚未达到。
研究结果进一步支持帕博利珠单抗可作为无EGFR/ALK突变且PD-L1 TPS≥50%晚期NSCLC患者的一线治疗方案。











 苏公网安备32059002004080号
苏公网安备32059002004080号


