2009年秦叔逵教授在ASCO大会进行的口头报告,揭开中国创新走向世界的序幕。如今,中国创新研究在ASCO上组团亮相已成为每年的常态。今年6月1-5日的ASCO2018年会上,中国共有5项研究入选大会口头报告。报告摘要于北京时间2018年5月17日6:00AM正式出炉,大量关键性临床数据首次公开,【肿瘤资讯】带您先睹为快!

卡培他滨联合Utidelone治疗转移性乳腺癌的有效性

徐兵河 教授(第二次ASCO大会口头发言)
中国医学科学院肿瘤医院
背景:埃博霉素类似物——Utidelone在II期及III期临床试验中均显示出优异的疗效,在此多中心III期临床试验中,比较了Utidelone联合卡培他滨对照卡培他滨单药化疗在曾接受紫杉类及蒽环类药物的转移性乳腺癌的疗效。
方法:本研究纳入405例患者,按2:1随机分为治疗组与对照组,治疗组(Utidelone 30 mg/m2/d d1~5 +卡培他滨 1000 mg/m2 bid d1~14),对照组(1250 mg/m2 bid d1~14)。共给药3周。ITT人群的OS、2年生存率和95%CI均使用Kaplan-Meier 进行双侧log-rank检验。
结果:随访至2018年3月9日,治疗组281例病人中180死亡(66.7%),对照组病人101例死亡(74.8%)。在ITT人群中,治疗组的总生存OS为14.75个月(95%CI 13.08-16.69),对照组的总生存OS为12.22个月(95%CI 11.14-14.26)。Utidelone联合用药显著提高了患者的总生存(HR 0.63;95% CI 0.45-0.88;p = 0.0047)。2年生存率联合组为39.0% (95% CI 33.2%, 45.1%),对照组为26.6% (19.4%, 35.0%),获得了约12.4% (1.9%- 22.4%;p = 0.015)的提高。周围神经病变是仅报告的3级不良事件,在Utidelone联合组发生率为25%,且该不良事件是可控且可逆的。值得注意的是,Utidelone引起非常轻微的骨髓抑制和肝脏毒性。Utidelone是第一个骨髓抑制不明显的微管抑制剂。
结论:该研究证明了Utidelone联合卡培他滨在曾接受紫杉类及蒽环类药物的转移性乳腺癌中的有效性及安全性。因此,其可作为转移性乳腺癌的一个临床选择。[1]
安罗替尼用于转移性软组织肉瘤:PFS显著优于对照组

依荷芭丽·迟 教授(第二次ASCO大会口头发言)
中国医学科学院肿瘤医院
背景: 目前在中国,软组织肉瘤(STS)一线化疗进展后的患者尚无标准治疗方案。在2016年ASCO大会上报道的安罗替尼单药用于STS的II期临床研究中,显示出安罗替尼较好的疗效。本研究旨在更大样本量的一线化疗进展后的晚期STS患者评估安罗替尼的疗效和安全性。
方法:研究入组了年龄18岁或以上,既往未接受抗血管生成治疗,组织学确诊的晚期STS患者,患者对含蒽环类药物的化疗无法耐受或进展,至少有1个满足RECIST 1.1标准的可测量病灶。入组患者随机2:1分配接受安罗替尼(12 mg/天,用药2周停药1周)或安慰剂治疗。入组患者的病理亚型包括:滑膜肉瘤(SS),腺泡状软组织肉瘤(ASPS), 平滑肌肉瘤(LMS)和其他。不同病理亚型的患者也作为分层因素,随机2:1分配至各治疗组。主要研究终点为无进展生存期(PFS)。本研究在ClinicalTrials.gov网站上进行注册,临床试验编号为NCT02449343。
结果:共233 例患者随机分配至安罗替尼组(n=158)或安慰剂组 (n=75),并纳入最后结果分析。安罗替尼组患者的PFS显著优于安慰剂组,中位PFS分别为6.27个月(95% CI:4.30-8.40)和1.47个月(95% CI:1.43-1.57) ,HR=0.33, p<0.0001。两组的客观缓解率分别为10.13% 和 1.33% (p=0.0145);疾病控制率分别为55.7% 和 22.67% (p<0.0001),差异均有显著统计学意义。滑膜肉瘤(SS) 的患者共57例,安罗替尼组和安慰剂组的mPFS分别为5.73个月和 1.43个月,HR=0.2, p<0.0001。腺泡状软组织肉瘤(ASPS)患者共56例,两组的mPFS分别为18.23个月和 3个月,HR=0.14, p<0.0001。平滑肌肉瘤(LMS)共41例,两组的mPFS分别为5.83个月和 1.43个月,HR=0.19, p<0.0001。最常见的3度或以上的不良事件为高血压(安罗替尼组和安慰剂组发生率分别为18.99% 和 0, p=0.00),Υ-谷氨酰转移酶升高 (4.43% 和 1.33%, p=0.44), 甘油三酯升高 (4.43% 和 0, p=0.10), 低密度脂蛋白升高 (3.16% 和 2.67%, p=1.00), 低钠血症(3.16% 和 1.33%, p=0.67)和中性粒细胞计数减少 (3.16% 和 0, p=0.18)。
结论: 对于标准化疗进展后的晚期STS患者,安罗替尼是一个新的治疗选择。[2]
达可替尼成为首个EGFR突变NSCLC一线治疗OS获益药物

莫树锦(Tony Mok)
FASCO首席作者,中国香港大学临床肿瘤学系
背景:正在进行的III期ARCHER1050研究显示,相比于吉非替尼,达可替尼(dacomitinib)用于EGFR阳性的晚期NSCLC一线治疗疗效卓越,主要研究终点PFS及ORR、TTF等终点均得到显著改善。为75.6%(95%CI:60.5-87.1),mPFS为18.2个月(95%CI:12.8-23.8),(Wu et al, Lancet Oncol, 2017)。此次报道是该研究的长期OS数据。
方法:新诊IIIB/IV期或复发、携带EGFR敏感突变(19外显子缺失或21号外显子L858R突变+/-20号外显子T790M突变)、非CNS转移的NSCLC患者按照1:1随机分配到达可替尼45 mg/每天或者吉非替尼 250 mg/每天;随机分层因素为种族及EGFR突变。
结果:截止2017年2月17日,中位随访时间为31.3个月,共计有220例(48.7%)死亡事件发生:达可替尼和吉非替尼组分别为103例(103/227,45.4%)和117例(117/225,52.0%)。相比于吉非替尼,达可替尼可显著提升患者OS(HR=0.76; 95% CI, 0.582–0.993; P = 0.044)。达可替尼和吉非替尼组的中位OS分别为34.1个月 (95% 29.5–37.7) 和 26.8 个月 (95% 23.7–32.1),30个月的OS分别为56.2%和46.3%。各亚组OS结果与总体结果一致,亚组分析结果见表1。
表1 种族和EGFR状态亚组分析结果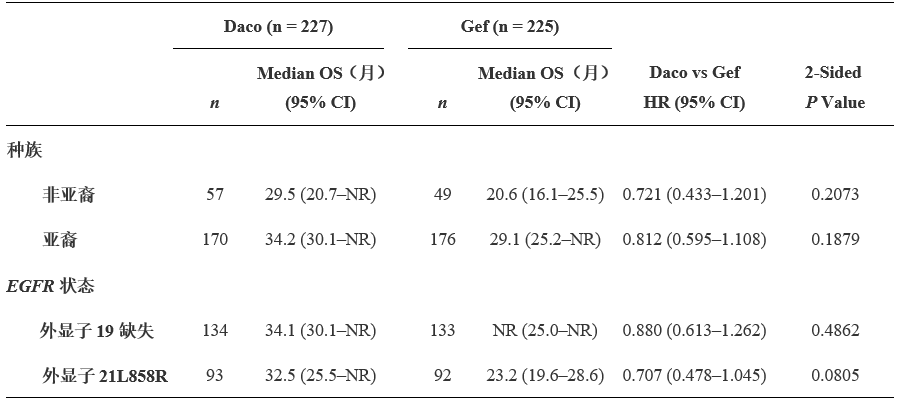
结论:ARCHER 1050是EGFR TKI的III期头对头研究,在EGFR敏感突变NSCLC患者一线治疗中,达可替尼是首个显示OS获益的药物。达可替尼有望成为该类患者一线治疗的新选择。临床试验编号:NCT01774721。[3]
FOWARC多中心随机试验最终结果

邓艳红 教授
中山大学附属第六医院
背景:FOWARC试验研究了FOLFOX6联合或不联合放疗对比5-FU化放疗新辅助治疗局部晚期直肠癌。早期次要终点的首要结果已经公布(Deng等,JCO 2016)。在这里,我们公布3年的主要终点即无病生存率(DFS)。
方法:2011年1月至2011年2月间,距肛门12厘米,II/III期的直肠癌患者被随机分配接受5-FU放疗(RT)(FU-RT治疗),或接受mFOLFOX6联合RT(FOLFOX-RT组),或接受4-6周期单独mFOLFOX6(FOLFOX组),如果需要可以进行围手术期放疗。主要终点是3年时的DFS,定义为从随机分组到不完全手术切除,局部或转移复发或死亡(以先发生者为准)的时间间隔。
结果:共有495名患者被按照1:1:1的比例随机分配到三个组。有418例患者接受了随访并遵照方案治疗,FU-RT组130例,FOLFOX-RT组142例,FOLFOX组146例。局部复发率分别为10.0%,8.5%和8.9%。在中位随访时间45.2个月后,FU-RT组35例患者发生了DFS相关事件,FOLFOX-RT组中37例患者(HR 1.031,95%CI 0.657~1.620)和FOLFOX组41例(HR 0.960,95%CI 0.615~1.497)。FU-RT组的3年DFS率为76.4±3.8%,FOLFOX-RT组为77.8±3.5%,FOLFOX组为75.7±3.6%(精确分层log-rank检验的P = 0.961)。FU-RT组3年OS率为93.7±2.2%,FOLFOX-RT组为92.0±2.3%,FOLFOX组为92.2±2.3%(精确分层log-rank检验的P = 0.961)
结论:FOLFOX联合或不联合放疗并不能显著改善直肠癌患者的DFS。然而,与标准FU-RT相比,单纯FOLFOX新辅助化疗似乎具有相同的局部复发率和3年-DFS率和3年-OS率。临床试验信息:NCT01211210[4]
高肿瘤突变负荷和DNA损失修复与卵巢癌预后相关

王华英教授、田文娟博士
复旦大学附属肿瘤医院
背景:在多种瘤种中,DNA损伤修复 (DDR) 缺陷会导致基因的不稳定性,增加肿瘤突变负荷(TMB)。但在卵巢癌患者中,TMB的预后价值以及TMB与DDR的关系尚未明确。
方法:研究分析了TCGA数据库中434例卵巢癌全外显子测序(WES)的数据和3DMedicines公司(3D Med)93例卵巢癌二代测序(NGS)的数据,探索21个癌症相关的DDR基因和TMB的关系。TMB定义为非同意突变的数目。研究同时分析了TCGA数据库患者的生存数据,探索TMB对卵巢癌预后的影响。
结果:TCGA和3D Med的卵巢癌患者中,分别有27.4%和40.9%的患者含有至少1个DDR基因变异。TCGA数据库患者最常见的突变基因及其突变率如下:POLE (21%), BRCA1 (5.1%), BRCA2 (4.1%), ATM (3.0%), FANCA (2.5%), PALB2 (2.3%), FANCD2 (2.1%)和ATR (2.1%);3D Med 数据库患者最常见的突变基因及其突变率如下:BRCA1 (12.9%), BRCA2 (10.8%), ATM (5.4%), RAD51 (3.2%), BRIP1 (3.2%), FANCD2 (3.2%)和PALB2 (3.2%)。两个数据库患者中,相比于DDR基因野生型的患者,携带任意1个DDR基因变异与高的TMB显著相关:TCGA (P < 0.00)和3D Med (P = 0.021);携带任意2个DDR基因变异均与更高的TMB显著相关:TCGA (P < 0.00)和3D Med (P = 0.03)。此外,TP53和任意1个DDR基因共突变也与更高的TMB显著相关:TCGA (P < 0.00)和3D Med (P = 0.02)。研究者同时对TCGA数据库中的患者进行了预后分析,以所有患者TMB的中位数作为cut-off值,高的TMB与显著更长的DFS (16.4m 和 14.1m, HR=0.83, P = 0.04) 和OS (41.0m 和 32.1m, HR=0.77, P < 0.00) 相关。此外,携带和不携带DDR基因变异的患者,mPFS分别为19.2m和16.7m (P = 0.07),mOS 分别为54.6m和41.5m (P = 0.02)。
结论:在卵巢癌患者中,DDR缺陷非常常见,与更高的TMB相关。卵巢癌患者高的TMB与更好的DFS和OS相关。这一研究结果提示DDR基因变异可能与抗肿瘤免疫相关,表现为更高的TMB,可以增加肿瘤新抗原负荷。这也可以帮助我们筛选最有可能从免疫治疗中获益的卵巢癌患者。[5]
[1]http://abstracts.asco.org/214/AbstView_214_223479.html
[2]http://abstracts.asco.org/214/AbstView_214_208931.html
[3]http://abstracts.asco.org/214/AbstView_214_210573.html
[4]http://abstracts.asco.org/214/AbstView_214_226739.html
[5]http://abstracts.asco.org/214/CatView_214_S.html













 苏公网安备32059002004080号
苏公网安备32059002004080号


