在HR+/HER2-晚期乳腺癌的排兵布阵中,抗体偶联药物(ADC)常被视为后线治疗的有力武器。然而,临床现实往往充满了不确定性,当被寄予厚望的ADC药物遭遇“滑铁卢”,患者的PFS仅仅维持了两个月便宣告进展,治疗的下一步该何去何从?这无疑是令临床医生感到棘手的“至暗时刻”。对于这类多线经治且对ADC产生原发耐药的难治性病例,传统的治疗路径似乎已无路可走。此时,潜伏在肿瘤深处的驱动基因往往是破局的关键。
当PIK3CA突变浮出水面,是否意味着我们能通过精准阻断其核心通路,从而逆转快速耐药的颓势?本期【PIK TALK】聚焦一例来自北京大学深圳医院农巧红医生团队的极具挑战性的真实病例。该患者在经历了55个月的肿瘤稳定期后突发肝转移,且二线ADC治疗迅速耐药。面对绝境,医疗团队通过NGS检测精准锁定PIK3CA突变,大胆采用了包含伊那利塞在内的“四药联合”跨线挽救方案。这一策略不仅成功遏制了肿瘤的“狂飙”,更在短短两个月内实现了病情的深度缓解(PR)。我们特邀江苏省人民医院李薇教授和中山大学肿瘤防治中心安欣教授结合该病例,深度解析这一“绝地反击”背后的临床决策逻辑,针对后线CDK4/6抑制剂经治患者找到PIK3CA突变关键因素,使用更直接抑制PI3K突变的伊那利塞依然能在复杂治疗环境下力挽狂澜。
案例报告
病史回顾:内分泌治疗获益55个月
患者为女性,42岁,于2014年3月行左乳癌保乳根治术。术后病理提示浸润性癌,2cm,淋巴结阴性(0/10),免疫组化显示ER(+++)、PR(+++)、HER2(2+)且FISH阴性、Ki-67 20%。患者术后完成了EC-T化疗及放疗,并接受了长达6年的OFS+TAM/TOR内分泌治疗。2020年8月,患者确诊胸椎多发骨转移。穿刺病理显示肿瘤仍保持激素受体强阳性(ER 60%,PR 30%),但增殖指数Ki-67升高至50%。自2020年9月起一线治疗采用OFS联合氟维司群及CDK4/6抑制剂(先后使用哌柏西利、阿贝西利),实现了长达55个月的无进展生存期(PFS)。
治疗困境:二线ADC快速耐药,PFS2个月
2025年4月,患者病情出现进展,影像学提示肝脏S8段新发转移。肝脏穿刺病理显示肿瘤生物学行为发生转化:ER表达下降至20%(弱-中+),PR转为阴性,HER2呈2+(60%弱-中)且FISH阴性,Ki-67为30%。鉴于HR下调HER2低表达状态,二线治疗尝试了抗体偶联药物(ADC)德曲妥珠单抗(T-DXd)。然而疗效不佳,仅治疗2个月(2025年5月-7月),影像学评估即提示疾病进展(PD),表明肿瘤对该ADC药物存在原发耐药。

关键转折:基因检测锁定靶点
面对ADC治疗的快速失败,临床团队于2025年5月12日对肝脏病灶进行了二代测序(NGS)检测。检测结果检出PIK3CA基因p.H1047R激活突变(变异频率35.5%),同时伴有KRASG12V及NTRK1变异;肿瘤微卫星状态为稳定(MSS),PD-L1表达阴性。这一关键发现明确了PI3K通路的异常激活是驱动耐药的核心机制,为后续精准治疗指明了方向。
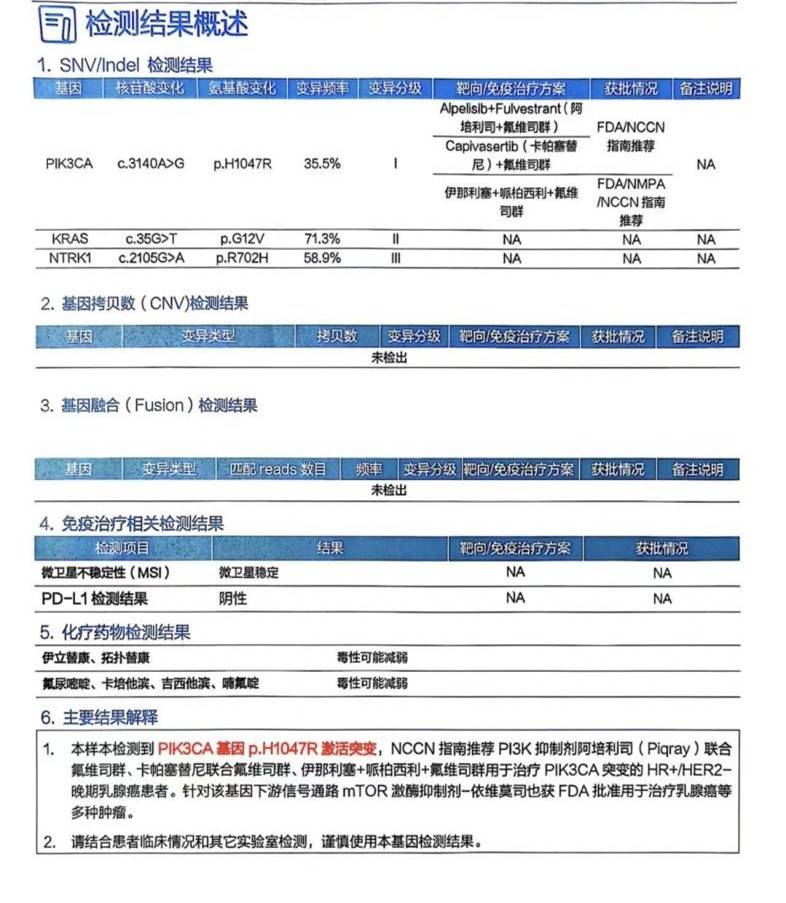
三线挽救:精准联合与疗效逆转,用药2个月即PR
基于PIK3CA突变及既往CDK4/6抑制剂经治史,团队制定了包含新型PI3Kα抑制剂的强化内分泌治疗策略。治疗分为两个阶段:2025年7月10日至8月17日为导入期,使用伊那利塞联合来曲唑及OFS;8月18日起进入联合期,在上述基础上跨线加入CDK4/6抑制剂(达尔西利 125mg qd),组成四药联合方案。
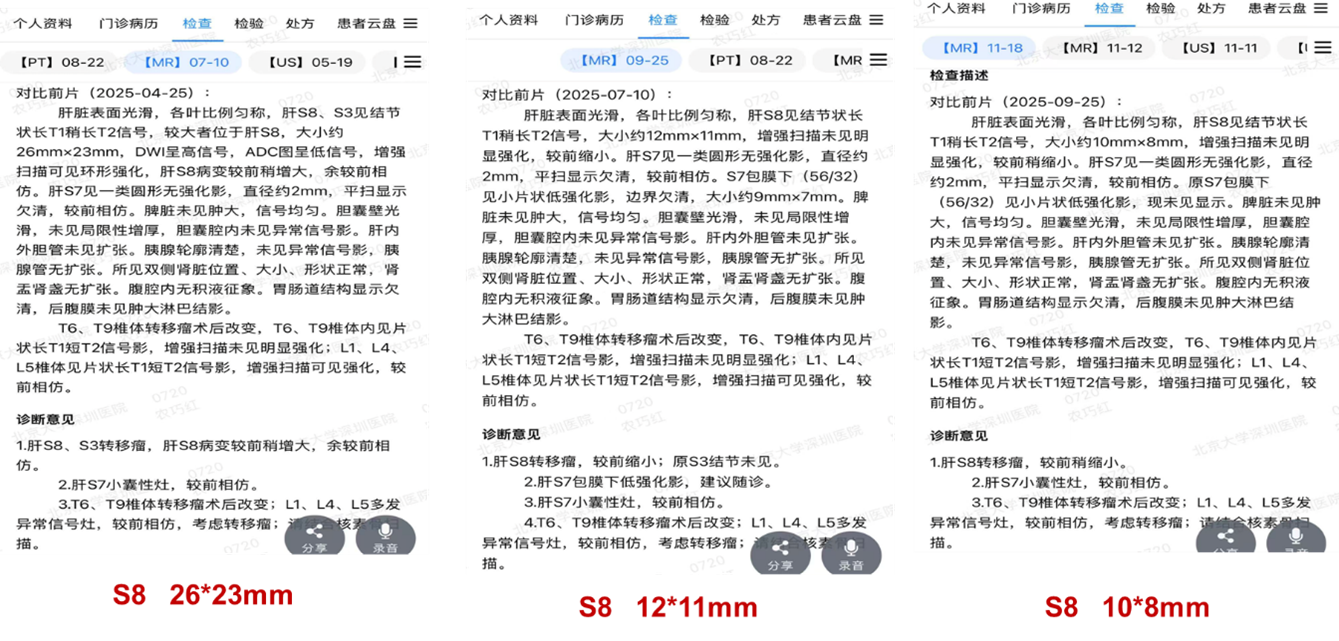
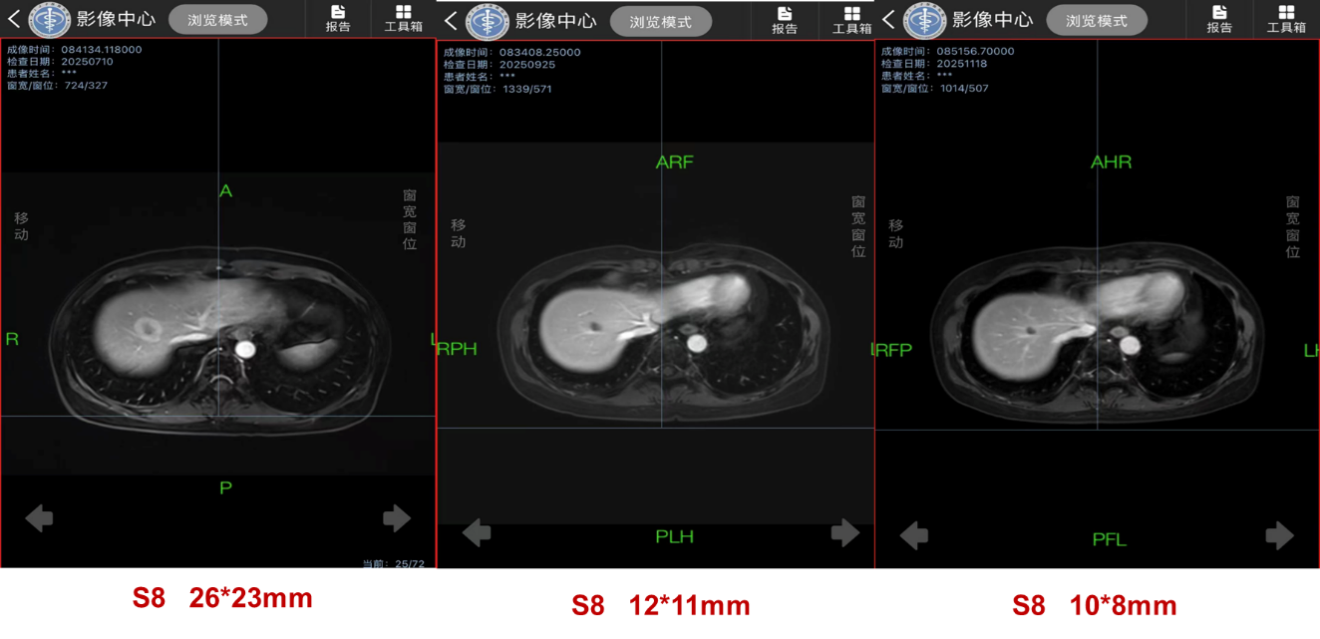
该策略疗效显著:治疗2个月后(2025年9月),肝S8转移灶从基线的26×23mm显著缩小至12×11mm,评估为部分缓解(PR);至2025年11月,病灶进一步缩小至10×8mm,维持PR。
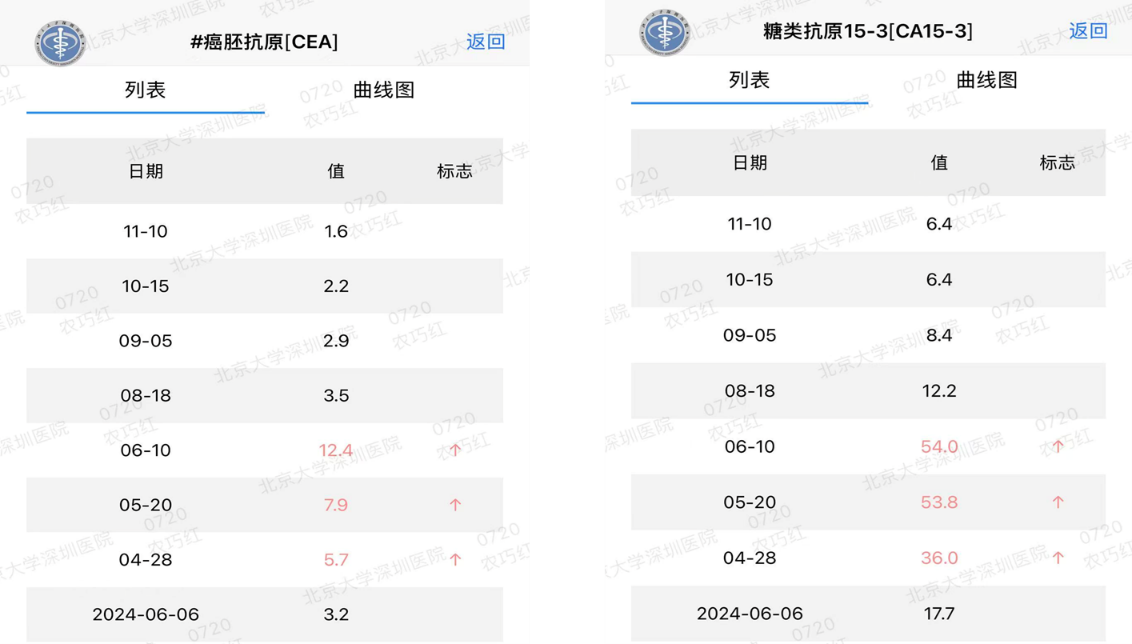
同时,肿瘤标志物CA15-3从治疗前的12.4 U/ml(6月)迅速下降至1.6 U/ml(11月),降幅明显。
安全性管理:皮疹的妥善处理
在四药联合治疗期间,患者于用药6周后(2025年9月)出现3级皮疹。临床团队立即采取停药措施,并予以静脉糖皮质激素及抗过敏治疗,5天后皮疹降至1级。随后治疗得以重启:先恢复来曲唑和伊那利塞,观察无异常后,于10月8日加用减量后的达尔西利(100 mg qd)。随访至今,患者未再发生皮疹,亦未监测到高血糖等其他不良反应,治疗耐受性良好。
专家点评与临床启示
点评专家
江苏省人民医院乳腺中心副主任
中国临床肿瘤学会(CSCO)乳腺癌专家委员会委员
中国临床肿瘤学会(CSCO)青年专家委员会常委
中国抗癌协会乳腺癌专业委员会委员
长江学术带乳腺联盟(YBCSG)副主任委员
中国抗癌协会乳腺肿瘤整合康复专委会委员
江苏省研究型医院肿瘤分子靶向治疗专业委员会常委
江苏省“科教强卫工程”青年人才
美国南卡莱罗那大学医学院访问学者
点评专家
中山大学肿瘤防治中心内科主任医师、主诊教授、硕士生导师
中国老年保健协会乳腺癌专业委员会 秘书长兼常委委员
中国临床肿瘤协会 (CSCO)青委会委员
中华医学会肿瘤学分会乳腺肿瘤青年学组委员
中国抗癌协会(CACA)化疗专业委员会委员
广东省医学会肿瘤内科学分会青年委员会主任委员
广东省抗癌协会泌尿生殖系肿瘤专业委员会委员
广东省抗癌协会遗传性肿瘤专业委员会委员
广州市抗癌协会巾英分会副主任委员
乳腺癌和泌尿生殖系肿瘤内科系统治疗。主持或参与国家自然科学基金和省部级课题多项,以第一/通讯作者发表SCI论文30余篇,包括Cancer Cell, JNCI, EJC等。
李薇 教授:
本例患者在经历了长达55个月的一线获益后,在二线ADC治疗快速耐药后实现了三线精准逆转。结合本中心诊疗体会与最新的循证医学证据,该病例为HR+/HER2-晚期乳腺癌的“全病程排兵布阵”提供了三点重要启示:
第一,警惕HER2低表达人群的“ADC盲区”,重视PIK3CA突变的常规筛查。中国乳腺癌患者中PIK3CA突变率约高达45.6%[1],本例患者在二线使用T-DXd治疗2个月即发生进展(PD),提示HER2低表达并非ADC治疗的“免死金牌”。回顾DESTINY-Breast04及DESTINY-Breast06研究,虽然T-DXd确立了优于化疗的地位,但其PFS获益的风险比(HR)分别为0.50和0.62;相比之下,INAVO120研究中伊那利塞方案的HR值达到了惊人的0.43。这表明在PIK3CA突变人群中,精准靶向驱动基因的获益强度可能远超单纯针对HER2低表达表型的ADC治疗。本例通过肝脏活检NGS检出的PIK3CA H1047R突变(丰度35.5%),揭示了驱动耐药的真凶。因此,对于ADC治疗反应不佳或存在高危因素的患者,必须回归分子本质,通过常规筛查PIK3CA突变寻找更优解。
第二,伊那利塞联合方案的高缓解率(ORR),是实现“跨线挽救”的基石。
INAVO120研究显示,在PIK3CA突变且内分泌耐药人群中,伊那利塞三联方案的客观缓解率(ORR)高达62.7%,是标准治疗组(28.0%)的两倍以上[2]。本例患者在三线采用“伊那利塞+达尔西利+来曲唑”方案后,仅用药2个月,肝S8转移灶即从26×23mm显著缩小至12×11mm,CA15-3从12.4 U/ml骤降至1.6 U/ml。这种“速效”特征,与INAVO120研究中mPFS从7.3个月提升至17.2个月(HR=0.42)的卓越数据高度呼应,INAVO120中纳入了82%内脏转移的患者,34%原发内分泌耐药的患者,仍取得了PFS及ORR的超双倍获益,该例证实了该方案在肿瘤高负荷人群多线经治后仍有强大肿瘤缩减能力。
此外,本例在 CDK4/6 抑制剂的选择上灵活应用了达尔西利,这一选择的科学性在 2024 SABCS 公布的 MORPHEUS-pan Breast Cancer 研究中找到了坚实支撑[3]。该研究表明,伊那利塞与不同种类的 CDK4/6 抑制剂(如阿贝西利、瑞波西利)联用时,均未观察到非预期毒性,且药代动力学(PK)分析证实不存在临床相关的药物相互作用(DDI)。这充分说明伊那利塞具有极佳的“配伍宽容度”,为临床灵活联合达尔西利提供了安全保障。
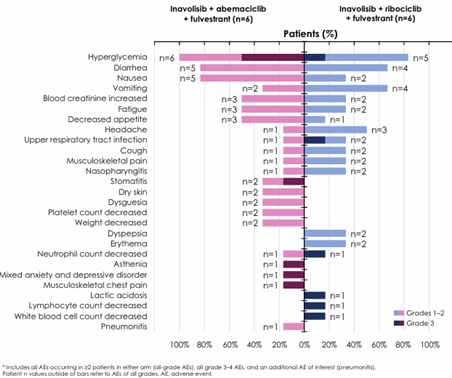
第三,分级管理策略有效化解了多药联合的安全性顾虑。 四药联合(PI3Ki+CDK4/6i+AI+OFS)对安全性管理提出了更高要求。本例患者虽出现3级皮疹,但通过严格的“停药-激素治疗-减量重启”流程,成功保留了伊那利塞这一核心药物,并长期维持治疗。值得注意的是,得益于伊那利塞对PI3Kα亚基的高选择性(>300倍于其他亚型),患者全程未发生高血糖,这与INAVO120研究中3-4级高血糖发生率仅为5.6%的数据相符,显示出新一代药物在代谢安全性上的显著优势。
安欣 教授:
从真实临床实践的角度来看,这一病例的价值在于它精准呈现了当前 HR⁺/HER2⁻ 晚期乳腺癌中容易被忽视、却最具决策意义的几个关键矛盾点。
首先,这是一个高度内分泌经治、且已出现多重耐药信号的病例。患者既往接受过 AI、氟维司群以及两种不同的 CDK4/6 抑制剂治疗,累积内分泌暴露时间长。在这样的背景下,临床上对再次选择内分泌治疗,尤其是继续以内分泌为治疗骨架,本身就存在疑虑。这也是为什么在实际工作中,面对类似患者,很多医生会本能地倾向于优先选择 ADC 或化疗,而非继续“押注”内分泌路径。
其次,病例中一个非常典型、但又非常具有现实意义的变化是:在长期内分泌压力下,肿瘤 HR 表达水平由高到低的动态转变。这种转变在临床中并不少见,却常常被简单理解为“内分泌不敏感”,从而过早放弃内分泌治疗的可能性。既往研究显示,在他莫昔芬治疗背景下发生肿瘤进展时,ER 丢失/转化的比例可达约 30%[4]。事实上,HR 表达下降并不等同于内分泌治疗完全失效,更关键的是要判断:是否仍存在可以被精准打击的驱动通路。
第三,需要特别强调的是,该例虽出现肝转移,但并非高肿瘤负荷或爆发性内脏危象。病灶体积相对有限,患者仍然客观存在一定的治疗时间窗。这一点在临床决策中非常重要——它为重新评估分子特征、选择更有针对性的靶向方案提供了现实基础,而不是被迫立即转向“强度更大但未必更精准”的治疗手段。
正是在这一关键节点,通过精准检测明确了 PIK3CA 激活突变,为治疗策略的重新排序提供了明确抓手。已发布的 2025 版《中国乳腺癌 PIK3CA 基因突变检测专家共识》明确指出[5]:对于 HR⁺/HER2⁻ 的局部晚期或转移性乳腺癌患者,建议在一线治疗前常规开展 PIK3CA 基因检测。该推荐证据质量高、推荐强度强,强调了规范化检测在精准治疗中的核心作用。对照该例路径可以看到:在 ADC 快速耐药之后,通过 NGS 明确 PIK3CA 激活突变,才使得后续治疗从“经验性换线”转向“明确靶点后的通路级逆转”,从而实现快速且深度缓解。
需要指出的是,尽管该患者与 INAVO120 的严格入组标准并不完全一致,但从“高度内分泌经治 + 分子驱动明确 + 内脏病灶可控”这一组合特征来看,这一人群在现实世界中反而更具代表性,也更具挑战性。该病例最终获得快速且深度缓解的事实提醒我们:当精准分子检测明确存在关键靶点时,即便在多线治疗、甚至 ADC 失败之后,通过更强效、更直接的 PI3Kα 通路抑制,内分泌治疗仍然可以重新获得主导地位。这不仅是对既往“内分泌已尽”的一种修正,也提示我们在临床实践中,应更加主动、前置地进行分子检测,为患者尽早明确真正具有价值的治疗锚点,而不是仅凭既往治疗线数或直觉判断提前“宣判”内分泌治疗失效。
案例提供专家
北京大学深圳医院肿瘤内科副主任医师
广东省医疗行业协会乳腺内科管理分会副主委
广东省医学会肿瘤精准诊疗乳腺肿瘤学组委员
深圳市医学会乳腺病青委副主委
深圳市抗癌协会乳腺癌专业委员会副主委
深圳市中西医结合学会甲状腺乳腺专业委员会常委
深圳市健康管理协会肿瘤多学科防诊治专委会乳腺癌青年学组组长
1. Chen L, Yang L, Yao L, et al. Characterization of PIK3CA and PIK3R1 somatic mutations in Chinese breast cancer patients. Nat Commun. 2018;9:1357.
2. Turner NC, Im SA, Saura C, et al. Inavolisib-Based Therapy in PIK3CA-Mutated Advanced Breast Cancer. N Engl J Med. 2024;391(17):1584-1596.
3. Loi S, Martin HC, Oliveira M, et al. Abstract P4-07-23: Preliminary safety in the inavolisib + fulvestrant + ribociclib/abemaciclib arms of MORPHEUS-pan breast cancer: A Phase 1b/2 study of efficacy & safety of multiple treatment combinations in patients with metastatic/locally advanced breast cancer. Clin Cancer Res. 2025;31(12_Supplement):P4-07-23.
4. Djahansouzi S, Hanstein B, Rein D, et al. The rate of estrogen receptor-conversion associated with tumor progression in estrogen receptor-positive breast cancer patients following adjuvant Tamoxifen administration. Cancer Rep (Hoboken). 2022;5(1):e1431.
5. 中华医学会病理学分会, 中国临床肿瘤学会病理专家委员会, 国家病理质控中心. 中国乳腺癌PIK3CA基因突变检测专家共识(2025版). 中华病理学杂志. 2025;54(2):120-125.
排版编辑:肿瘤资讯-XZY











 苏公网安备32059002004080号
苏公网安备32059002004080号


