整理:肿瘤资讯
来源:肿瘤资讯
导 语
本期要点
前IDH1抑制剂时代,mIDH1 AML患者预后显著差于IDH野生型(IDHwt)及IDH2突变(mIDH2)患者,现有治疗方案缓解率低,存在明确未满足治疗需求。
异基因造血干细胞移植(allo-HSCT)后,mIDH1 AML患者复发风险高,IDH1 R132突变可测量残留病(MRD)阳性是复发的重要预测因素。
NCCN指南明确推荐,mIDH1 AML患者可采用艾伏尼布(IVO)为基础的方案治疗,包括IVO单药、IVO+阿扎胞苷(AZA)等。
IVO单药或联合方案在mIDH1 AML治疗中疗效显著,可提升完全缓解(CR)率、延长总生存期(OS),且中国患者人群耐受性良好,输血依赖性改善明显。
IVO用于mIDH1 AML患者allo-HSCT后维持治疗,可降低2年累积复发率(CIR)至19%,提升2年OS率至88%;用于移植后复发患者,可实现快速、持久缓解,中位缓解持续时间(DOR)达18.3个月。
▲ 点击观看视频
mIDH1 AML治疗现状:前IDH1抑制剂时代预后差,治疗需求未满足
2025年EHA大会上,多项中国真实世界研究数据均显示,前IDH1抑制剂时代,mIDH1 AML患者的治疗效果较差,临床存在明确且未被满足的治疗需求:安徽医科大学第一附属医院一项回顾性分析显示[1],mIDH1 AML患者经首次诱导治疗[主要为阿糖胞苷为主的强化治疗和AZA+维奈克拉(VEN)治疗]后的CR率为38.7%,低于IDHwt组(58.9%)及mIDH2组(49.0%)。在生存期方面,mIDH1 AML患者的中位OS为7.6个月,不仅短于IDHwt组的10.1个月,也不及mIDH2组的9.9个月。山东大学齐鲁医院开展的一项回顾性研究显示[2],接受以VEN为基础的方案治疗的mIDH1 AML患者,CR率仅36.4%;而吉林大学第一医院的研究针对初治mIDH1 AML患者[3],数据显示同类方案的CR率低至25%,进一步印证了传统方案对mIDH1 AML的治疗局限性(图1)。
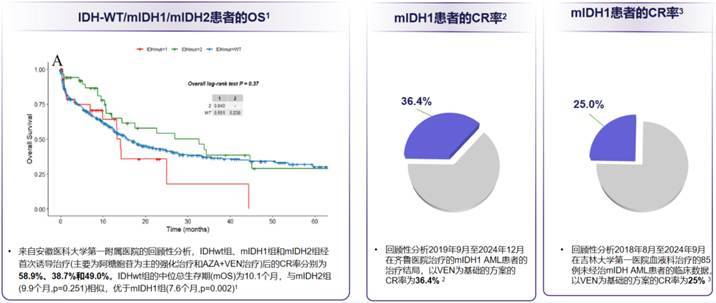
图1. 前IDH1抑制剂时代,mIDH1 AML预后差,治疗方案尚有优化空间
值得注意的是,2024年欧洲白血病网(ELN)预后分层系统虽能有效区分低强度治疗背景下AML患者的整体预后[4],但对于mIDH1这一亚型的高风险特征,即便采用当前临床常用的标准治疗方案[如去甲基化药物(HMA)联合VEN],患者仍未获得明显获益。mIDH1 AML患者的临床困境亟待新的治疗策略突破。
mIDH1 AML移植挑战:复发风险高,MRD是关键预后指标
allo-HSCT是AML患者的根治性治疗手段之一,但mIDH1 AML患者在移植后面临更高的复发风险。一项纳入292例在2007年8月至2020年9月期间接受allo-HSCT的成人AML患者的回顾性研究中[5],评估了诊断时和移植缓解期mIDH对治疗结局的影响。研究显示,24%患者诊断时存在IDH突变(含11.2% mIDH1)。基于数字PCR(ddPCR)技术的检测结果表明:IDH1 R132 MRD阳性AML患者接受allo-HSCT后的CIR显著高于IDH1 MRD阴性患者,同时无事件生存期(EFS)和OS也更短,证实mIDH1可增加AML患者HSCT后复发风险。
移植后IDH MRD状态对复发的预测价值同样突出。既往一项研究通过NGS或Sanger测序筛查了IDH突变移植前后的MRD对预后的影响[6],ROC曲线分析显示,移植后IDH1和IDH2 MRD状态对于未来56天(AUCIDH1=0.98和AUCIDH2=0.93)和84天(AUCIDH1=0.91和AUCIDH2=0.90)内的复发具有高度预测性。且这一预测能力不劣于在NPM1突变患者中的NPM1 MRD(56天 AUCNPM1=0.95,84天 AUCNPM1=0.81)。进一步数据显示,移植后1年内有至少1个IDH MRD阳性样本的患者,其CIR显著更高(P<0.001),且OS显著缩短(P=0.001)(图2)。上述研究数据凸显了mIDH1 AML患者在移植后复发风险高、预后改善难度大的核心移植挑战。
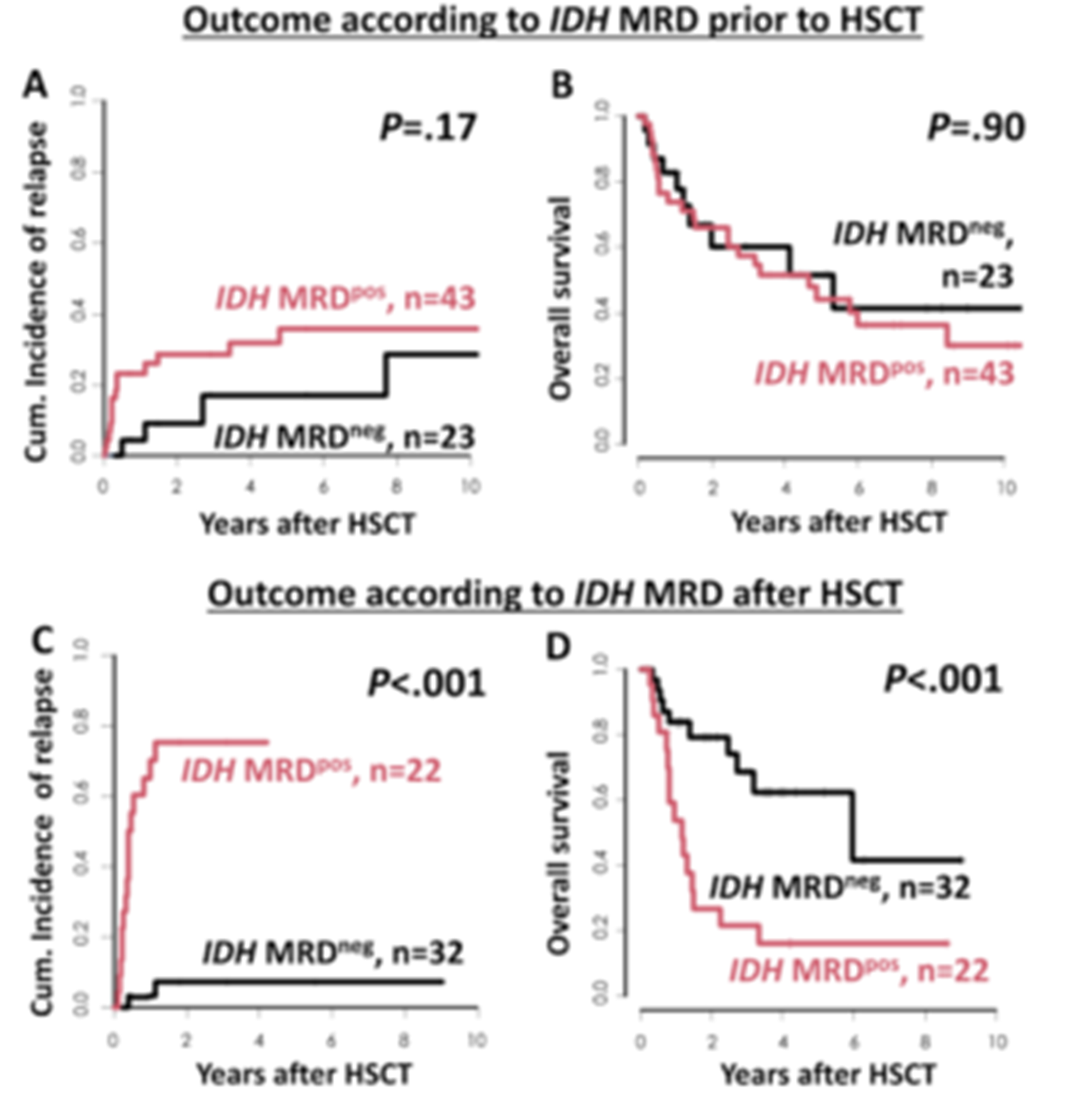
图2. IDH突变AML患者接受移植前(A,B)后(C,D)的IDH MRD状态下的CIR和OS
以IVO为基础的方案:mIDH1 AML诱导治疗的新选择
对于拟接受移植的AML患者而言,移植前的缓解状态直接影响移植预后。一项纳入2001年至2015年接受allo-HSCT的新诊断(ND)AML患者的回顾性单中心研究显示[7],CR状态与CR伴不完全血液学恢复(CRi)状态患者的移植结局存在显著差异:单变量分析中,CRi患者的3年生存率(41% vs 62%,P=0.023)显著低于CR患者,3年非复发死亡率(NRM)显著高于CR患者(27% vs 10%,P=0.007);多变量分析进一步证实,相较于CR患者,CRi患者的OS和NRM均更差(图3)。这一结果明确提示,移植前获得CR是AML患者实现更优移植获益的关键前提,也为mIDH1 AML患者的诱导治疗提出了核心目标——需通过有效方案提升CR率,为后续移植奠定良好基础。
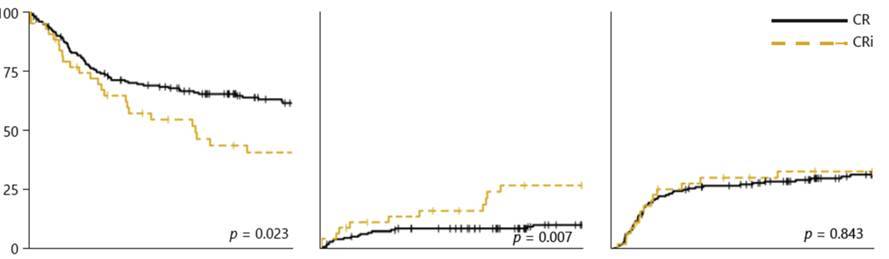
图3. 从左到右依次为CR和CRi患者的OS率、NRM和复发率
近年来,随着对IDH1突变机制的深入理解,目前全球首个且国内唯一获批的IDH1抑制剂IVO的出现为mIDH1 AML的治疗带来了新的希望。以IVO为基础的方案在mIDH1 AML治疗中展现出优异疗效,且被NCCN指南推荐——对于mIDH1 AML患者,推荐使用IVO单药或者联合AZA诱导治疗(图4)[8]。

图4. NCCN指南更新的mIDH1 AML治疗方案
在临床研究方面,Ⅲ期AGILE 研究显示[9-10],与安慰剂(PBO)+AZA相比,IVO+AZA可显著改善ND unfit的mIDH1 AML患者生存——中位OS达29.3个月(vs 7.9 个月;HR=0.42,P<0.0001),死亡风险降低58%;同时,IVO+AZA组的CR率(47% vs 15%)、CR伴部分血液学恢复(CR+CRh)率(53% vs 18%)均显著更高,且12个月CR维持率达88%(vs 36%),缓解维持时间更长。

图5. IVO + AZA vs PBO + AZA组患者的mOS
中国桥接研究CS3010-101研究显示[11-12],艾伏尼布单药治疗中国复发/难治性(R/R) mIDH1 AML患者的CR率为36.7%,总缓解率(ORR)为43.3%;患者达CR的中位时间为3.7个月,中位CR持续时间为19.7个月,中位至首次缓解时间仅为1.5个月。值得注意的是,患者接受艾伏尼布单药治疗后,绝对中性粒细胞计数(ANC)恢复快速,且超过50%患者实现输血脱离或维持非输血依赖,同时血液学毒性可控。

图6. 接受艾伏尼布单药治疗后患者输血依赖改善情况
在临床实践中,美国一项回顾性真实世界研究显示[13],在ND unfit mIDH1 AML患者中,IVO+HMA组的CR率(42.5% vs 26.3%,P=0.007)、CR伴不完全血液学恢复/部分缓解(CR+CRi/p)率(63.0% vs 48.5%,P=0.019)均显著优于VEN+HMA组。尤其在“低虚弱程度(less frail)”患者中,另一项研究显示IVO+HMA组的CR率(47.4% vs 27.0%,P=0.007)、6个月EFS率(64.2% vs 42.9%,P=0.005)、桥接移植率(14.6% vs 3.2%,P=0.029)更具优势,且非计划急性护理风险更低(相对风险 40.9% vs 73.0%,P<0.001)[14]。
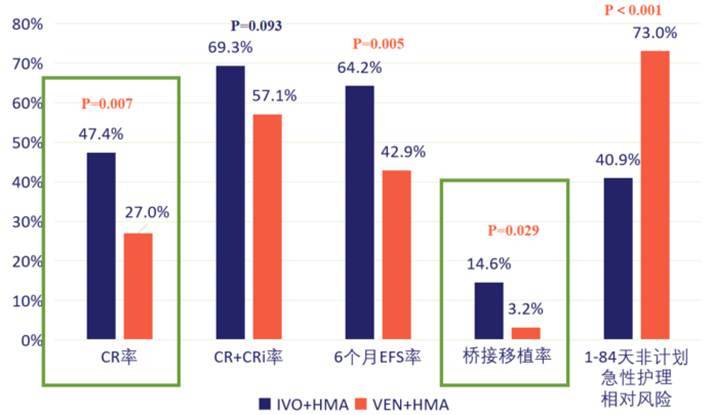
图7. Less frail人群的治疗结局
此外,基于IVO的三药联合方案亦疗效显著,美国一项多中心Ⅰb/Ⅱ期研究显示[15],IVO+VEN±AZA方案治疗ND AML患者的3年OS率达71%、3年EFS率达73%、3年DOR率达72%;且CRc率高达94%。此外,39%的患者序贯移植后,3年OS率提升至95%(未移植患者 58%,P=0.011)。安全性方面,≥3级不良事件发生率仅27%,分化综合征、QT间期延长等特殊关注不良事件发生率均低于8%,耐受性良好。
综上,无论是单药还是联合方案,艾伏尼布均能为mIDH1 AML患者带来显著疗效,既提升诱导治疗阶段的缓解率与生存质量,又为后续序贯移植、改善长期预后奠定坚实基础,且安全性可控,充分验证了其在mIDH1 AML诱导治疗中的核心价值。
IVO在mIDH1 AML移植后治疗中的应用:维持与复发挽救
鉴于mIDH1 AML患者在移植后面临高复发风险,且移植前通过IVO为基础的方案已实现较高CR率,探索IVO在移植后阶段的应用价值,成为进一步改善患者长期预后的关键方向。
一项多中心Ⅰ期研究纳入16例mIDH1 AML患者[16],在移植后30~90天开始IVO(500mg QD)维持治疗,持续12个周期,结果显示:生存患者移植后中位随访29个月时,患者2年OS率达88%,2年PFS率达81%,2年CIR仅19%,2 年累积非复发死亡率(CINRM)为0%,显著降低复发风险。安全性方面,仅2例患者发生3级QT间期延长,6个月累积2~4级急性移植物抗宿主病(aGVHD)发生率为6.3%,无3~4级aGVHD;2年慢性移植物抗宿主病(cGVHD)发生率为63%,但多为轻中度,未影响治疗持续。
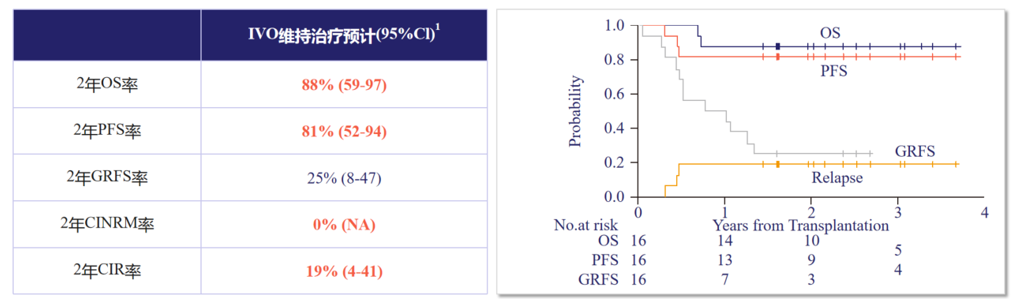
图8. IVO单药治疗mIDH1 AML移植后维持治疗,可延长生存,降低复发
IDALLO回顾性研究纳入22例allo-HSCT后复发的mIDH1 AML/MDS患者,接受IVO单药(500mg QD)治疗[17],结果显示患者达缓解的中位时间为40天,CR+CRi率达40.9%(CR率36.4%),中位缓解持续时间达18.3个月,应答者的缓解持续时间未达到(NR)。中位随访27.4个月时,患者中位OS达10.3个月,18个月OS率达45.5%;其中应答者中位OS未达到,显著优于无应答者(3.2个月,P<0.001)(图9)。在安全性方面,无患者因毒性停药,无分化综合征发生,仅1例QT间期延长(剂量调整后缓解),无aGVHD,仅2例1级cGVHD,安全性可管理。

图9. 移植后复发AML患者接受IVO治疗的中位OS和中位PFS
总之,IVO在mIDH1 AML移植后维持与复发挽救治疗中均展现出显著价值,既填补了移植后降低复发风险的治疗空白,又为复发患者提供了安全有效的挽救方案。
谭业辉 教授
吉林大学第一医院血液科副主任,主任医师,教授,博士生导师
中华医学会血液学分会委员
中华医学会血液学分会移植学组委员
中国医师协会血液科医师分会委员
中国临床肿瘤学会(csco)理事
中国医药教育协会血液学分会委员
中国医疗保健国际交流促进会血液学分会委员
中国中西医结合学会血液学分会委员
中国康复医学会血液病康复专业委员会委员
中国初保会造血干细胞移植专委会常委
中华医学会吉林省血液学分会常委
吉林省医师学会血液学分会常委
吉林省健康管理学会血液学分会副主委
中华医学会长春市血液学分会主委
主要专业白血病诊治及造血干细胞移植
参考文献
免责声明:本资料的内容仅作为科学信息参考,仅用于医疗卫生专业人士的学术交流,请勿用于任何其他用途。若您不是医疗卫生专业人士,请勿观看和/或传播此资料。
本资料可能会出现某些药品信息,但该药品/适应症可能尚未获得国家药品监督管理局的注册批准。医疗卫生专业人士做出的任何与治疗有关的决定应根据患者的具体情况并应参照国家药品监督管理局批准的药品说明书。对于本资料可能提到的相关诊断、治疗方法,请遵守国家卫生健康委员会以及相关部门批准使用的指南或规定。
审批编号:M-TIBSO-CN-202512-00029
有效期至2027年12月27日
排版编辑:肿瘤资讯-Shiro












 苏公网安备32059002004080号
苏公网安备32059002004080号


