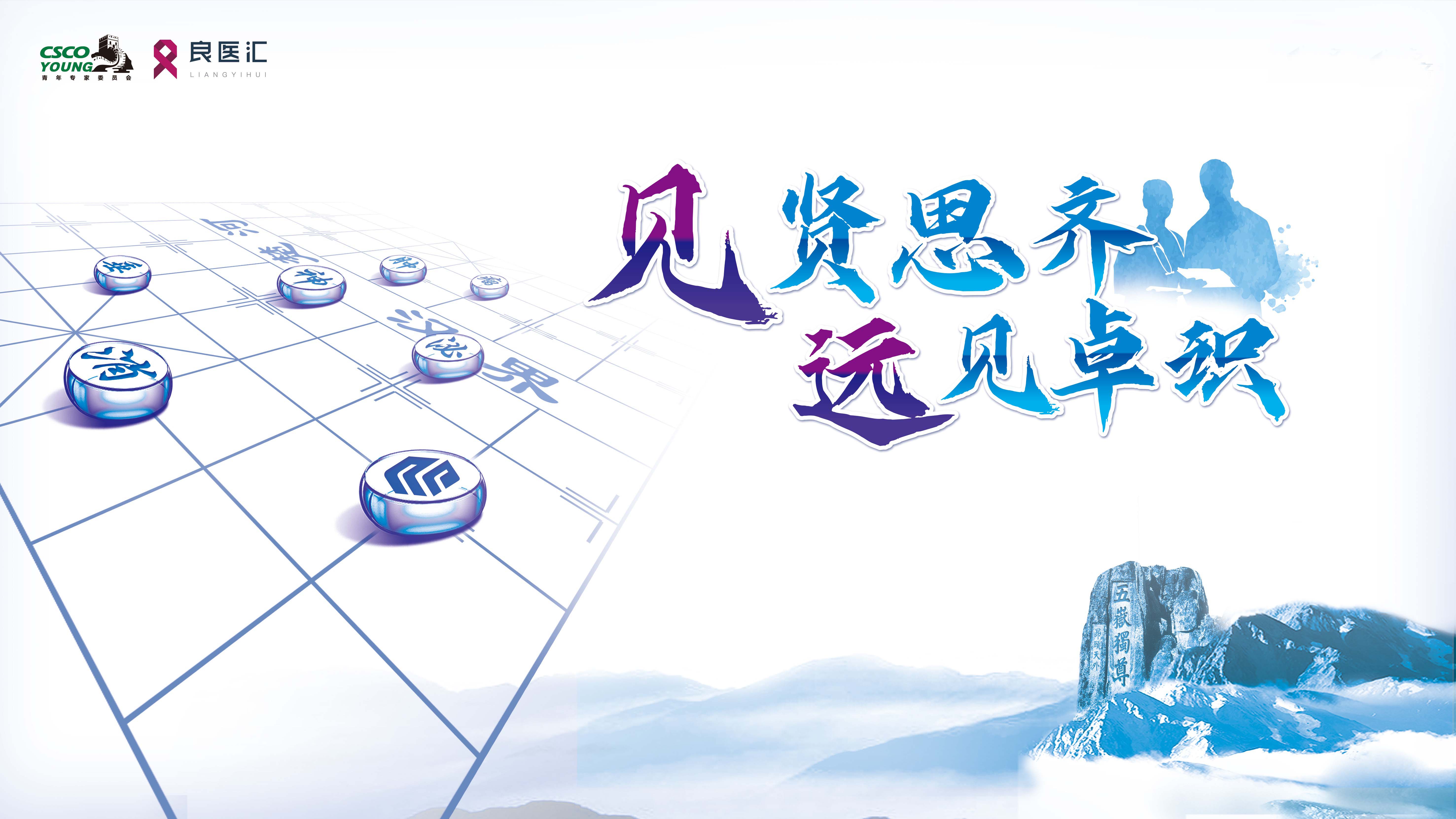
肢端肥大症的诊治始终是内分泌与神经外科交叉领域的重要挑战。随着影像学、垂体激素检测与神经内镜技术的不断进步,功能性垂体腺瘤的诊断效率显著提高,但如何在复杂多样的临床表现中实现精准诊断、规范治疗与长期管理,仍是当前临床实践的重点难点。
本期病例集从不同角度呈现了肢端肥大症的典型与特殊病例,涵盖GH分泌型垂体瘤、TSH/GH混合型瘤、术后残留与复发、放疗后管理、及生长抑素类似物长期治疗策略等多个关键环节。这些病例有望为更多临床医生提供实践经验及诊疗思路,并进一步促进肢端肥大症的综合治疗体系的规范化与发展。值得强调的是,生化控制是这类患者长期预后关键指标,即使影像学残留稳定,若GH/IGF-1未达标,仍会增加长期心血管与代谢风险,而生长抑素类似物(如奥曲肽)等药物的个体化剂量调整,是术后残留、复发及不适合手术患者的重要治疗支柱。
Section 1
病例汇报:
杨海燕教授 广西医科大学第一附属医院
病例点评:
杨幸达教授 新余市人民医院
黄世英教授 昆明医科大学第一附属医院
李军教授 中国人民解放军联勤保障部队第九〇〇医院
谢雪梅教授 广西医科大学第一附属医院
医学博士,广西医科大学第一附属医院内分泌科主治医师
广西医师协会第二届内分泌代谢学分会委员兼秘书
《系统内分泌学》编者
获“泌境寻踪”临床内分泌代谢性疾病病例比赛全国总决赛第一名、中华医学会第十三次全国内分泌学中青年英文论文演讲比赛三等奖、青年医师英文大赛决赛全国二等奖、广西医科大学第三届医学专业青年教师英语授课比赛二等奖等奖项
参与多项国家级、省部级自然科学基金,参编出版专著1部,在《中华内分泌代谢杂志》、《European Journal of Nutrition》等本专业领域国内外知名期刊发表论文多篇,成果获第17届国际内分泌大会交流
病例介绍
患者1基本情况
患者男性,40岁,因“肢端肥大7年余,垂体瘤术后4年余”于2025年9月入院。既往乙型肝炎病史及甲状腺结节史。本次入院为评估病情及行第25次奥曲肽微球治疗入院。
2018年患者无明显诱因下出现四肢肢端肥大,伴左眼视力模糊,无其余不适,未进一步诊治。2021年因外伤就诊时偶然发现鞍区占位,经进一步评估提示鞍区及鞍上池占位,考虑垂体瘤病变、瘤内出血。
诊疗经过
患者2021年5月于我院神外住院,术前GH >34.8 ng/ml,余激素正常;行开颅鞍区占位性病变切除+脑脊液漏修补术+颅神经微血管减压术,术后MRI:2.7×2.3×3.3cm。术后病理诊断为垂体腺瘤,免疫组化示P53(2+)、Ki-67(+,1%)。2021年9月复查提示肿瘤残余,2021年9-10月行术后放疗,放疗后强化灶较前稍缩小(1.5×1.9×1.6cm,增强中等强化)。
2021年11月评估激素提示GH >34.8 ng/ml,IGF-1 773.6 ng/ml,奥曲肽-生长激素抑制试验提示GH被抑制,遂完成24次奥曲肽微球30mg治疗(q4w;2021.11-2025.6),末次出院无不适,手部及额部紧绷感较前明显缓解,双手指间关节及双足趾间关节肥大较前明显缓解,可正常握拳。患者在整个治疗过程中未能规律接受奥曲肽治疗,但仍可见其对药物具有良好的生化应答,奥曲肽在该患者身上呈现出明确的疾病控制效果。需要指出的是,患者生化指标的周期性波动与其给药间隔不规律密切相关。
病例小结
本例患者因外伤检查偶然发现鞍区占位,进一步评估提示垂体瘤及瘤内出血。随后于2021年5月行开颅垂体瘤切除术,术后病理提示垂体腺瘤,Ki-67约1%,P53(2+)。尽管接受了术后放疗,但影像学仍提示明显肿瘤残余。术后激素水平持续升高,GH>34.8 ng/mL、IGF-1显著升高,提示生化缓解未达标。自2021年11月起分次给予奥曲肽微球治疗,共完成24次。临床上患者肢端肥大相关症状逐渐改善,包括额面部紧绷感减轻、手足关节肥大缓解,功能活动恢复良好。需要强调的是,患者在治疗期间未能规律接受奥曲肽治疗,给药间隔多次延长。然而,即便在不规律治疗的情况下,仍然能够观察到其激素水平的良好反应性,提示患者对奥曲肽高度敏感。规律使用生长抑素类似物对于维持生化控制具有重要意义。
Section 2
病例汇报:
袁安琪教授 四川大学华西医院
病例点评:
张玉海教授 海南省人民医院
耿立丹教授 绵阳市中心医院
欧杨教授 云南省第一人民医院
医学硕士,四川大学华西医院内分泌代谢科专科医师
毕业于四川大学华西临床医学院
参与多项省级课题
病例介绍
患者1基本情况
患者男性,41岁,因“怕热、多汗、体重下降17年,间断手抖2+年”于2022年9月入院。
现病史:患者17年前出现怕热、多汗及显著体重下降(约13 kg),伴间断心悸不适、乏力不适。2年前开始出现间断性手抖。1月前因反酸、烧心不适就诊,内分泌检查显示TSH 14.83 mIU/L,伴TT3、TT4、FT3、FT4均升高。进一步垂体MRI提示鞍区肿瘤,考虑垂体大腺瘤可能。
体格检查:P 112次/分;甲状腺可触及Ⅱ度肿大,质软;双手稍有震颤。
辅助检查:激素检查示TSH持续升高;FT3/FT4升高;GH增高,抑制试验不抑制。影像学检查示蝶鞍占位,垂体瘤;垂体窝扩大,鞍区见大小约1.2×1.8×1.9 cm软组织密度结节,密度较均匀,边缘可见钙化。
初步诊断:TSH和GH细胞混合瘤?继发性甲状腺功能亢进症;肢端肥大症。
诊疗经过
垂体瘤及相关疾病多学科MDT会诊:患者鞍区占位明确,考虑TSH细胞瘤可能性大,不排除TSH和GH细胞混合瘤,有手术指征。2022年10月05日行鼻内镜中颅底占位病变切除术,脑脊液漏修补术,双侧视神经及视交叉减压术。2022-10-10术后复查激素水平:TSH 0.054 mIU/L,FT3 7.23 pmol/L,FT4 47.40 pmol/L;TgAb 189.00 IU/mL,TPOAb 327.00 IU/mL,TRAb <0.80 IU/L;GH 1.29 ng/mL。病理回报支持为垂体促甲状腺刺激激素+生长激素腺瘤。
2022年10月11日转内分泌代谢科继续治疗。复查甲功示TSH 0.050mIU/L,FT3 6.92 pmol/L,FT4 30.20 pmol/L。给予口服弥凝、醋酸泼尼松补充糖皮质激素、普萘洛尔控制心率及继续静滴万古霉素及美罗培南联合抗感染、多烯磷脂酰胆碱保肝治疗。2022-10-19复查甲功示TSH 0.224 mIU/L,FT3 5.19 pmol/L,FT4 23.10 pmol/L。于2022年10月20日出院。2023年9月1号复查示GH 0.22 ng/mL,IGF-1 25.4 ng/mI,TSH 1.87 mIU/L,FT4 21.4 pmol/L。
病例小结
随着现代影像技术和TSH敏感测定的发展,TSH瘤和GH/TSH混合瘤的诊断有所进步。实验室检查的发展有助于鉴别TSH瘤和甲状腺抵抗综合征(RTH)。经蝶窦垂体瘤切除术(TSS)依然是大多数GH/TSH混合瘤的首选治疗方案,尤其是近年来随着内镜不断发展,内镜下扩大经蝶窦入路手术成为主流。药物治疗可用于术后未缓解或者复发的患者,单纯以药物为主的治疗方法仍需要更多的研究支持。而对于术后未缓解但是无法接受长时间药物治疗的患者,放射治疗也可以成为一个选择。由于GH/TSH混合瘤临床罕见,发病率低,对于患者的诊断、治疗更加依赖于对以往病例的回顾性分析,而非临床试验。难治性患者往往涉及手术、放射和药物治疗等多种方法的联合治疗。
患者2基本情况
患者女性,57岁,因“垂体生长激素细胞腺瘤TSS术后4+年,放射治疗后1+年”入院。
诊疗经过
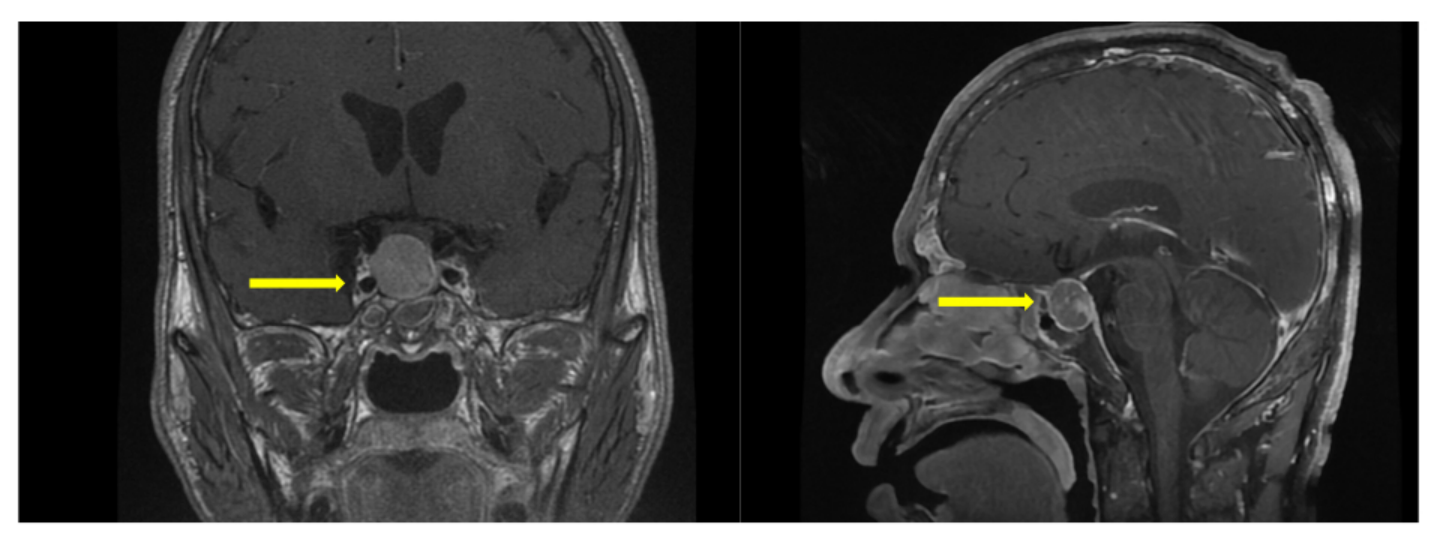
6+年前患者因“眼眶胀痛,伴视力下降1+年,双手晨僵3月”入住我院神经外科,诊断为:“鞍区占位:垂体瘤。”2019年7月23日在全麻下行导航下经鼻蝶颅底占位切除术+视神经减压术+脑脊液漏修补术+窦修补术,手术顺利,病理报告:免疫组化染色CK8/18(+)、Syn(+)、ACTH(-)、FSH(-)、GH(灶+)、LH(-)、PRL(-)、TSH(-)、Ki-67(MIB-1)(+,1-2%);特殊染色:网织纤维染色示纤维组织减少,支持为垂体生长激素瘤。
2020年7月14日,患者因“垂体瘤术后1+年,头痛4月”入院。生长激素高糖抑制试验显示GH抑制不充分,IGF-1 157.11 ng/m。MRI垂体高分辨增强扫描示垂体变扁、强化不均,垂体柄左偏。患者出院后继续给予奥曲肽20mg肌肉注射,每28天1次,加用卡麦角林0.5mg口服,每周二、五一次。
2023年2月15日患者因“垂体瘤术后残留”入我院神经外科,于2023年2月17日行伽马刀治疗(剂量28Gy、等剂量曲线50%),术后规律于神经外科或内分泌科门诊随诊。1+月前患者自觉手指有紧绷感、鼻子变大,为求进一步治疗,门诊以“垂体瘤术后、肢端肥大症”收入我科。
体格检查:肢端肥大症面容,下颌突出,鼻翼增宽,口唇肥厚。粗测视野无缺损。双手、双足关节粗大。
辅助检查:生长激素2.54 ng/ml,IGF-1 177.00ng/ml。
初步诊断:肢端肥大症(垂体生长激素瘤经鼻蝶颅底占位切除术后+伽玛刀术后)。
病例小结
肢端肥大症,TSS术切除腺瘤后仍有持续性疾病的患者,或不适合手术的患者以及放射治疗后起效过渡阶段,建议采用药物治疗。生长抑素类似物奥曲肽以及多巴胺激动剂卡麦角林,结合腺瘤中的生长抑素受体(SSTR)并抑制生长激素的分泌。长效奥曲肽LAR和兰瑞肽的选择取决于给药的实用性方便性和患者的偏好。卡麦角林可作为治疗肢端肥大症辅助药物。据文献报道第一代生长抑素受体配体(SRLs)奥曲肽的生化控制率约为55%,患者个体差异、GH/IGF1水平、既往手术、不良反应、治疗依从性都影响达到实践应用中的生化控制的可能性。
Section 3
病例汇报:
周立伟教授 厦门大学附属第一医院
病例点评:
章燕教授 南昌大学第一附属医院
伍敏教授 贵州省人民医院
张黎教授 绵阳市第一人民医院
厦门大学附属第一医院神经外科主治医师
熟练掌握神经外科常见疾病的诊断和治疗,于2023年在南昌大学附属第一医院进修神经内镜,熟练掌握“筷子技术”
主持厦门市自然科学基金项目1项,福建省科学技术厅课题1项
目前以第一作者发表SCI论文6篇
参与翻译《颅缝早闭 外科诊疗规范及手术技术原则》
病例介绍
患者基本情况
患者女性,36岁。因“闭经1年,头痛伴视物模糊2个月”于2024年7月入院。
现病史:1年余前无明显诱因下出现闭经,曾就诊外院,无明显好转。2个月前出现头痛,位于双侧额部,具体频率不详,可自行缓解,伴双眼视力模糊。
既往史:右肺恶性肿瘤病史(腺癌;2025-04-30手术)
查体:鼻翼肥厚,嘴唇增厚,手足肥大。
辅助检查:术前影像学提示鞍区占位;激素检查提示GH(>50 ng/ml)和IGF-1(431 ng/ml)升高。视力及视野检查提示左眼颞侧偏盲。
诊疗经过
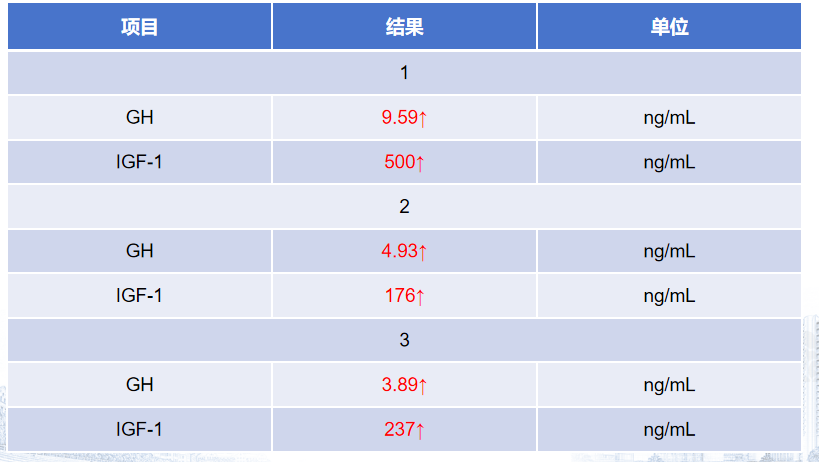
患者于2024年7月9日接受神经内镜经鼻鞍区占位切除术。术中依次完成黏膜瓣制作、双通道暴露、蝶窦前壁磨除、鞍底充分显露与切开硬膜,随后行肿瘤切除并实施鞍底重建。术后监测激素水平显示生长激素降至9.59 ng/mL,较术前显著下降。患者恢复平稳后出院。
术后随访复查提示生长激素持续下降,GH已降至3.89 ng/mL,呈良好生化反应趋势。术后半年复查影像学显示右侧海绵窦外侧可见残余病灶,但体积稳定,无明显进展。总体来看,患者激素水平控制理想。患者目前继续按照方案规律接受奥曲肽微球治疗,病情持续稳定。
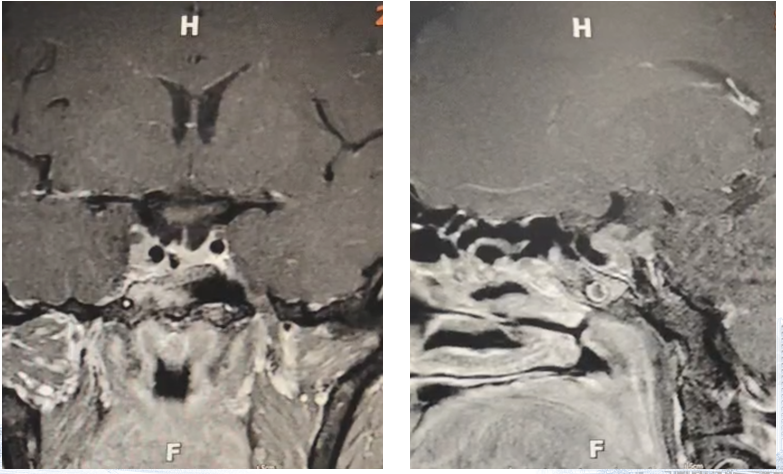
病例小结
本例为典型的生长激素分泌型垂体腺瘤致肢端肥大症,经神经内镜手术联合奥曲肽治疗后获得良好的生化及影像学控制。该病例提示,在存在海绵窦残留、难以一次性全切的情况下,手术与生长抑素类似物的联合策略仍可实现较满意的疾病控制,为类似患者的长期管理提供了重要参考。
总结
对于术后及放疗后仍存在肿瘤残余、且生化控制未达标的患者,规范而持续的生长抑素类似物治疗依然是实现长期疾病控制的核心策略。垂体瘤的内分泌活性往往并不完全取决于肿瘤体积,残余瘤即便体积不大,仍可能维持较高水平的GH和IGF-1分泌,导致患者处于持续的代谢和心血管风险之中。因此,在影像学稳定的前提下,生化指标的达标与否更能反映疾病的真实活动状态。对于具有侵袭性、反复性或海绵窦残留等高风险特征的功能性垂体腺瘤,术后长期内分泌抑制治疗应作为疾病管理的重要组成部分,并根据激素水平动态调整剂量和给药间隔,以实现真正意义上的生化控制与长期预后改善。
排版编辑:肿瘤资讯-Sally











 苏公网安备32059002004080号
苏公网安备32059002004080号


