
近年来,免疫治疗在肺癌领域进展不断。就在今年,基于CheckMate-227研究, 首个非小细胞肺癌(NSCLC)一线“双免联合”方案——纳武利尤单抗联合伊匹木单抗(O+Y)在中国获批,为PD-L1阳性患者提供了具有长生存获益的“免化疗”新选择;近期,CheckMate-227发布了6年随访结果全文 [1]:O+Y在不区分PD-L1表达的总体人群中6年OS率达20%,较化疗(11%)近翻倍,进一步夯实了该方案的长期获益证据。
另一方面,CheckMate-227作为全球首个探索双免联合治疗用于NSCLC的III期研究,其开展时间较早、设计较复杂;且该研究历经多次修订,也反映了免疫治疗早期探索阶段学术界的思维变迁,颇具启发价值。为深入剖析这一研究的设计逻辑与临床意义,我们特邀 广东省人民医院肿瘤医院周清教授和 复旦大学附属中山医院梁斐教授,围绕CheckMate-227的设计与结论开展深度对话, 从临床与统计双视角回顾这一研究的关键历程,为诊疗提供启发。


2015年,PD-1抑制剂在NSCLC二线突破不断,两项探索纳武利尤单抗(简称O药)单药对比化疗的III期研究:CheckMate-017(鳞癌)与CheckMate-057(非鳞癌)相继成功并登上《新英格兰医学杂志》,极大地激发了学术界推动PD-1前移至一线的信心。
然而,当时PD-1在NSCLC一线尚无数据积累,研究者面临诸多未解之问:一线应该选择单药还是联合治疗?联合化疗还是CTLA-4抑制剂?患者人群又应如何分层?
这些疑问反映在了CheckMate-227的最初设计 [2] 中, 研究被分为两个独立的部分,共计6个试验组:
Part 1a(PD-L1 ≥ 1%) :O药单药组、O+Y组、化疗对照组,主要终点为对比化疗的OS、PFS
Part 1b (PD-L1 < 1%) :O+化疗组、O+Y组、化疗对照组,主要终点为对比化疗的OS、PFS
可以看出,作为一项开展时间较早的研究,CheckMate-227的最初设计具有很强的探索性质,研究者期望通过“广泛探索”的方式,为NSCLC一线免疫治疗找到可行的路径。

正如周清教授所言,CheckMate-227虽然是一项注册研究,但其设计具有明显的“探索”思维,这点也在其最初的统计分析计划中有所体现:Part 1a和1b虽然共享同一套研究方案,但统计分析计划是完全独立的,Part 1a和1b各自分配α=0.05,共8个终点平行参与α的分配(即4个PFS、4个OS),每个PFS终点各分得0.005,OS终点各分得0.02。6个试验组的计划样本量也完全一致(均为330例)。
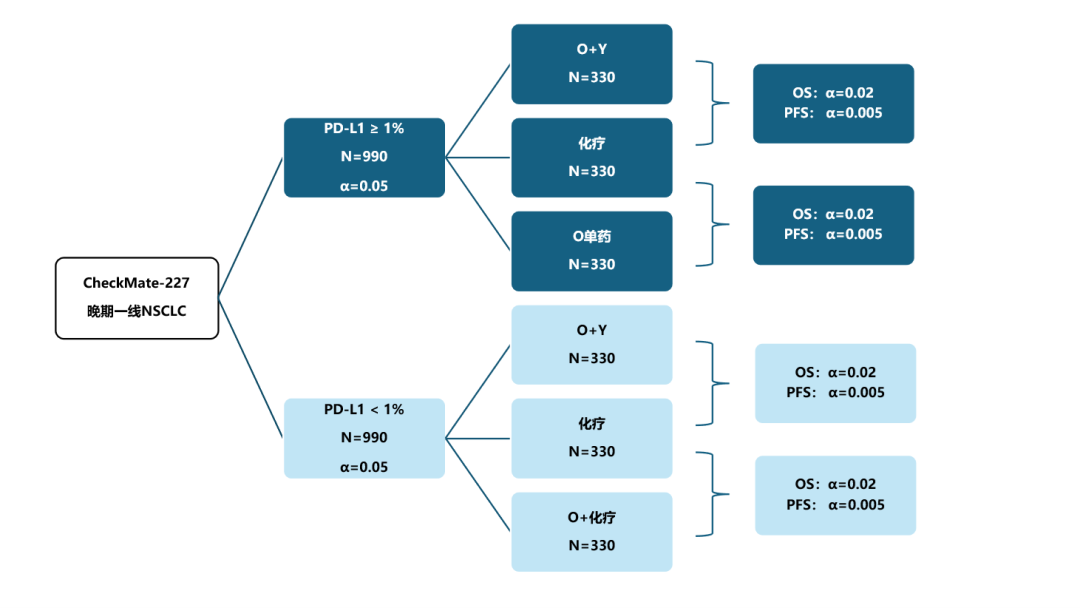
CheckMate-227:最初的样本量与α分配
这一设计体现了当时研究者充分开放的研究态度: 没有预设优势的人群亚组或治疗模式,而是期望通过全面、系统的比较 ,为后续免疫治疗策略的确立打下更扎实的基础。如果拿研究的最初版本和我们今天熟悉的版本做对照,可以发现,两者在入组人群和总体设计上基本保持一致(仅在样本量上有所调整),但在统计分析计划方面则有较大差别: 从最初多达8个平行主要终点收敛为仅保留2个主要终点,反映出研究经历了从“广泛探索”逐步走向“确证性验证”的过程。
CheckMate-227:最终的样本量与主要终点

在大型III期研究中,方案修订是一种常见且必要的过程; 回顾CheckMate-227的修订历程可以发现,其每次修订都是基于免疫治疗快速发展背景下,最新的外部研究成果和临床需求进行的动态调整 。 从统计学角度来说,两次修订均发生于研究开展早期,未进行揭盲或中期分析,且均对应地调整了α值的分配和入组样本量,这恰恰是其严谨性的体现,也是其能在 复杂背景下产出高价值结论的原因所在。
第一次修订发生于2016年11月 。此前的2016年ESMO大会上,PD-1单药用于PD-L1 ≥ 50% NSCLC一线人群的模式率先在取得了III期研究成功,这使得PD-L1 ≥ 50%成为了当时最明确的免疫治疗预测指标。受此影响,CheckMate-227的研究方案由原先开放的假设逐步收敛,聚焦于当时更具临床依据的人群和治疗模式 [2] :
Part 1a部分,主要终点被改为: PD-L1 ≥ 50%人群中,O+Y对比化疗的OS 。为确保统计学效力,Part 1a的总样本量从990例扩大至约1200例;
相对地,可能由于当时一线免疫治疗在PD-L1阴性人群中获益证据不足、前景仍不明朗,Part 1b的总样本量被缩减至约540例,主要终点也被改为: PD-L1 < 1%人群中,O+化疗对比化疗的PFS。
第二次修订发生于2017年,可能受多项研究结果的推动:
首先,CheckMate-026研究中肿瘤突变负荷(TMB)亚组分析结果显示, O药单药在高TMB的NSCLC一线患者中表现出较明显的PFS改善 (对比化疗的HR=0.62) [3] ;
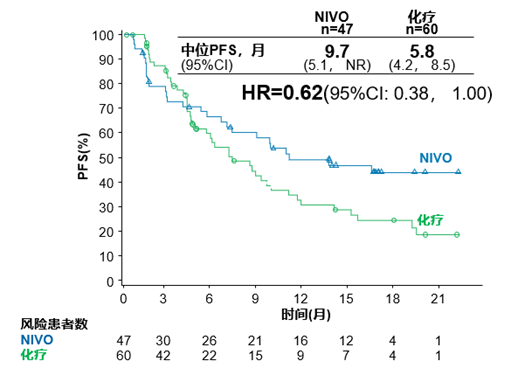
CheckMate-026:高TMB人群中O单药对比化疗的PFS
其次,II期CheckMate-568研究显示,O+Y在PD-L1 ≥ 1%与 ≥ 50%的NSCLC一线人群中PFS近似(6个月PFS率分别为52%和54%) [4] , 而按 TMB 状态分层后差异明显: TMB ≥ 10 mut/Mb人群的6个月PFS率达55%,<10 mut/Mb人群为31% [5] 。
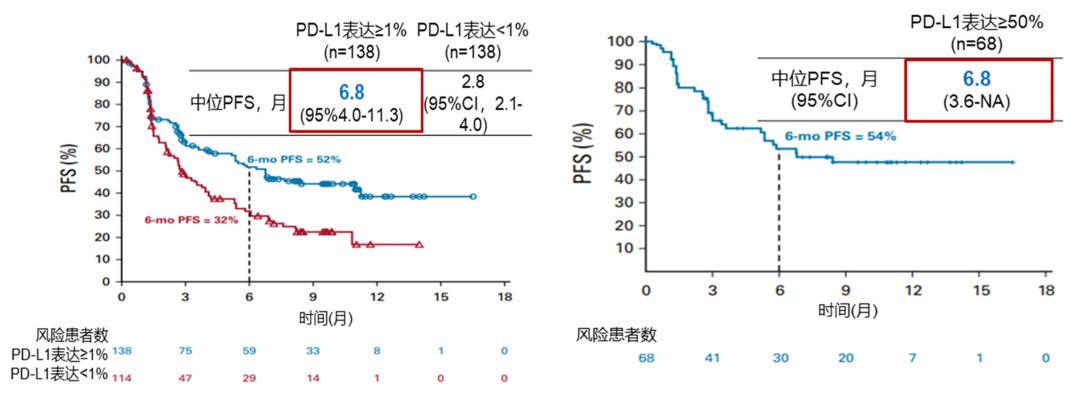
CheckMate-568:不同PD-L1表达人群中O+Y的PFS
(左:PD-L1≥ 1% vs. <1%;右:PD-L1 ≥ 50%)
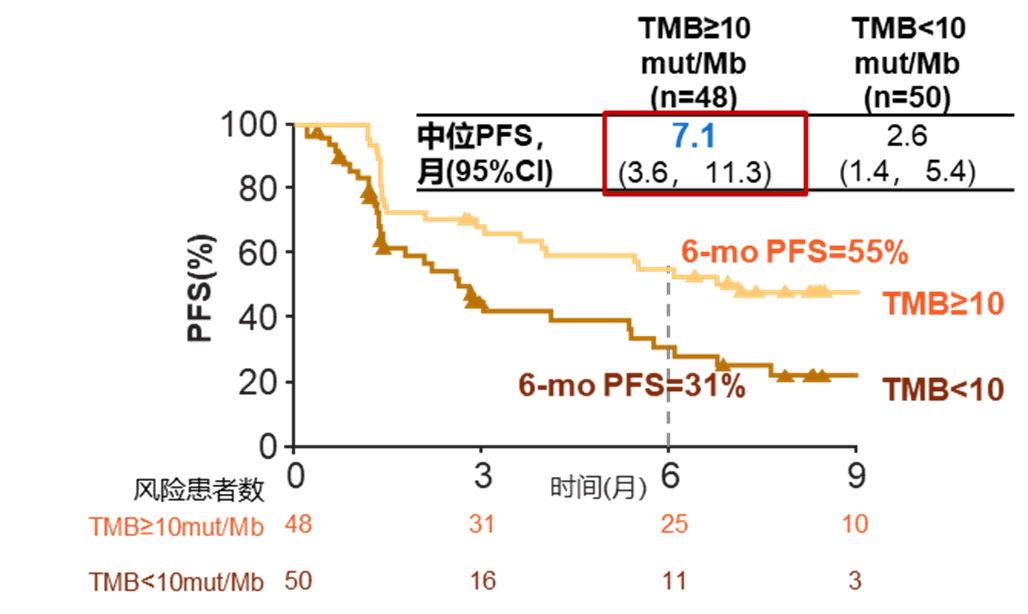
CheckMate-568:不同TMB人群中O+Y的PFS
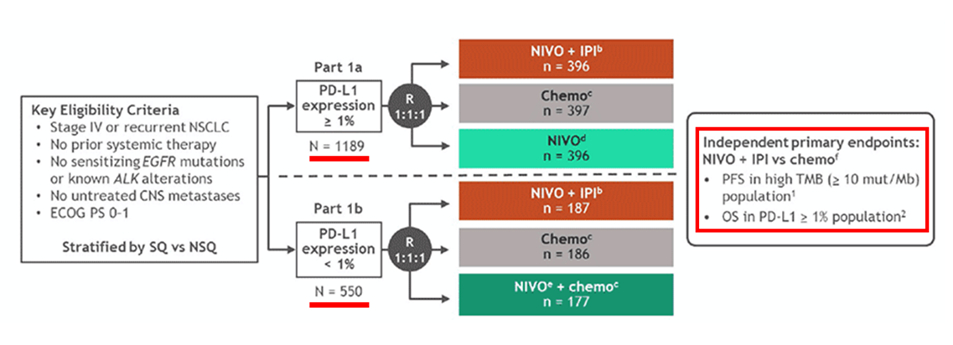
以上结果提示, TMB可能是 PD-L1 之外的独立预测因子 ,具有较大潜力。基于此, 研究者选择在CheckMate-227中引入TMB这一全新标志物,设计从开始的“多臂探索”演变为两条平行路径——PD-L1与TMB分层 [6] ;最初的part 1a/1b划分也已不再具有实质性统计意义,仅作为患者入组和数据结构上的标签存在:
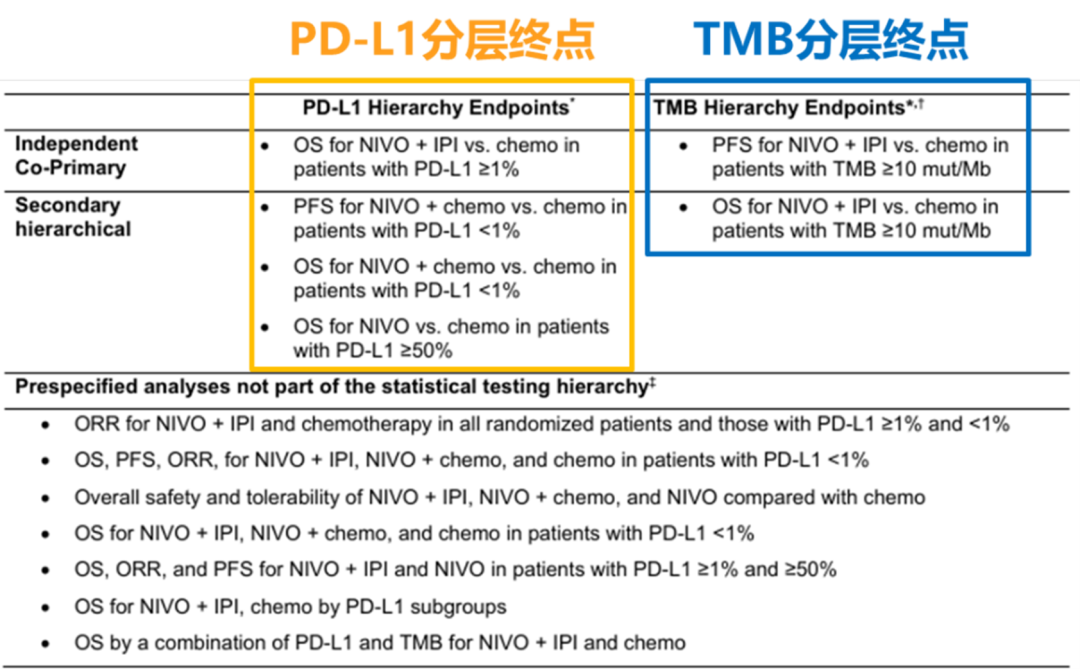
CheckMate-227第二次修订后:研究终点与统计分析计划
PD-L1 分层 : 主要终点重新变为 O+Y对比化疗,在PD-L1 ≥ 1% 人群中的OS ;如果结果为阳性,则对其下一层级的数个次要终点(在不同PD-L1分层人群中,对比O+化疗/O单药 vs. 化疗)进行层级检验;
TMB分层: 研究者将另一主要终点设置为 O+Y对比化疗,在高TMB (≥ 10 mut/Mb)人群中的PFS ;如果结果为阳性,则对其下一层级的次要终点——O+Y对比化疗,在高TMB人群中的OS进行层级检验。
第二次修订后的方案成为了CheckMate-227的最终方案。2018-19年, 研究在这两大主要终点上均取得了阳性结果,先后发表于《新英格兰医学杂志》 [7], [8],确证了O+Y在NSCLC一线中的价值。随后,基于PD-L1 ≥1% 人群的结果,O+Y用于PD-L1 ≥ 1% NSCLC的适应症很快获FDA批准 ;至于TMB分层的终点结果,由于后续OS亚组分析显示,不同TMB分层人群的OS获益近似,其疗效预测价值仍不明确,因此以TMB为人群划分依据的适应症申报未继续推进。
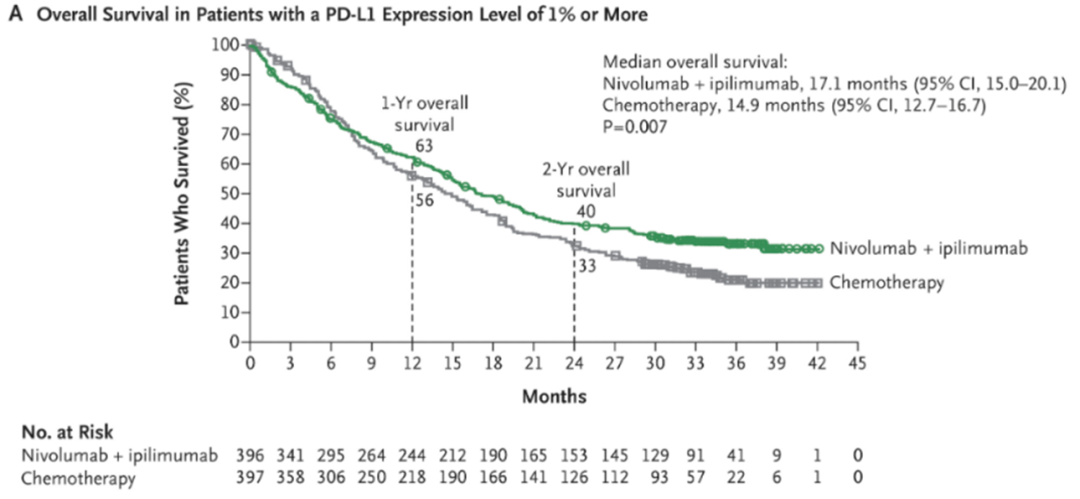
CheckMate-227主要终点:
O+Y对比化疗用于PD-L1 ≥ 1% 人群OS
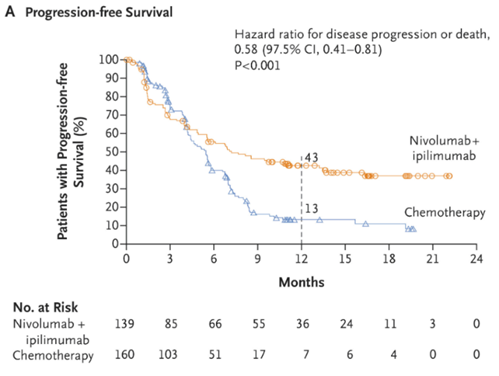
CheckMate-227主要终点:O+Y对比化疗用于高TMB人群PFS
方案修订带来的一个更令人遗憾的结果是,今天看来研究中最亮眼的数据: O+Y在PD-L1 < 1%人群中的OS [7] ,由于在最终的统计分析计划中仅作为描述性终点存在,没有被分配任何α,无法用于支持适应症的获批——如果拿高考做类比,就如同一名考生考出了非常优秀的成绩,但由于在考前提交的志愿中没有填报某学校,最终无法被该校录取。
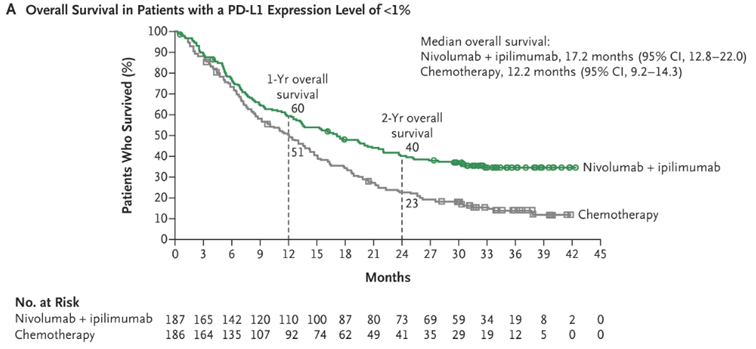
CheckMate-227:O+Y对比化疗用于PD-L1 < 1%人群OS
事后来看, CheckMate-227 的研究结果不仅在 PD-L1 ≥ 1% 人群中确证了 O+Y 的显著生存获益,也在 PD-L1<1% 人群中展现出明显的获益趋势 ,进一步拓宽了对免疫治疗潜在人群的认知,为后续研究设计与生物标志物策略的优化提供了重要启示。

相信梁斐教授的细致梳理解答了很多临床医生长期以来的疑问——CheckMate-227研究方案历经多次调整,其本质是在当时的背景下, 基于免疫治疗证据的积累所作出的前瞻性优化,背后有较为充分的科学逻辑。
这一研究的严谨性后续也得到了大量长期随访结果的检验:CheckMate-227目前已经持续发布了 6年随访结果 。在主要分析人群——PD-L1 ≥ 1%患者方面, O+Y在6年期间展现出稳定的长生存获益,使超过1/5患者(22%)实现了6年长生存(化疗组13%),降低22%死亡风险 [9],且曲线后期“平台”效应明显。
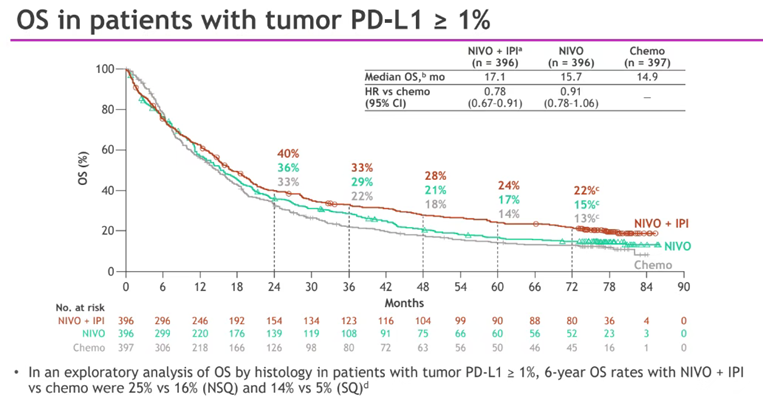
CheckMate-227(6年随访):PD-L1 ≥ 1%人群OS
不过正如梁斐教授所言,用现在的眼光来看, CheckMate-227中O+Y在PD-L1阴性人群中的OS数据颇具临床启示意义 :这部分患者从PD-1+化疗中的获益相对有限,多项III期研究中5年OS率对比化疗提升不足5% [10],[11] ,临床未满足需求更为突出; 而O+Y最终展现出的获益趋势却与PD-L1阳性人群高度一致:6年OS率为16%,较化疗组(5%)提升11%,死亡风险下降35% [9] 。不仅如此,PD-L1阴性人群是CheckMate-227的预设亚组,属于前瞻性结果,相比同类研究的回顾性分析,稳健度也更高。
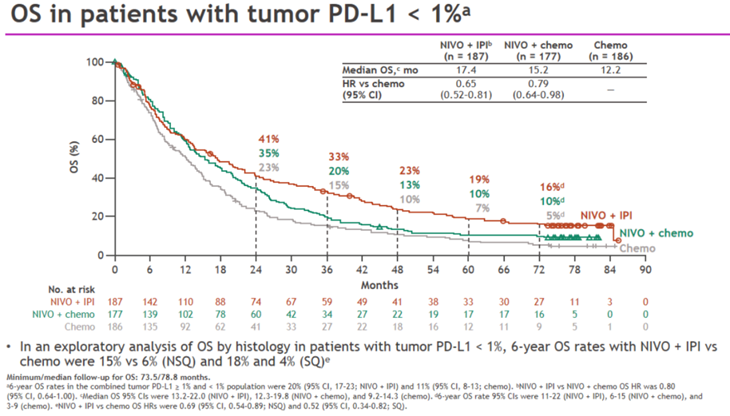
CheckMate-227(6年随访):PD-L1 < 1%人群OS
当然,当时的研究者在方案修订后仅将其作为探索性终点,可能是因为学术界对于免疫治疗的生物学理解尚处早期,普遍认为PD-L1阴性意味着免疫“冷肿瘤”,较难对纯免疫治疗产生应答;另一方面,对于CTLA-4的作用也认识不充分,低估了其 重塑免疫微环境、从源头激活免疫反应 的潜力,而这可能正是O+Y在PD-L1 < 1%人群中表现出较为明显获益趋势的原因。
除了PD-L1阴性人群,CTLA-4的这种“扭转免疫微环境”潜力,在CheckMate-227于2021年公布的KEAP1、STK11等突变亚组分析中也可找到印证 。这两者均是目前较明确的免疫治疗获益负向预测因子,患者接受PD-1+化疗的OS、PFS获益均十分有限,而O+Y对其均表现出一致获益趋势: 对KEAP1突变(n=38)、STK11突变(n=78)患者的4年OS率分别为44%(化疗组0%)和19%(化疗组5%),对比化疗的OS HR分别为0.31、0.78 [12] ,提示CTLA-4抑制剂的加入可能是这部分患者取得获益的关键。
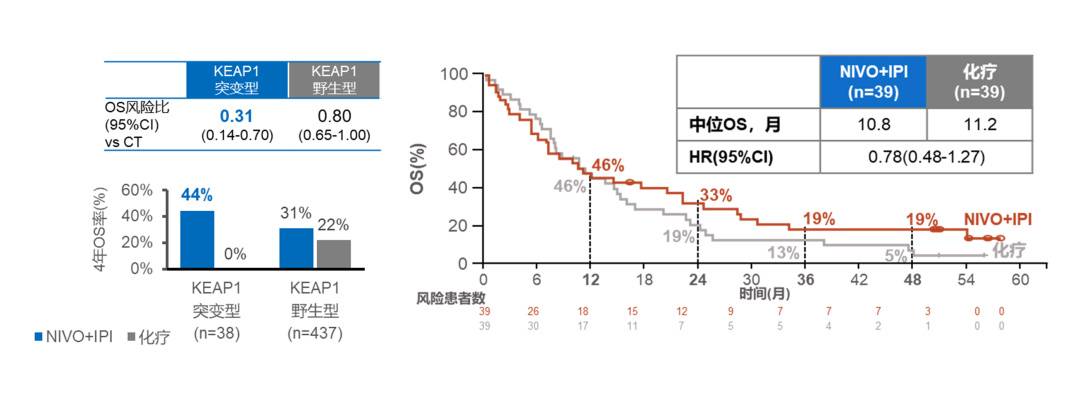
CheckMate-227:O+Y用于按KEAP1突变分层人群对比化疗的OS(左)
CheckMate-227:O+Y用于STK11突变人群的对比化疗的OS(右)
值得一提的是,这其中的详细机制直到2024年末,才被一篇发表于《Nature》的研究 [13] 阐明:KEAP1/STK11突变的肿瘤呈现较强的免疫抑制微环境,表现为CD8⁺ T细胞缺失、髓系抑制细胞富集等,可能导致T细胞功能被抑制;而小鼠模型证实,同时阻断CTLA-4和PD-1可增加CD4⁺ 效应 T 细胞的比例,包括Th1 细胞和效应记忆T细胞,同时提高Th1/调节性T细胞(Treg)的比例;并改善肿瘤微环境中髓系细胞的免疫活化状态,增加具有抗肿瘤活性(表达iNOS+)的抗原呈递细胞、单核细胞、中性粒细胞和肿瘤相关巨噬细胞的比例, 从而为“冷肿瘤”重新提供免疫激活通路、扭转免疫抑制微环境 ——而此时,距离CheckMate-227最初开展,已过去了近十年。
TMB的境遇则与PD-L1形成了对照。尽管其早期结果令人期待,但随后的研究显示其预测效力受到检测标准化等诸多因素限制。 但无论如何,这一系列探索历程正是 CheckMate-227 这类研究的价值所在,它帮助我们深刻地认识到了肿瘤治疗与免疫调控的复杂本质,也为后续探索指明了方向。

对监管部门而言,某个终点是否达到统计显著,是适应症能否获批的硬性标准;但对临床医生而言,解读一项研究的意义往往更加复杂:比如,研究假设是否合理、方案是否填补临床需求、结果是否经得起长期随访检验等等。从这个意义上讲, CheckMate-227的价值不只在于结果,同时在于展现了免疫治疗的探索如何在不确定中前行的过程。

O+Y用于NSCLC一线适应症在中国的获批,一方面填补了多项临床空白, 如具有长生存获益的“免化疗”方案、可用于既往免疫治疗难治性患者的方案等,在拓宽治疗边界的同时,也丰富了临床精准免疫治疗的手段;另一方面,也提供了良好的契机,使临床医生得以重新审视CheckMate-227这一经典研究。正如梁斐教授所言,它提醒着我们,真正的进步往往来自于不断的修正和验证,这也是医学发展的必经之路。
专家简介


参考文献:
[1]Peters S, et al. J Thorac Oncol. 2025 Oct;20(10):1505-1516.
[2]Hellmann MD, et al. N Engl J Med. 2019;381:2020–2031. Supplementary Material (Protocol).
[3]Solange P, et al. 2017 AACR, CT082.
[4]Ready N et al. J Clin Oncol. 2019;37:992-1000.
[5]Ramalingam SS, et al. 2018 AACR, CT078.
[6]Hellmann MD, et al. N Engl J Med. 2019;381:2020–2031. Supplementary Material (Supplementary Appendix).
[7]Hellmann MD, et al. N Engl J Med. 2019;381:2020–2031.
[8]Hellmann MD, et al. N Engl J Med. 2018;387:2093-2104.
[9]Ramalingam SS, et al. 2023 WCLC #OA14.03.
[10]Novello S, et al. J Clin Oncol. 2023;41(11):1999-2006.
[11]Garassino MC, et al. J Clin Oncol. 2023;41(11):1992-1998.
[12]Ramalingam S et al. 2021 ESMO IOl. Abstract 4O.
[13]Skoulidis F, et al. Nature. 2024 Nov;635(8038):462-471.
排版编辑:niko














 苏公网安备32059002004080号
苏公网安备32059002004080号


