胆管癌是一种侵袭性强、预后差的恶性肿瘤,多数患者确诊时已失去手术机会,系统性治疗是其主要治疗手段。过去十年,以吉西他滨联合顺铂为基础的化疗是晚期胆管癌的标准方案,但疗效有限,中位总生存期难以突破一年。近年来,随着分子病理学的深入和肿瘤免疫学的发展,胆管癌的治疗格局正经历深刻变革:一方面,针对特定驱动基因(如IDH1突变、FGFR2融合、BRAF V600E等)的靶向药物以其卓越的疗效和良好的安全性,开启了精准治疗的新纪元;另一方面,免疫检查点抑制剂与化疗的联合成功改写了一线治疗标准,而双免疫联合、靶向联合免疫等创新策略的探索,则预示着疗效的进一步突破可能。值此契机,中国医学论坛报特邀山东大学齐鲁医院郝静教授,系统梳理胆管癌靶向与免疫治疗的最新证据与临床启示,聚焦序贯治疗策略的优化与生物标志物指导的个体化决策进行精彩点评,以期为临床实践提供参考。
专家简介
山东大学齐鲁医院
丹麦奥胡斯大学临床实验肿瘤学系访问学者
加拿大安大略省癌症研究院访问学者
CSCO神经内分泌肿瘤专委会委员
中国抗癌协会神经内分泌肿瘤专委会常委
中国医疗保健国际交流促进会神经内分泌肿瘤分会副主任委员
CSCO胰腺癌专委会委员
山东省医师协会神经内分泌肿瘤专委会主任委员
山东生物医学工程少见肿瘤转化医学专委会主任委员
山东省研究型医院协会肺癌转化医学专委会副主任委员
山东抗癌协会女医师分会副主任委员
山东省罕见疾病防治协会少见肿瘤分会副主任委员
山东省公共卫生协会消化道肿瘤防治委员会副主任委员
山东省抗癌协会肺癌专业委员会常委
艾伏尼布治疗IDH1突变型肝内胆管癌:
一项多中心真实世界研究的启示
IvosidenibforIDH1-MutantIntrahepaticCholangiocarcinoma: Insights From a Multicenter Real-World Study1
这项由欧洲多中心团队开展的回顾性真实世界研究,旨在评估IDH1抑制剂艾伏尼布在晚期IDH1突变型肝内胆管癌(iCCA)患者中的疗效与安全性,并与二线标准化疗方案FOLFOX/CAPOX进行比较。胆管癌(CCA)是一种罕见且预后差的恶性肿瘤,尽管一线化疗联合免疫治疗已取得进展,但二线治疗选择仍然有限。IDH1突变见于约15–20%的iCCA患者,艾伏尼布作为IDH1抑制剂已在III期ClarIDHy试验中显示出优于安慰剂的疗效,并获得FDA与EMA批准,但其在真实世界中的应用数据仍较为缺乏。本研究纳入了2021年5月至2024年9月期间在11家欧洲中心接受艾伏尼布治疗的46例晚期IDH1突变CCA患者,其中43.5%为二线治疗,56.5%为三线及以上治疗。研究主要终点为无进展生存期(PFS),次要终点包括总生存期(OS)、疾病控制率(DCR)、客观缓解率(ORR)及安全性。此外,研究通过逆概率处理加权(IPTW)方法,将其中20例接受二线艾伏尼布治疗的患者与41例接受二线FOLFOX/CAPOX治疗的历史队列患者进行疗效比较。
结果显示,艾伏尼布组的中位PFS为3.7个月,中位OS为11.5个月,DCR为50.0%,3级及以上不良事件发生率为8.7%,耐受性良好。在二线治疗的对比分析中,经IPTW校正后,艾伏尼布组的中位PFS显著优于化疗组(6.9个月 vs 2.1个月,HR: 0.36, P=0.0005),中位OS亦显著延长(15.9个月 vs 9.0个月,HR: 0.47, P=0.0405)。亚组分析显示,肝功能正常及ECOG评分为0的患者获益更明显;部分患者(15.2%)持续用药超过一年,且治疗反应与生存期显著相关。
不可切除胆管癌的靶向治疗与免疫治疗
Targeted therapies and immunotherapies for unresectable cholangiocarcinoma2
CCA是一种发病率持续上升、预后极差的恶性肿瘤,多数患者确诊时已属晚期,失去了手术机会,使得以化疗、靶向治疗和免疫治疗为主的系统性治疗成为不可切除CCA管理的核心。尽管基于ABC-02和ABC-06研究,吉西他滨联合顺铂以及FOLFOX方案已分别确立为一线和二线标准治疗,但化疗的累积毒性和耐药性仍是重大挑战。近年来,随着对CCA分子分型认识的深入,针对特定分子异常的靶向治疗和旨在激活人体免疫系统的免疫治疗带来了更精准、个性化的治疗选择,推动了不可切除CCA进入精准治疗时代。
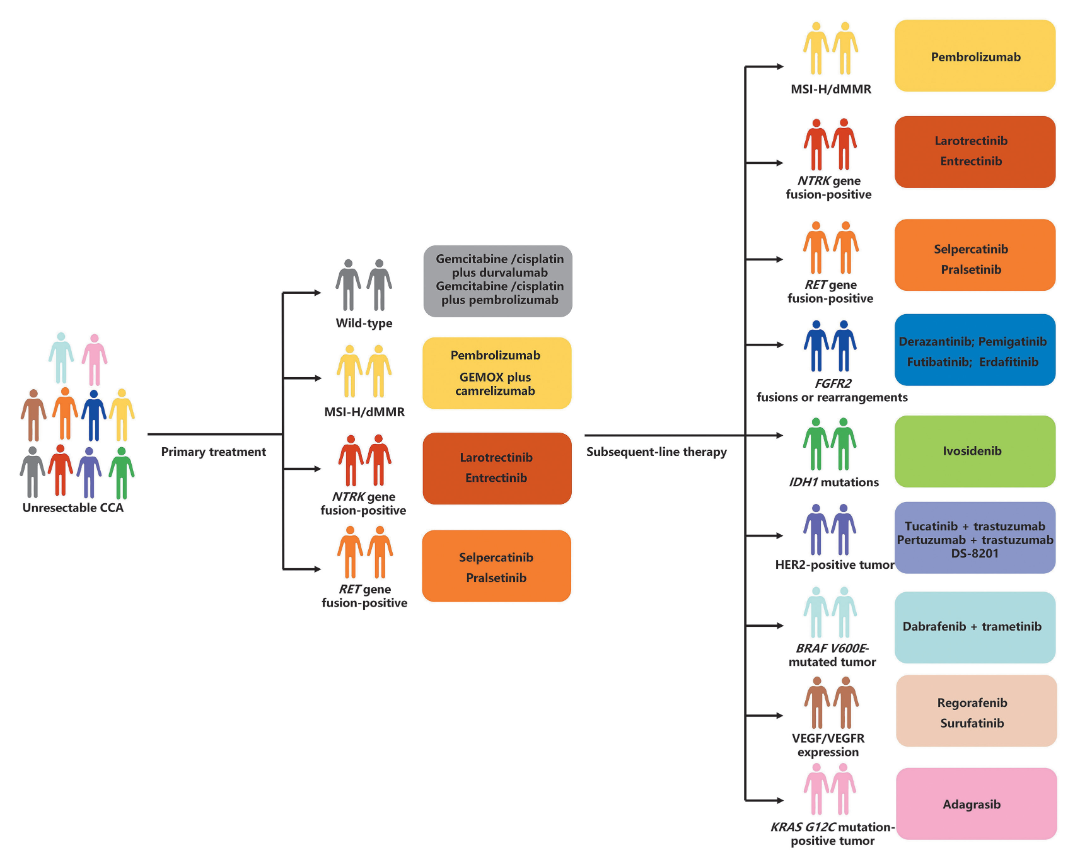
本综述旨在系统总结不可切除CCA靶向治疗与免疫治疗的最新进展,通过梳理大量关键性临床研究数据,评估各类重要药物的疗效与安全性。靶向治疗方面,FGFR2基因融合作为iCCA中最具代表性的驱动变异之一,发生率约为10%–15%,为这部分患者提供了明确的治疗方向。以佩米替尼为例,其在关键II期FIGHT-202研究中展现出令人鼓舞的疗效。该研究纳入了107例既往经治的FGFR2融合/重排CCA患者,结果显示中位PFS为6.9个月,中位OS达到21.1个月;进一步分析显示,6个月PFS率达到60.5%,1年PFS率也维持在35.8%;福巴替尼作为不可逆FGFR1–4抑制剂,其II期FOENIX-CCA2研究结果显示,中位PFS为9.0个月,中位OS为21.7个月;6个月PFS率为70.9%,1年PFS率为34.5%;针对IDH1突变(约10-20%的iCCA)的艾伏尼布(ClarIDHy研究)能显著改善无进展生存期和总生存期,艾伏尼布组对比对照组的中位PFS为2.7个月对比1.4个月(单侧P <0.0001);中位OS为10.3个月对比5.1个月(单侧P<0.001)。针对BRAF V600E、NTRK融合、RET融合、KRAS G12C、HER2扩增/过表达以及VEGF/VEGFR通路等多种靶点的药物(如达拉非尼+曲美替尼、拉罗替尼、阿达格拉西布、德曲妥珠单抗、泽尼达妥单抗等)也在相应患者群体中展现出令人鼓舞的抗肿瘤活性,部分已写入NCCN、CSCO等临床指南。免疫治疗方面,尽管免疫检查点抑制剂单药疗效有限,但其与化疗的联合改变了晚期CCA的一线治疗格局:基于TOPAZ-1和KEYNOTE-966 III期研究,度伐利尤单抗或帕博利珠单抗联合吉西他滨和顺铂相比单纯化疗显著改善患者的总生存期,已成为新的标准一线方案。此外,靶向治疗与免疫治疗的联合(如仑伐替尼联合特瑞普利单抗及GEMOX方案)、过继性细胞(ACT)疗法等新兴策略也显示出广阔前景。
晚期或转移性胆道癌患者靶向治疗和免疫检查点抑制剂的疗效与安全性:一项试验的荟萃分析及序贯分析
Efficacy and safety of targeted therapy and immune checkpoint inhibitors in patients with advanced or metastatic biliary tract cancer: a meta-analysis of and sequential analysis of trials3
本研究旨在系统评估靶向治疗与免疫检查点抑制剂在晚期或转移性胆道癌患者中的疗效与安全性。研究方法严格遵循PRISMA指南,检索截至2024年10月的PubMed、Embase和Web of Science数据库,纳入15项随机对照试验,共计4203例患者。采用随机效应或固定效应模型合并分析总生存期、无进展生存期、客观缓解率、疾病控制率和不良事件等结局指标,并进行亚组分析、Meta回归、敏感性分析和试验序贯分析以验证结果的稳健性。
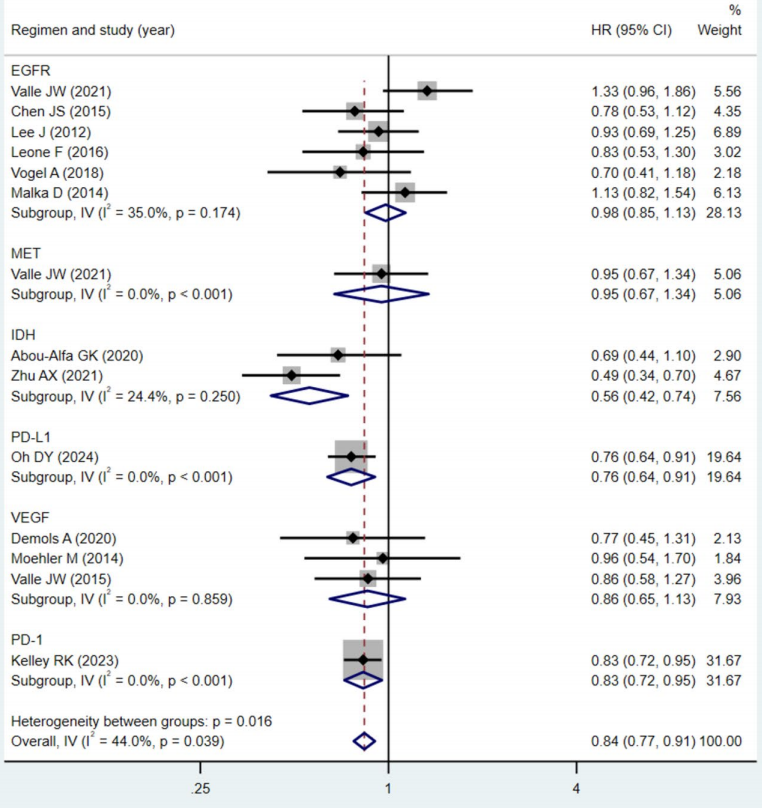
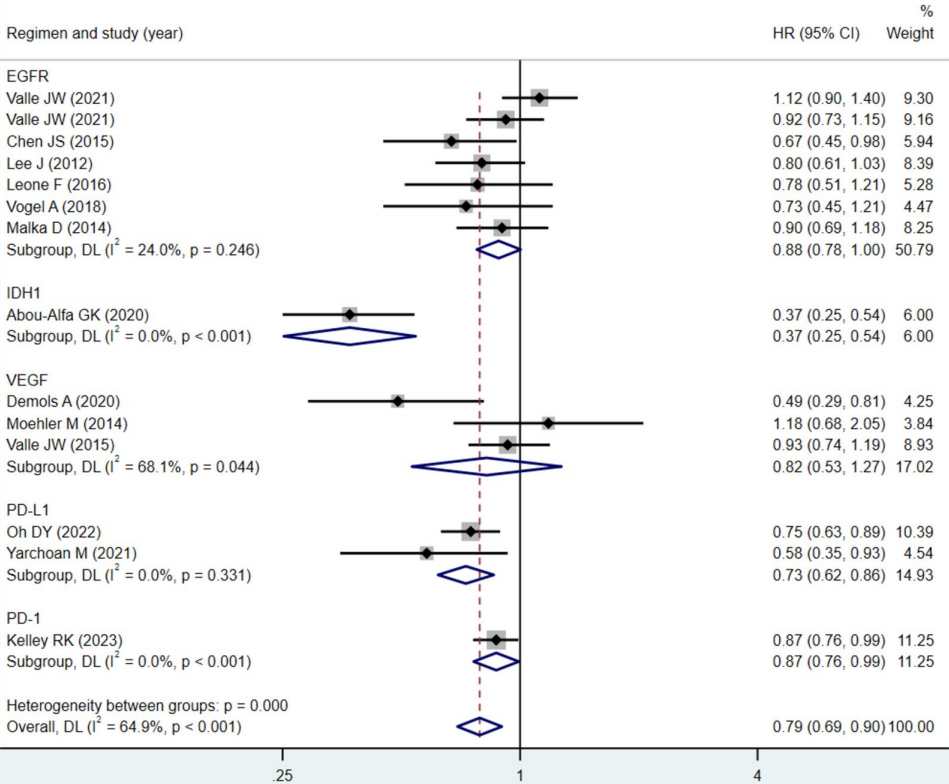
研究结果显示,总体而言,靶向与免疫治疗显著改善OS(HR=0.84)、PFS(HR=0.79)、ORR(RR=1.29)和DCR(RR=1.06)。亚组分析进一步揭示,PD-L1抑制剂、IDH1抑制剂和PD-1抑制剂在OS和PFS方面均表现出显著优势,而抗EGFR药物、MET抑制剂和抗VEGF药物则未显示显著生存获益。序贯分析结果显示,无论是作为一线还是二线治疗,靶向与免疫治疗均显著改善OS(一线HR=0.87,P=0.001;二线HR=0.65,P<0.001)和PFS(一线HR=0.88,P=0.002;二线HR=0.51,P<0.001),且二线治疗的效应值更优,提示在化疗进展后序贯使用靶向或免疫治疗仍能带来显著生存获益,尤其是在IDH1抑制剂和PD-1/PD-L1抑制剂中表现突出。安全性方面,所有级别、严重及3-4级不良事件的发生率与对照组相当,常见不良事件包括腹泻、血小板减少、发热等,多数可通过剂量调整和支持治疗控制。
替雷利珠单抗和欧司珀利单抗联合吉西他滨和顺铂一线治疗晚期胆道癌(ZSAB-TOP):一项多中心、单臂、2期研究
First-line tislelizumab and ociperlimab combined with gemcitabine and cisplatin in advanced biliary tract cancer (ZSAB-TOP): a multicenter, single-arm, phase 2 study4
尽管KEYNOTE-966和TOPAZ-1等III期研究已确立PD-1/PD-L1抑制剂联合GemCis为标准方案,但其生存获益仍显有限,ORR提升不明显;临床前研究提示,TIGIT与PD-1/PD-L1双重阻断可能产生协同抗肿瘤效应。在此背景下,本研究旨在探索PD-1抑制剂替雷利珠单抗与TIGIT抑制剂欧司珀利单抗联合标准化疗(GemCis)在晚期胆道癌一线治疗中的疗效与安全性。
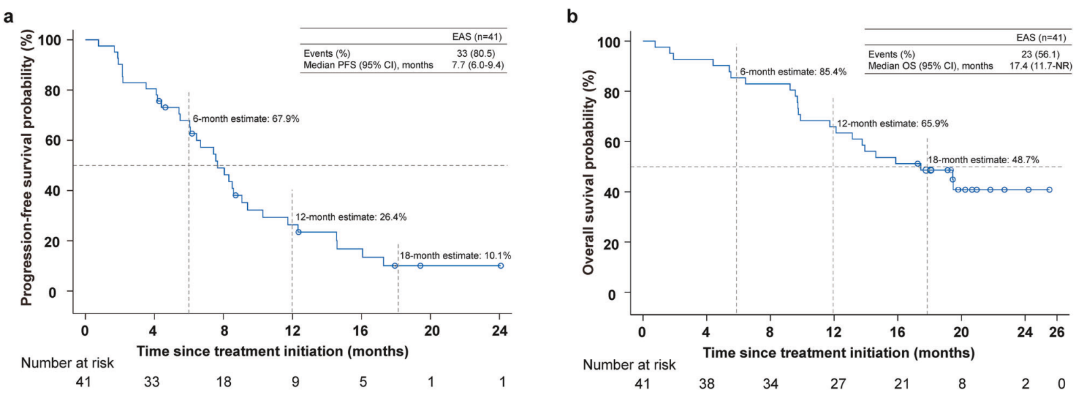
本研究为单臂II期试验,共纳入45例未经系统性治疗的晚期胆道癌患者,给予替雷利珠单抗(200mg)、欧司珀利单抗(900mg)及GemCis(吉西他滨1000mg/m² + 顺铂25mg/m²)联合治疗,主要终点为研究者评估的确认客观缓解率。结果显示,在41例可评估疗效的患者中,确认ORR达51.2%,显著优于预设的历史对照ORR 25%,中位无进展生存期为7.7个月,中位总生存期达17.4个月,展现出令人鼓舞的疗效。尤为重要的是,生物标志物分析揭示TIGIT与PD-L1双阳性患者获益更为显著,其ORR高达75%,提示该人群可能是此类双重免疫联合化疗的潜在优势人群。安全性方面,≥3级治疗相关不良事件发生率为60%,以血液学毒性为主,免疫相关不良事件发生率为42.2%,多数为1-2级,整体安全谱可控,未见新的非预期信号。
郝静教授:以上文献分别从真实世界研究、治疗策略综述、荟萃分析和前瞻性临床试验的角度,为我们勾勒出当前BTC精准治疗的清晰轮廓,同时也提出了值得深入思考的临床问题。艾伏尼布的真实世界研究有效衔接了III期临床试验(ClarIDHy)与日常临床实践。该研究不仅验证了艾伏尼布在IDH1突变型iCCA患者中的疗效和良好安全性,其更重要的贡献在于通过严谨的统计方法(IPTW)证实了在二线治疗中,艾伏尼布相较于传统化疗(FOLFOX/CAPOX)能带来显著的PFS和OS获益(中位PFS: 6.9 vs 2.1个月;中位OS: 15.9 vs 9.0个月)。这为IDH1突变患者的二线治疗决策提供了强有力的高级别真实世界证据。尤其值得注意的是,亚组分析提示肝功能良好和ECOG评分0分的患者获益更显著,提醒我们在临床实践中需综合评估患者的一般状况和器官功能,以优化靶向治疗的人群选择。部分患者(15.2%)能够持续用药超过一年,预示着可能存在优势人群,未来需进一步探索其内在的分子标志物。
BTC靶向与免疫治疗的综述系统性地梳理了从FGFR2、IDH1到BRAF V600E、NTRK等诸多靶点及其相应药物的研究数据,展现了BTC已进入基于分子分型的精准治疗时代。同时,文章也客观指出了当前面临的挑战:其一,大部分靶向药物的适应症人群相对有限(如NTRK融合发生率极低),如何通过高效的检测平台识别这些人群是推广精准治疗的前提;其二,获得性耐药是靶向治疗无法回避的问题,其机制及后续策略亟待探索;其三,尽管免疫联合化疗(TOPAZ-1/KEYNOTE-966模式)已成功跻身一线标准治疗,但其疗效提升仍有限,如何进一步提升疗效(如联合抗血管药物、双免疫联合等)是未来的重要方向。
靶向与免疫治疗疗效与安全性的荟萃分析证实,无论是一线还是二线使用靶向或免疫治疗,都能为患者带来生存获益。特别值得注意的是,二线使用的效应值(HR)似乎更优(OS: 二线HR=0.65 vs 一线HR=0.87;PFS: 二线HR=0.51 vs 一线HR=0.88)。这一发现提示我们,在一线化疗(或化疗联合免疫)进展后,根据基因检测结果序贯使用相应的靶向药物(如IDH1抑制剂)或免疫检查点抑制剂,仍然是极具价值的治疗策略,不应轻易放弃。这挑战了“后线治疗疗效必然递减”的传统观念,强调了分子分型指导下的全程化管理的重要性。该荟萃分析还明确指出了不同靶点药物的疗效异质性,如PD-1/PD-L1和IDH1抑制剂表现突出,而EGFR、MET抑制剂则未显示优势,再次凸显了生物标志物驱动治疗决策的核心地位。
ZSAB-TOP这项II期研究则将目光投向了双免疫检查点抑制这一前沿领域。在TOPAZ-1和KEYNOTE-966的基础上,该研究尝试GemCis化疗联合PD-1抑制剂替雷利珠单抗和TIGIT抑制剂欧司珀利单抗,结果令人振奋:ORR高达51.2%,中位OS达17.4个月,均优于既往化疗联合单免疫方案的历史数据。更关键的是,其生物标志物分析发现TIGIT与PD-L1双阳性患者的ORR达到了惊人的75%,为精准筛选优势人群提供了极具潜力的预测指标。尽管这是一项单臂研究,但其结果有力地支持了双重免疫阻断联合化疗在晚期BTC一线治疗中的巨大潜力,并指明了未来III期研究应重点围绕TIGIT/PD-L1共表达人群展开。安全性数据显示该方案耐受性尚可,未出现新的安全信号,但其≥3级TRAEs发生率达60%,提示在追求疗效的同时,需对联合治疗带来的毒性叠加保持高度警惕并做好管理预案。
总结而言,BTC治疗的未来方向愈发清晰:一是强化分子检测,实现“应检尽检”,为靶向治疗奠定基础;二是探索更优的联合治疗模式,包括双免疫、免疫联合抗血管、免疫联合靶向等,以突破现有疗效瓶颈;三是深化对治疗顺序和耐药机制的理解,实现患者的全程化、个体化管理,开创从标准化走向精准化与个性化并重的BTC治疗新时代。
1. Niger M, Rimini M, Castet F, et al. Ivosidenib for IDH1-Mutant Intrahepatic Cholangiocarcinoma: Insights From a Multicenter Real-World Study. Liver Int. 2025 Sep;45(9):e70295. doi: 10.1111/liv.70295. PMID: 40856270; PMCID: PMC12379572.
2. Xue S, Jiang W, Ma J, et al. Targeted therapies and immunotherapies for unresectable cholangiocarcinoma. Chin Med J (Engl). 2025 Aug 20;138(16):1904-1926. doi: 10.1097/CM9.0000000000003705. Epub 2025 Jul 21. PMID: 40693603; PMCID: PMC12369749.
3. Mao T, Li X, Wang L, et al. Efficacy and safety of targeted therapy and immune checkpoint inhibitors in patients with advanced or metastatic biliary tract cancer: a meta-analysis of and sequential analysis of trials. Hepatol Int. 2025 Aug 5. doi: 10.1007/s12072-025-10860-0. Epub ahead of print. PMID: 40760243.
4. Shi, G., Huang, X., Ma, L. et al. First-line tislelizumab and ociperlimab combined with gemcitabine and cisplatin in advanced biliary tract cancer (ZSAB-TOP): a multicenter, single-arm, phase 2 study. Sig Transduct Target Ther 10, 260 (2025). https://doi.org/10.1038/s41392-025-02356-y
本资料的内容仅作为科学信息参考,仅用于医疗卫生专业人士的学术交流,请勿用于任何其他用途。若您不是医疗卫生专业人士,请勿观看和/或传播此资料。
本资料可能会出现某些药品信息,但该药品/适应症可能尚未获得国家药品监督管理局的注册批准。医疗卫生专业人士做出的任何与治疗有关的决定应根据患者的具体情况并应参照国家药品监督管理局批准的药品说明书。对于本资料可能提到的相关诊断、治疗方法,请遵守国家卫生健康委员会以及相关部门批准使用的指南或规定。
审批号:M-TIBSO-CN-202510-00004
本文转自:中国医学论坛报今日肿瘤











 苏公网安备32059002004080号
苏公网安备32059002004080号


