G3级神经内分泌瘤具有侵袭性强、进展快、治疗方案有限的特点,给临床治疗带来了巨大挑战。本文分享一例G3级胰腺神经内分泌肿瘤(pNET G3)的完整诊疗过程,该患者在经历两轮化疗进展后,通过再次活检和分子检测,发现了高肿瘤突变负荷(TMB-H)的特征,最终在化疗联合免疫治疗下取得了显著疗效。本案例旨在探讨该类肿瘤在治疗过程中的演变、分子标志物的指导价值以及免疫治疗的应用前景,以期为晚期pNET G3的治疗提供参考。
病例介绍
患者基本情况:女,32岁。
诊疗经过(外院):患者于2018年5月体检时腹部CT发现胰尾占位,在外院接受了“胰体尾+脾脏切除术”。术后广州中山一附院病理会诊示:肿瘤大小3.8*2.5cm,切缘阴性,淋巴结0/6枚转移,符合胰腺神经内分泌瘤,G3,免疫组化见瘤细胞CK+, CgA弥漫+, Syn弥漫+, CDX2+, CK20-, CK7-, CA19-9-, Ki-67 30%, SSTR2散在少数细胞+, MGMT弥漫+。

(外院)PET/CT双扫示,腹腔及腹膜后多发淋巴结转移,生长抑素受体弱表达,糖代谢轻度增高。
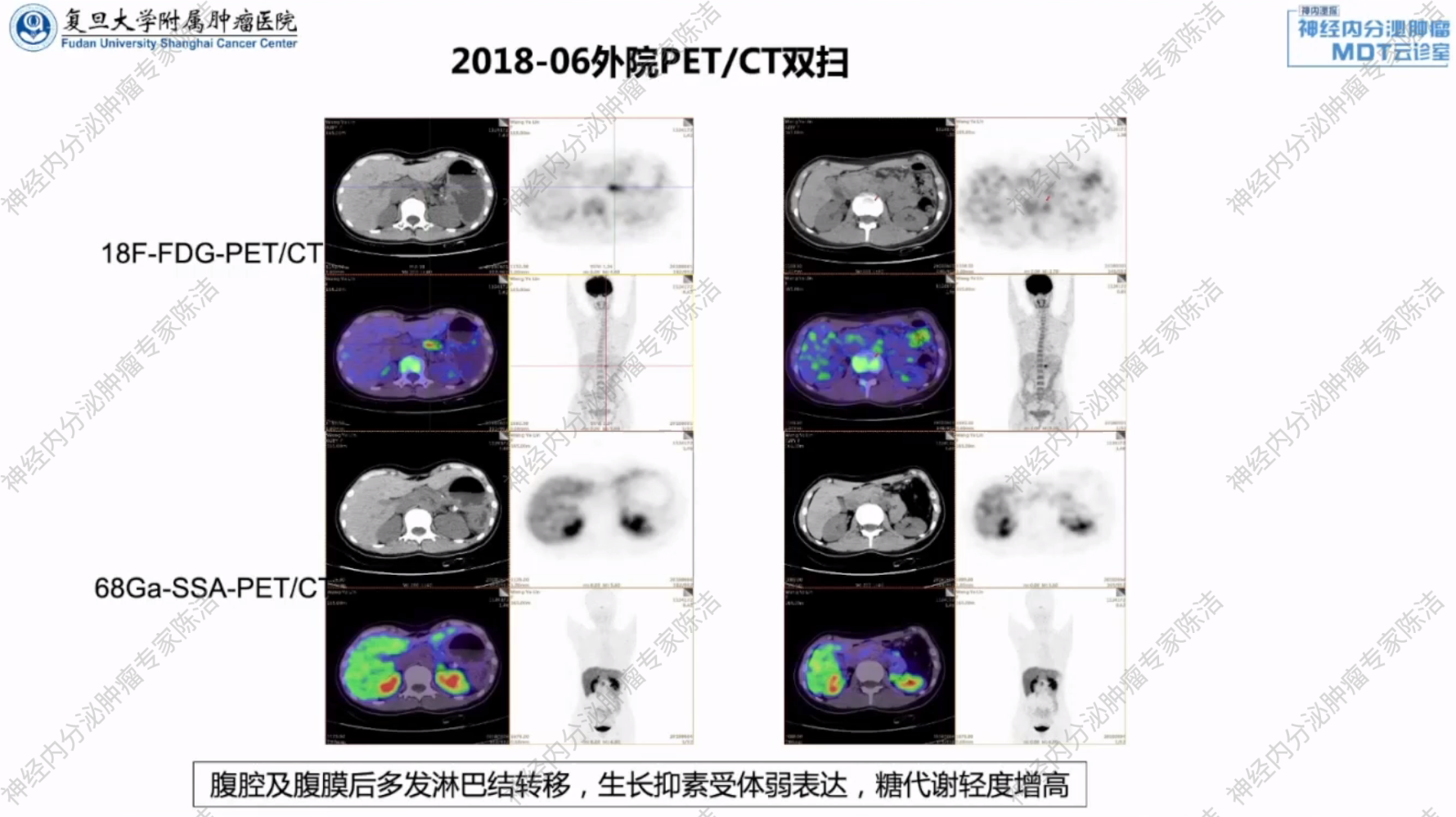
2018年6月至2019年5月,患者接受了卡培他滨+替莫唑胺(CAPTEM方案)化疗12个周期。治疗后病情稳定,进入定期随访阶段。2020年10月外院复查增强CT时发现,腹腔及腹膜后淋巴结较前增大,提示疾病进展。
考虑到患者对CAPTEM方案曾有应答且无化疗间歇期超过半年,2020年10月至2021年10月,再次给予CAPTEM方案化疗12个周期。治疗期间,腹腔肿瘤一度有所缩小。
诊疗经过(我院):2022年7月,患者因自觉颈部淋巴结进行性肿大,至我院就诊。
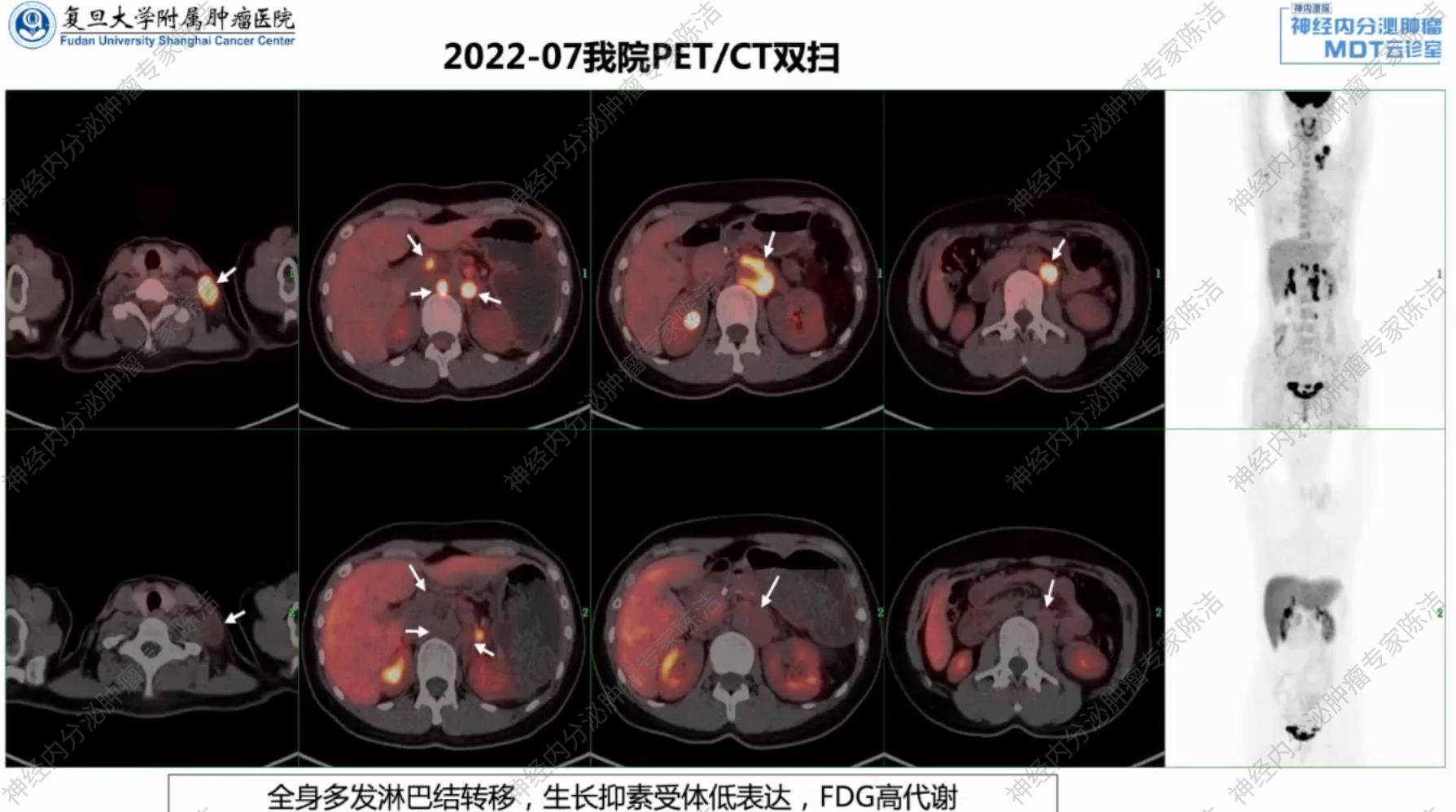
(我院)PET/CT双扫示:全身多发淋巴结转移,生长抑素受体低表达,FDG高代谢。
(我院)增强CT:左锁骨区多发肿大淋巴结,肝门区、腹膜后及膈脚后多发肿大淋巴结。
(我院)颈部淋巴结穿刺病理示:神经内分泌瘤转移,AE1/AE3+, CDX2+, Syn+, CgA部分+, CD56+, INSM1+, Ki-67 30%, MGMT-。

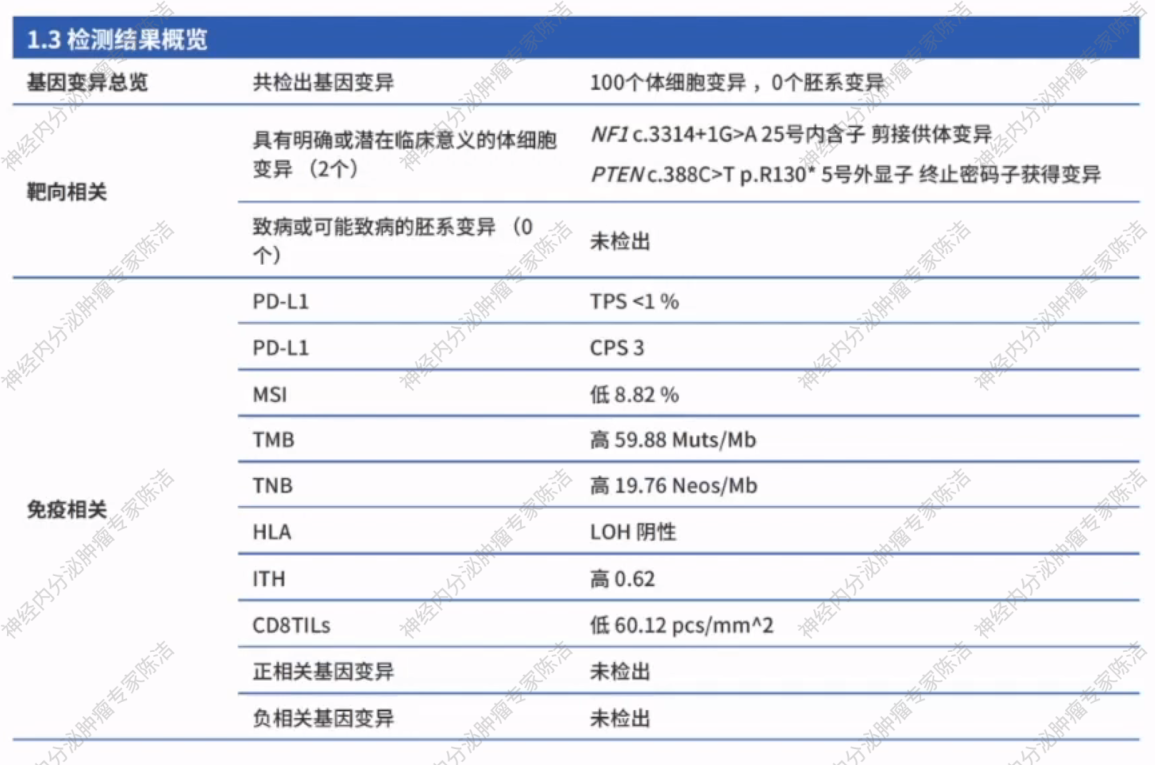
为指导后续治疗,对穿刺组织进行了详细的免疫相关生物标志物检测:
PD-L1表达:CPS=3,TPS<1%。
微卫星状态(MSI):微卫星稳定(MSS)。
肿瘤突变负荷(TMB):高(59.88 Muts/Mb)。
CD8阳性浸润T淋巴细胞(CD8+ TILs):数量较低(60.12 pcs/mm²)。
后续治疗方案:鉴于患者对CAPTEM方案耐药,且分子检测提示TMB-H,经多学科讨论后,决定采用XELOX方案(奥沙利铂+卡培他滨)化疗联合PD-1单抗免疫治疗。

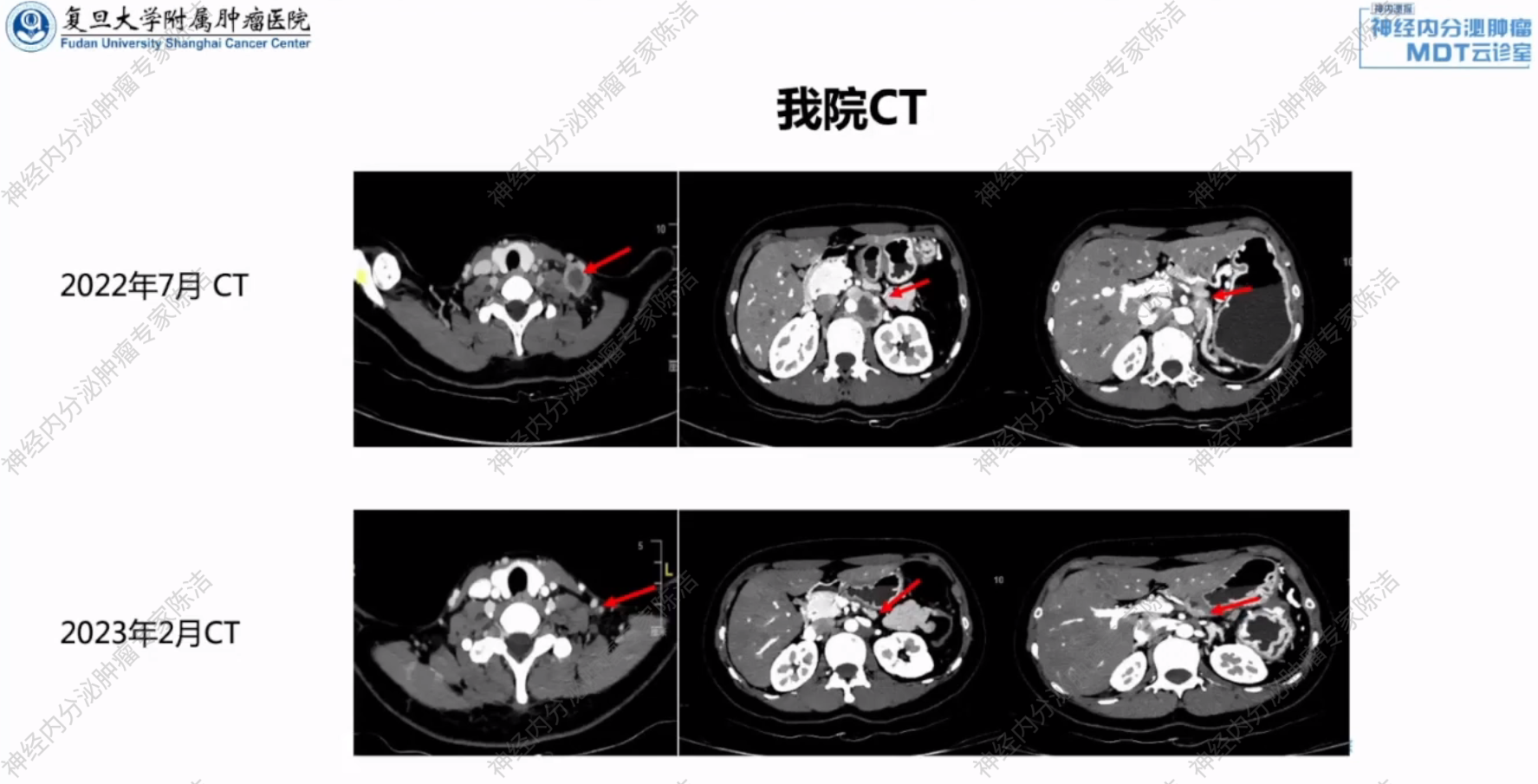
疗效评估(2023年2月):治疗后复查CT显示,无论是颈部还是腹腔的转移淋巴结,均较治疗前显著缩小,总体疗效评价为部分缓解(PR)。
维持治疗:患者目前正接受PD-1单抗单药维持治疗,病情持续稳定。

多学科团队(MDT)讨论
病理科李媛教授:本病例的再次活检意义重大。两次病理结果虽都显示为NET G3,Ki-67指数稳定在30%左右,但分子标志物出现了重要变化。初次手术时病理提示MGMT弥漫阳性,而经过两轮含替莫唑胺的化疗后,颈部转移灶的MGMT表达转为阴性,这反映了肿瘤在治疗压力下的异质性演进。更关键的是,基因检测发现了TMB-H,这为免疫治疗的应用提供了强有力的理论依据。PD-L1的表达(CPS=3)虽然不高,但在TMB-H的背景下,患者仍可能从免疫治疗中获益。
放射诊断科汤伟教授:通过对比2022年7月和2023年2月的CT影像,可以直观地看到治疗带来的显著效果。治疗前的左侧颈部和腹膜后淋巴结肿大明显,经过8周期化疗联合免疫治疗后,这些病灶均出现了明确的缩小,影像学诊断符合PR标准,证实了该治疗方案的有效性。
核医学科徐俊彦教授:PET/CT双扫的动态变化清晰地展示了疾病的演变过程。从2018年术后到2022年再次就诊,FDG PET的影像显示肿瘤的糖代谢活性显著增高,而SSTR PET的显像从弱表达变为低表达,这说明肿瘤发生了“去分化”,恶性程度增加,侵袭性更强。这与临床上患者病情不断进展的情况吻合,也解释了为何生长抑素类似物不是有效的治疗选项。
陈洁教授总结
这是一例非常具有启发性的G3级胰腺神经内分泌瘤病例。患者非常年轻,但疾病侵袭性强,在经历了两轮共24个周期的标准化疗后,依然出现了疾病进展。此时,我们面临着治疗选择的困境。
幸运的是,我们坚持了再次活检和全面的分子检测。这一决策成为整个治疗过程的转折点。检测结果显示,患者的肿瘤具有TMB-H的特征。尽管其PD-L1表达不高且为MSS,但TMB-H是目前公认的、独立于PD-L1表达和MSI状态的免疫治疗疗效预测标志物。我们推测,患者长期接受替莫唑胺治疗,可能诱导了肿瘤细胞产生大量基因突变,从而形成了TMB-H的“获得性”免疫治疗优势人群。
基于这一发现,我们果断地为患者制定了XELOX化疗联合PD-1单抗的治疗策略。化疗旨在快速控制肿瘤负荷,而免疫治疗则利用TMB-H的特点来激发持久的抗肿瘤效应。最终,患者获得了较理想的“部分缓解”的疗效,生活质量也得到改善。
这一病例深刻揭示了,对于进展迅速、标准治疗失败的神经内分泌肿瘤,再次活检以获取最新的病理和分子信息至关重要。肿瘤的生物学特性是动态变化的,治疗可能诱导新的分子特征出现,如本例中的MGMT表达丢失和TMB升高,从而为后续治疗提供新的靶点和机会。并且,在神经内分泌肿瘤领域,TMB-H可以作为指导免疫治疗选择的强有力生物标志物,即使在PD-L1低表达和MSS的患者中,也值得尝试化疗联合免疫的策略。
更多精彩病例,可点击或复制以下链接,粘贴到浏览器查看神经内分泌肿瘤MDT云诊室-神经内分泌肿瘤免疫治疗专场回放:
https://doctor.liangyihui.net/#/doc/113808

本文仅供健康科普使用,不能作为诊断、治疗的依据,请谨慎参阅。











 苏公网安备32059002004080号
苏公网安备32059002004080号


