当肺癌治疗领域还在为“靶向药耐药后怎么办”探索时,HARMONi研究的出炉,像给临床医生递上了一把看似趁手的新钥匙。只是这把“钥匙”亮相时,资本市场先演了出“预期落空”的戏码——股价跌去20%,向FDA递交申请的计划虽箭在弦上,却绕不开“OS未达标”“疗效机制主次难辨”两大核心争议,更恰逢FDA新指南草案强化OS监管,让这场闯关之路更添变数。临床医生们的专业质疑,则让围绕依沃西单抗的讨论多了几分理性审视,正以复杂姿态叩击肺癌治疗的现有格局。
HARMONi研究:PFS破局,但OS差“临门一脚”
先厘清HARMONi研究的核心目标:针对三代EGFR-TKI耐药的晚期非鳞非小细胞肺癌患者,验证“依沃西单抗+化疗”是否比单纯化疗更有效。从结果看,它在“无进展生存期(PFS)”上确实交了满分答卷——联合治疗组患者病情不恶化的时间(mPFS)达6.8个月,对照组仅4.4个月,风险比(HR)0.52,统计学意义显著,相当于给患者多争取了两个多月“无进展”的安稳日子。

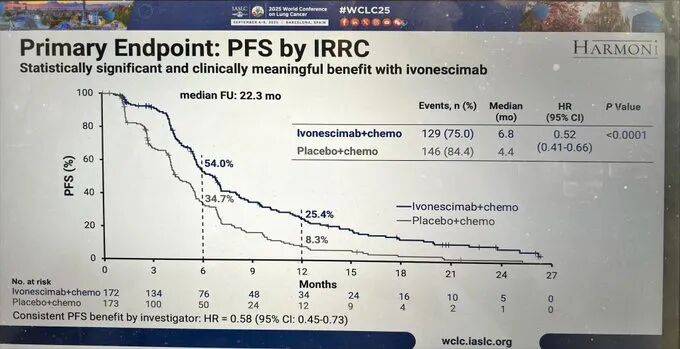
但关键的“总生存期(OS)”,却卡在了“差一点”的尴尬位置。根据最终分析数据,联合治疗组中位OS 16.8个月,对照组14.0个月,HR 0.79,P值0.057——恰好高于预设的统计学显著性标准(P≤0.0448)。这意味着,尽管数据上看联合治疗组生存期数值更长,但从统计学角度,这种差异可能是偶然的,不能认定为“明确的OS获益”。后续对西方患者延长随访后,OS HR微调至0.78(nominal p=0.0332),但“nominal p值”未经过多重检验校正,更像是“事后补充分析”,说服力仍受争议,无法改变“预设OS终点未达”的核心事实。
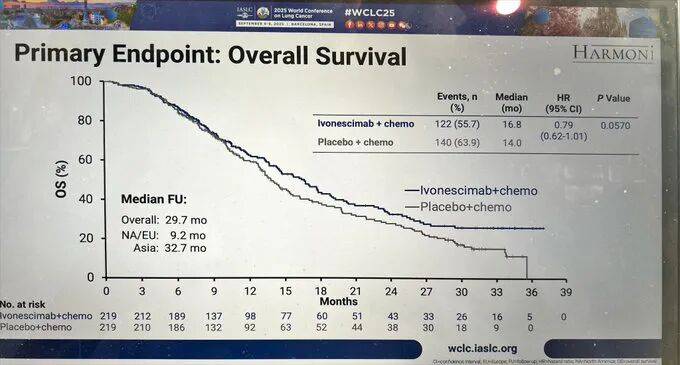
公司在公告中反复强调“OS呈现有利趋势”,试图传递积极信号,但从临床研究的严谨性来看,“趋势”与“明确获益”隔着一道统计学“硬门槛”。对晚期癌症患者而言,“活得更久”是终极目标,若药物仅能延缓病情进展,却无法证明能延长生命,即便PFS亮眼,也会让医生和患者在选择时多一分犹豫——毕竟,“趋势”不能等同于“确定能多活几个月”。
此外,研究中亚洲患者数据与中国此前的HARMONi-A研究高度契合——后者不仅PFS显著,还实现了OS的统计学获益,也正因如此,依沃西单抗联合化疗已在中国获批进医保。但这种“亚洲优势”也带来新疑问:亚洲患者随访长达33个月,西方患者初始仅9.2个月,地域间随访时长的差异,是否放大了部分疗效信号?这为后续全球推广埋下了争议伏笔。
股价跌20%:资本市场不买“趋势”的账
HARMONi研究公布后,相关公司股价跌去20%,看似意外,实则是资本市场对“结果不完美”的直接反馈。毕竟,医药投资中,“达到主要终点”只是基础,“是否超预期”“关键次要终点能否落地”才是股价的催化剂——而OS未达统计学意义,恰好击中了投资者的核心顾虑。
一方面,市场早把期待拉满:不少人盼着依沃西单抗能同时拿下PFS和OS“双终点”,成为“同类最优”,结果OS卡在“趋势”上,未能给出更硬核的生存获益证据,部分投资者便选择“用脚投票”。这就像期待一场考试拿双百,结果一门差1分及格,失落感自然会转化为短期抛压。
另一方面,医药行业本就对“生存获益”格外敏感——对癌症药物而言,OS是衡量价值的“金标准”,若无法证明能延长生命,即便PFS亮眼,也可能影响医生处方偏好和后续市场渗透。投资者正是看到了这层风险,才对短期股价做出调整。当然,从长期看,PFS的明确获益仍为药物保留了临床价值,但资本市场的“耐心”往往跟不上临床研究的“长期验证周期”,这才有了这场“短期波动与长期价值的错位”。
FDA递交计划:撞上OS监管新范式,闯关难度再升级
尽管OS未达终点、机制争议未解,公司仍计划基于HARMONi数据向FDA递交申请——而这步棋,恰好撞上FDA 2025年8月发布的《肿瘤临床试验中总生存期评估方法》指南草案,这份被业内视为“监管风向标的文件”,是否会让本就充满不确定性的审批之路更添挑战?


具体到依沃西单抗的申请,FDA大概率会聚焦三大核心问题:
其一,预设OS终点未达的合理性。指南强调“预设统计方案的严肃性”,HARMONi在primary分析中OS P值0.057高于预设标准,后续西方患者延长随访的nominal p值(0.0332)属于“事后分析”,未纳入初始统计计划,说服力有限。FDA可能会质疑:为何初始设计未充分考虑地域随访差异?这种“补充分析”能否弥补预设终点未达的缺陷?
其二,OS数据是否满足“排除伤害”要求。指南要求即便是安全性评估,也需量化OS风险——HARMONi的OS HR 0.79(95%CI 0.62-1.01),置信区间上限恰好触及1.0,意味着无法完全排除“试验组与对照组生存无差异”的可能,更未达到“排除伤害”的明确证据标准。若FDA严格按指南执行,可能会要求补充更多数据以验证OS安全性。
其三,与加速批准路径的适配性。指南虽提及“未满足医疗需求领域可通过替代终点获加速批准”,但前提是“OS数据存在不确定性时,需后续确证OS获益”。对依沃西单抗而言,EGFR-TKI耐药后治疗确实是未满足需求,但FDA可能会要求公司承诺更严格的上市后随访计划,确保后续能提供OS确证数据——这不仅会延长完全批准的周期,也会增加研发成本与不确定性。
更关键的是,指南明确反对“用亚组分析挽救总体失败的试验”。公司若试图以“亚洲人群OS获益”“北美人群OS趋势”作为补充论据,大概率会被FDA驳回——毕竟,指南强调“ITT人群结果是核心,亚组仅作参考,不能改变总体结论”。而医生群体对“疗效仅来自VEGF抑制”的质疑,也可能被FDA纳入风险-获益评估:若药物的核心价值与传统VEGFi重叠,却额外增加了免疫相关不良反应,其“风险-获益比”是否值得认可?
可以说,这场FDA闯关,已从“证明疗效”升级为“在新监管框架下证明安全性与合理性”。公司需要同时回应“OS未达终点的原因”“如何符合指南的伤害排除要求”“机制争议是否影响临床价值”三大难题,每一步都需精准踩中监管要点,难度远超以往。
医生质疑:获益是否仅来自VEGF?PD-1抑制成“鸡肋”?
在HARMONi研究的讨论中,临床医生的观点尤为关键——他们的质疑,直指药物疗效机制的“核心矛盾”:依沃西单抗的获益,是不是只来自VEGF抑制,而PD-1抑制根本没发挥作用?
首先,从PFS数据看,依沃西单抗带来的获益,与既往VEGF抑制剂(VEGFi)研究高度相似。比如,贝伐珠单抗联合化疗用于类似患者时,也能将PFS从4个月左右延长至6-7个月,HR多在0.5-0.6区间——依沃西单抗的PFS HR 0.52,并未超出这一范围,更像是“重复了VEGFi的已知获益”,而非“PD-1+VEGF双靶点协同带来的突破”。
其次,研究中缺乏PD-1抑制起效的“关键证据”:没有看到免疫治疗典型的“生存长尾效应”(即部分患者长期获益),PD-L1表达水平与疗效也无关联——通常来说,PD-1抑制剂的疗效会与PD-L1表达正相关,而依沃西单抗未呈现这一特征,间接说明PD-1通路可能未被有效激活。
更值得关注的是,药物虽带来了额外的免疫相关不良反应(irAEs),但这些不良反应似乎“毫无必要”。研究显示,依沃西单抗组3级以上irAEs发生率约6%,虽不算高,但对比传统VEGFi方案(几乎无irAEs),这些风险并未换来对应的“免疫疗效增量”——相当于“花了额外的风险成本,却没拿到额外的收益”,这让不少医生质疑:PD-1抑制这一靶点,是不是成了“多余的设计”?
正如埃默里大学Ramalingam博士等专家的观点:“依沃西单抗在EGFR突变肺癌中的表现,更像是VEGFi的延续,而非双靶点的创新。”对临床医生而言,若药物的核心价值只是抗血管生成,那在处方时,就会更倾向于选择“已知安全、机制明确”的传统VEGFi,而非“带着PD-1抑制标签、却无免疫获益”的双抗——毕竟,额外的irAEs对患者而言,也是一种潜在负担。

临床格局:突破之外,仍需理性看待
不可否认,HARMONi研究为三代EGFR-TKI耐药患者提供了新的治疗选择——单纯化疗时代,患者的PFS往往不足5个月,依沃西单抗的加入,确实把这一时间显著延长,这对改善患者生活质量、延缓病情恶化有明确意义,尤其在中国,药物已获批进医保,患者能实实在在享受到这一进步。
但争议也需正视:其一,OS未达终点,限制了药物的“天花板”——它或许能成为“有效选项”,却难成“金标准”;其二,机制争议削弱了“差异化优势”——若PD-1抑制未发挥作用,那它与传统VEGFi的竞争,就只剩“给药便利性”(双抗可能减少用药次数),而非“疗效突破”;其三,生物标志物缺失——目前无法精准筛选“最可能获益的患者”,可能导致部分患者用药后效果不佳,造成医疗资源浪费。
这些争议并非否定HARMONi的价值,而是提醒我们:肺癌治疗的进步从不是“一蹴而就”,一款药物的定位,需要在“明确获益”与“潜在风险”、“短期改善”与“长期生存”、“机制创新”与“临床实际需求”间找到平衡。依沃西单抗或许不是“完美答案”,但它打开了新的探索方向——无论是后续验证PD-1抑制的真实价值,还是寻找能预测疗效的生物标志物,都能推动肺癌治疗向更精准的方向迈进。
康方的一小步,出海的一大步?
从HARMONi研究的PFS破局,到OS的争议、机制的疑问,再到股价波动与FDA新监管框架下的闯关未知,这款药物的每一步,都折射出医药研发的复杂与艰难。它有突破的光芒,也有明显的短板,但正是这些“不完美”,推动着医学不断向前。
未来,它能否在全球市场站稳脚跟,能否真正改变临床实践?是对夏总的考验,也是对biotech制药出海的考验和学习。还需时间与更多数据给出答案——而这个过程,本身就是医药进步的必经之路。...













 苏公网安备32059002004080号
苏公网安备32059002004080号


