神经内分泌肿瘤是近年来在我国逐渐受到高度关注的一类肿瘤疾病。回顾过去15年的发展历程,神经内分泌肿瘤专业医师队伍不断壮大,多学科协作的诊疗模式日趋成熟,公众对该疾病的认知水平也持续提升。这一系列变化不仅推动了相关诊疗实践的不断规范化,也促使越来越多的医学专家开始关注这一曾被视为“罕见”的小瘤种。
值得指出的是,从目前的流行病学数据来看,若将全身范围内的神经内分泌肿瘤合并统计,其整体发病率已逐渐超出传统“罕见病”的界定范畴,更倾向于被归为“少见病”。这一趋势也意味着,该类疾病的临床价值和研究意义正在不断凸显,相关领域的基础研究、临床探索和药物研发正迎来新的发展机遇。
本文通过三例具有代表性的神经内分泌肿瘤病例,结合其诊断过程、治疗策略及预后情况进行分析,旨在为该类疾病的临床治疗提供可借鉴的经验,也为进一步推动该领域的规范化管理与个体化治疗提供实践参考。
病例一
病例汇报:
李蓉教授 云南省肿瘤医院
病例点评:
王福龙教授 中山大学附属肿瘤医院
王双佳教授 厦门大学附属第一医院
中华结直肠癌MDT联盟云南分盟昆明分会委员
云南省肿瘤医院结直肠癌MDT青年团队成员
云南省预防医学会胰腺癌防治专业委员会委员
云南省抗癌协会肿瘤临床化疗专业委员会秘书
云南省戒烟联盟委员
获得全国人工肝治疗专业上岗资质
主持省级科研项目2项,厅级项目1项,教学项目1项
参与国家自然科学基金等科研项目12项
第一作者/共一发表论文9篇,其中SCI 5篇,北大核心1篇,参编指南1部,参编专著1部
参与获得2019年度云南省卫生科技成果奖三等奖(6/11)
患者基本情况
一般资料:男,50岁。
主诉:
体重下降1年余,发现肝肿物1月。
查体:无异常。
穿刺病理:考虑恶性肿瘤。
免疫组化结果:Ki-67(热点区,+,5%),syn (+),cgA (+),SSTR2(+)。<“肝脏肿块”>结合HE及免疫组化结果,为神经内分泌肿瘤,G2,请临床先排除转移后再考虑原发。
首次入院CT评估:影像所见:肝脏多发低密度结节、肿块,大者长径约4.8cm(S5),边界大致清楚,部分融合,胰腺平扫大小、形态及密度正常;诊断意见:1、肝脏多发结节、肿块,多考虑恶性,神经内分泌性肿瘤可能,转移与原发待鉴别。
首次入院MRI评估:影像所见:肝实质多发结节、肿块影,较大者位于S2,大小约4.4cmx3.8cm,胰腺、脾脏平扫大小、形态及信号正常,增强后未见异常强化灶。平扫及增强上腹腹膜后淋巴结显示,短径小于1.0cm,强化尚均匀。诊断意见:1、肝脏多发结节、肿块,性质恶性,建议完善检查首先排除转移瘤再考虑原发,神经内分泌肿瘤?2、上腹腹膜后淋巴结显示,右上腹及脾门区血管增多、迂曲。3、胃窦壁稍增厚,请结合内镜。
首次评估及治疗:患者为肝脏神经内分泌肿瘤,G2诊断明确,微创介入科评估后示:可行经肝动脉介入栓塞治疗;SSTR-2表达阳性,依据神经内分泌瘤诊疗指南,建议行“奥曲肽微球”全身内分泌治疗。MDT评估治疗目标:姑息治疗,以内科为主,联合介入治疗。
诊疗经过
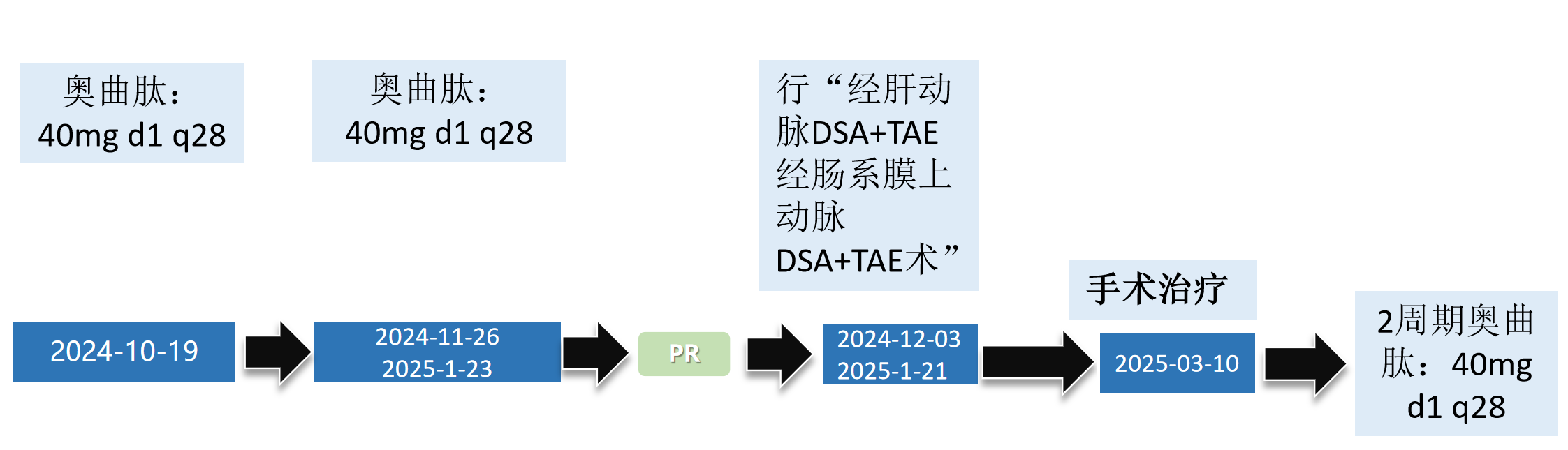
患者于2024-09-02第1次行“经肝动脉DSA+TAE经肠系膜上动脉DSA术”,手术经过顺利,术后予保肝等对症支持治疗,评估病情后有奥曲肽治疗指征,于2024-09-03行“奥曲肽”治疗:奥曲肽微球:40mg d1 q4w,治疗期间予抑酸护胃、保肝等处理。1周期内分泌治疗后复查(2024-10-12)示:1、肝脏多发结节、肿块,部分较前缩小,建议结合临床复查。2、胰尾部结节,建议结合MRI或复查。胃周静脉曲张,腹主动脉壁多发钙斑,上中腹膜后未见肿大淋巴结。由于治疗有效,患者于2024-10-16行第2次“经肝动脉DSA+TAE,经肠系膜上动脉DSA+TAE术”,2024-10-19行第2周期“醋酸奥曲肽微球”治疗(醋酸奥曲肽微球40mg d1 Q4W)。
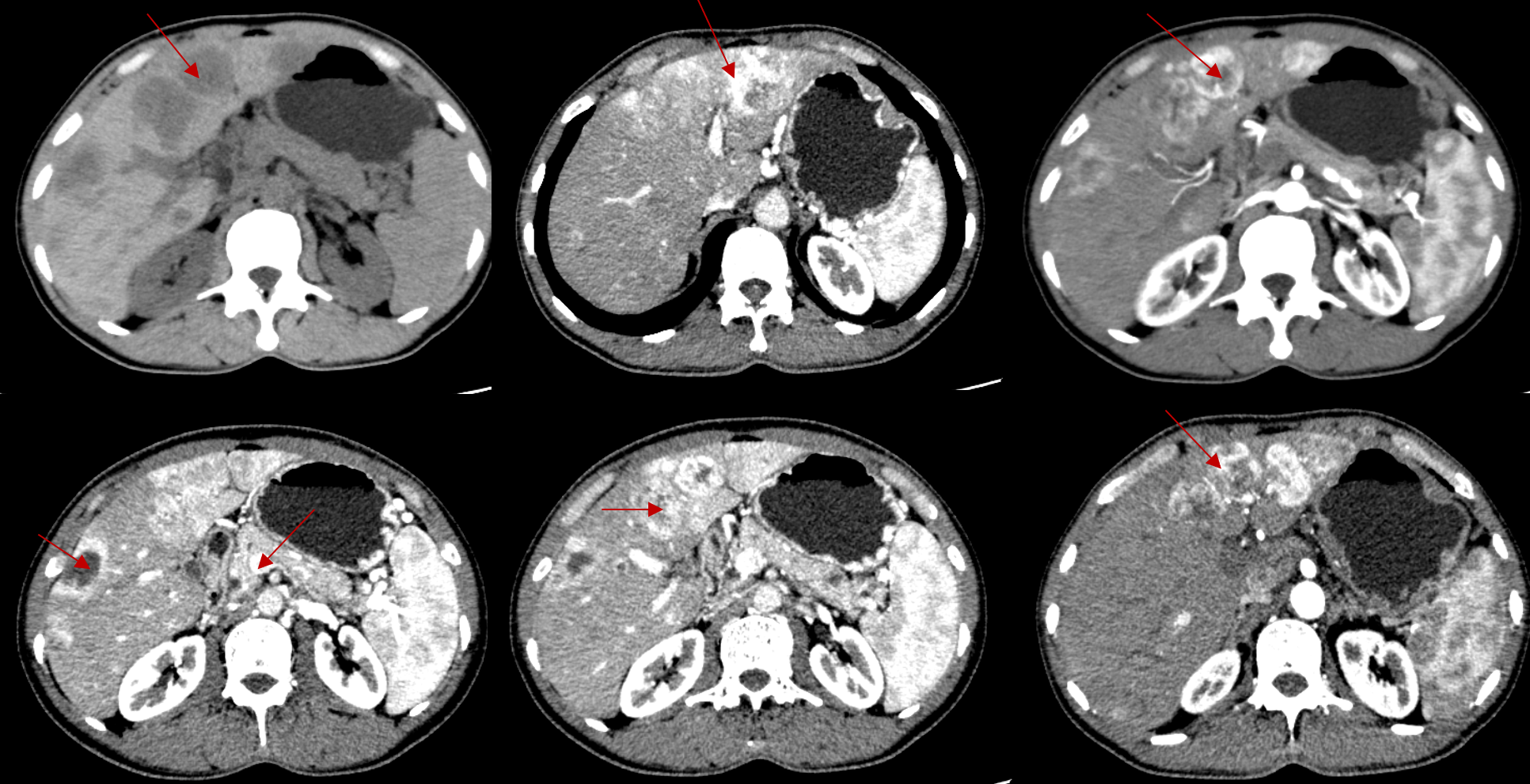
2024-11-04患者于他院行PET-CT(68Ga+18F)检查,结果显示:1. 约胰尾病变可符合神经内分泌肿瘤改变,并伴肝脏多发转移。2. 双肺结节倾向炎性病灶。3. 慢性膀胱炎可能。4. 右上颌窦炎。3周期内分泌治疗后复查(2024-11-29)显示PR。基于此,患者于2024-12-03行第3次“经肝动脉DSA+TAE,经肠系膜上动脉DSA+TAE术”,2024-11-26行第3周期醋酸奥曲肽微球治疗(醋酸奥曲肽微球40mg d1 Q4W)。
2025-01-20上腹部复查显示PR,对比2024-10-12片:1、肝脏多发结节、肿块,部分较前稍缩小(以S2病灶明显),建议结合临床复查。2、胰腺尾部强化欠均,局部脾静脉显示不清。建议结合MRI或复查,上中腹膜后未见肿大淋巴结。MDT再次评估治疗目标:NED,继续奥曲肽微球治疗,备行手术。基于此,患者于2025-01-21行第4次“经肝动脉DSA+TAE,经肠系膜上动脉DSA+TAE术”,2025-01-23行第4周期醋酸奥曲肽微球治疗(醋酸奥曲肽微球 40mg d1 Q4W)
患者于2025-03-10行胰体尾切除,脾切除,肝脏肿瘤射频消融,左肝肿瘤切除,右肝肿瘤切除术。术后病理支持神经内分泌瘤(NET,G2)。患者于2025-4-18、2025-05-19行第4、5周期醋酸奥曲肽微球治疗(醋酸奥曲肽微球30mg d1 Q4W)。
病例小结
患者最初在外院检查时发现肝脏存在多发肿物,当时初步考虑为肝脏原发肿瘤,遂建议行TACE治疗。随后患者辗转至我院进一步评估,经穿刺活检明确诊断为肝脏神经内分泌肿瘤,分级为G2,Ki-67指数为5%,SSTR2阳性。经MDT讨论后,确定以延长生存期为目标,采取以内科治疗为主、联合介入治疗的综合治疗策略。经过一个周期的治疗后,患者疗效明显,肝转移灶出现缩小甚至减少。在完成三个周期治疗后,疗效评估达到PR水平,故再次提交NET MDT团队讨论,认为患者具备争取NED或接近NED状态的机会,可考虑减瘤性手术。在充分与患者及家属沟通后,患者选择前往就近医院接受手术治疗。术后尚未进行复查。患者目前一般情况良好,复查已预约在他院进行,后续检查资料将反馈至我院,以进一步评估并制定下一步治疗计划。目前患者术后已完成两个周期奥曲肽微球治疗,后续管理将根据复查结果进行个体化调整。
病例二
病例汇报:
何朝滨教授 中山大学附属肿瘤医院
病例点评:
施承民教授 昆明医科大学第一附属医院
张雅雅教授 厦门大学附属第一医院
医学博士、博士后、助理研究员
新加坡国立大学医学院,美国MD Anderson CancerCenter交流学者
中国CSCO第七届35under35优秀青年肿瘤医生
中国抗癌协会胰腺癌/胆囊癌/肝癌指南认证专家
2022年广东省科学技术奖青年科技创新奖提名者
主持国家自然科学基金、广东省自然科学基金、广东省基础与应用基础研究基金、广州市科技计划项目和中山大学医学人文调研基金等多项课题,参与国家重点研发计划、国家自然科学基金等多项重大科研项目
中国胰腺病学会会员
中国抗癌协会胰腺癌专业委员会会员
中国抗癌协会肿瘤胰腺病学专业委员会会员
中国抗癌协会胆道肿瘤专业委员会会员
中国抗癌协会神经内分泌肿瘤专业委员会会员
广东省健康管理学会胰腺疾病专业委员会委员
广东省抗癌协会胰腺癌专业委员会青年委员会委员
第一作者在Annals of Oncology,CancerCommunications,Clinical andTranslational Medicine, CancerLetters, Oncoimmunology等SCI杂志发表论文50余篇,累积影响因子300,担任多本SCI杂志编委及审稿专家
ESMO Asia Merit Award,GAPMerit Award,FACO Travel grant获得者
多次受邀在国际胰腺病学会大会(IAP2022)、亚洲肿瘤学联盟大会(FACO 2023)、美国MD Anderson CancerCenter全球学术计划年会(GAP2019、GAP2020)、全国胰腺疾病学术研讨会、中国肿瘤学大会(CCO 2020)、香港Cancer2025等国内外著名学术会议上口头报告
患者基本情况
一般资料:男,35岁。
主诉:
检查发现胰腺和肝脏占位1月余。
现病史:
患者1月前因车祸伤在当地医院行CT检查提示胰腺尾部肿块,考虑胰腺癌。肝脏多发低密度占位病变及腹腔多发淋巴结增大。患者无明显腹痛,全身皮肤无巩膜黄染。发病以来患者一般情况可,体重无明显消瘦,为求进一步治疗来我院就诊。
既往史:
否认传染性疾病史;否认高血压、冠心病、糖尿病病史,否认输血史。
个人史:
抽烟2年,无饮酒史,否认食生鱼史。
家族史:
其父亲患有胆管肿瘤,可疑神经内分泌肿瘤。
辅助检查:
2023-12-22 CT检查示:胰腺尾部肿块,考虑胰腺癌:肿块接触脾动脉及胃体小弯侧,侵犯并堵塞脾静脉,周围侧枝循环形成,脾静脉内癌栓接近肠系膜静脉根部血管腔。胰腺肿块周围多发淋巴结转移瘤,肝脏多个转移瘤。2024-1-5我院超声造影:肝内多发实性稍高回声灶,考虑肝M可能性大。肿瘤标志物:CA19-9 (-)、CEA (-)、CA12-5 (-)。2024-1-30胸部、上腹部CT示:1. 胰尾部肿物、胰头结节,考虑胰腺恶性肿瘤可能性大,神经内分泌癌?2. 门脉主干、脾静脉充盈缺损,考虑癌栓可能。胰周数个淋巴结,考虑转移可能性大。肝内多发肿物、结节,考虑转移瘤可能性大。
2024-1-5我院超声引导下行肝S4肿物穿刺活检,病理诊断:肝脏穿刺组织中细胞呈巢片状,菊形团样成腺样排列,形态符合肿瘤,需鉴别原发与转移。补充诊断:病变诊断为神经内分泌肿瘤,符合为神经内分泌瘤(G2),分裂象可见(3个/10HPF),未见明确坏死。免疫组化:CD56(+),Syn(+),CgA(+),Ki-67(5%+),CK(AE1/A E3) (+),CK7(-),HepPar-1(少量+),Arginase-1(-),Glypican-3(-)。
诊断:
胰腺神经内分泌肿瘤肝转移。疾病特点:1、胰尾病灶59×63mm,胰头病灶6×8mm(胰腺双原发病灶);2、胰腺pNET肝转移,门静脉-脾静脉交汇处癌栓(肿瘤负荷较大)。
诊疗经过
新辅助治疗
患者于2024-1-31首次接受肝内病灶动脉微球栓塞术(TACE),术后予以长效生长抑素联合化疗方案(卡培他滨 + 替莫唑胺)治疗。2024-3-20行第二次肝内病灶动脉微球栓塞术,术后继续给予长效生长抑素联合化疗(卡培他滨 + 替莫唑胺)治疗。
CT复查疗效评价:胰尾部肿物、胰头结节,符合神经内分泌瘤,较前稍缩小。门脉主干、脾静脉充盈缺损,考虑癌栓,较前变化不大。胰周数个淋巴结,考虑转移可能性大,较前变化不大。肝内多发肿物、结节,考虑转移瘤,较前缩小。PET-CT复查示:胰尾部肿物葡萄糖代谢略活跃,生长抑素受体显像强阳性。胰头结节葡萄糖代谢未见明显异常,生长抑素受体显像阳性。胰周多发淋巴结葡萄糖代谢略活跃,生长抑素受体显像强阳性,考虑转移。肝脏多发病灶部分葡萄糖代谢略活跃,生长抑素受体显像强阳性,符合转移瘤。
转化手术
患者于2024-5-17接受胰体尾切除+门静脉切开取栓+肝转移瘤切除+肝肿物微波消融+门静脉修补+脾切除术+胆囊切除。病理诊断示,胰尾肿物:神经内分泌肿瘤(G2),核分裂像3个2平方毫米,可见脉管内瘤栓;肝肿物:肝S3和S5肿物可见神经内分泌肿瘤,G2;脾静脉癌栓:镜下见神经内分泌肿瘤组织,G2;胰周淋巴结:LN8(-),LN9(-),LN10(-),LN11(-),LN12(+),LN13(+);免疫组化:EMA(局灶+),CD56(+),Syn (+),CgA(+),Ki-67(5%+),SSTR2(局部+), CK7(-),CK19(局部 +),CK20(局灶+),CDX2(-),Villin(少量+),Muc-5AC(-),Muc-1(局灶+)。
辅助治疗
基于患者胰头病灶仍存在,葡萄糖代谢未见明显异常,生长抑素受体显像阳性;68-Ga PET-CT显示胰头结节生长抑素受体显像阳性,于是患者接受术后长效生长抑素维持治疗。术后CT复查(2024-11)示:胰体尾部术后缺如,原术区积液、积气,积液较前减少。肝脏术后部分缺如,术区残腔形成,范围较前缩小。残肝内多发片状低密度灶,考虑消融术后改变。目前最新复查结果显示,患者整体病情稳定,仍处于“无明显进展’的状态。虽然胰头部仍可见一个小病灶,但该病灶自初次发现以来未见明显变化,形态稳定。患者目前正在规律接受长效生长抑素治疗。
病例小结
患者因车祸查体发现胰尾部肿块,合并肝脏多发占位及门静脉癌栓。经我院肝穿活检及免疫组化确诊为胰腺神经内分泌瘤(G2,Ki-67 5%)肝转移。治疗策略以转化治疗为目标,先后行两次肝内TACE,联合长效生长抑素与卡培他滨+替莫唑胺化疗,影像复查提示肿瘤缩小、代谢活性下降,达手术指征。2024年5月完成胰体尾切除+门静脉取栓+肝转移瘤切除+微波消融+脾切除等多脏器联合手术,术后病理确认为NET G2,部分淋巴结阳性。术后继续给予长效生长抑素维持治疗,最新复查提示病情稳定,残余胰头小灶未见进展。本例通过多学科合作,实现高负荷晚期pNET的成功转化,为类似患者的个体化综合治疗提供了有益参考。
病例三
病例汇报:
邱钧教授 厦门弘爱医院
病例点评:
李聪教授 中山大学附属肿瘤医院
邓俊教授 昆明医科大学第一附属医院
福建省医院协会肿瘤多学科诊治专业管理分会委员
福建省肿瘤防治联盟结直肠癌专业委员会常务委员
福建省肿瘤防治联盟胃癌专业委员会委员
福建省抗癌协会神经内分泌肿瘤学组委员
福建省抗癌协会肿瘤营养与支持专业委员会青年委员
福建省抗癌协会癌症康复与姑息专业委员会青年委员
厦门市中西医结合学会肿瘤学分会常务委员
厦门市医学会疼痛学分会委员
厦门市医师协会肿瘤医师分会青年委员会胃肠学组副组长
厦门市医学会肿瘤分会委员
厦门消化学会神经内分泌肿瘤和激素学组委员
厦门抗癌协会肿瘤营养与支持治疗委员会委员
患者基本情况
一般资料:女,46岁。
主诉:
反复上腹部闷痛6月余。
现病史:
2018年11月中旬因“反复上腹部闷痛6月余,发现胰腺、肝脏占位1月余”就诊我院肝胆外科,无发热、腹泻、颜面潮红等不适。
查体:
ECOG评分:1分。血压116/76 mmHg,神清,气平,浅表淋巴结未触及。心肺听诊未闻及异常,腹平软,未触及包块,肝脾肋下未扪及,右侧中上腹轻度压痛、无反跳痛。腹部移动性浊音阴性,肠鸣音正常,5次/分。
辅助检查:
肿瘤标志物未见明显异常。2018-9-30 CT平扫+增强:胰体尾部混杂中等血供占位累及脾动、静脉,伴有膈角肿大淋巴结,左肾上腺占位。2018-10-11 MRCP:胰体尾部混杂信号占位伴肝多发转移瘤,右膈角淋巴结转移瘤。免疫组化结果:CK(+),HEP(-),GS-6(-),GYP-3(-),CK19(+),CA19-9(-),SY(+),CgA(+),Ki-67(10%+),CD56(旁+),CD10(-),B-catanin(浆+),PR(-),vimentin(-),AAT(-)。肝脏肿瘤穿刺活检病理提示神经内分泌肿瘤(NET G2)。
诊断:
胰腺占位→神经内分泌肿瘤非功能性可能大;肝多发转移→神经内分泌肿瘤 G2;主动脉旁、腹膜后、双肺门、右锁骨多发淋巴结转移可能;左肾上腺占位→转移可能大。
诊疗经过
患者于2018-11接受胰体尾切除术+脾切除术+肝部分切除术+微波消融术。68 Ga PET/CT提示:神经内分泌肿瘤累及双肺门、纵膈、膈脚后、腹膜后淋巴结;肝脏多发累及;左肾上腺累及。术后病理提示患者SSTR-2阳性,因此自2018年12月至2019年8月,患者接受奥曲肽长效微球(30mg im q4w)治疗。2019-3-5 CT增强示:肝转移瘤治疗后未见明显活性,胰腺术区未见肿瘤复发,右膈角淋巴结转移瘤稳定。2019-8-15 68 Ga PET/CT提示:左锁骨新增病灶;双肺门、纵膈、膈脚后、腹膜后淋巴结、肝脏多发、左肾上腺较前进展。
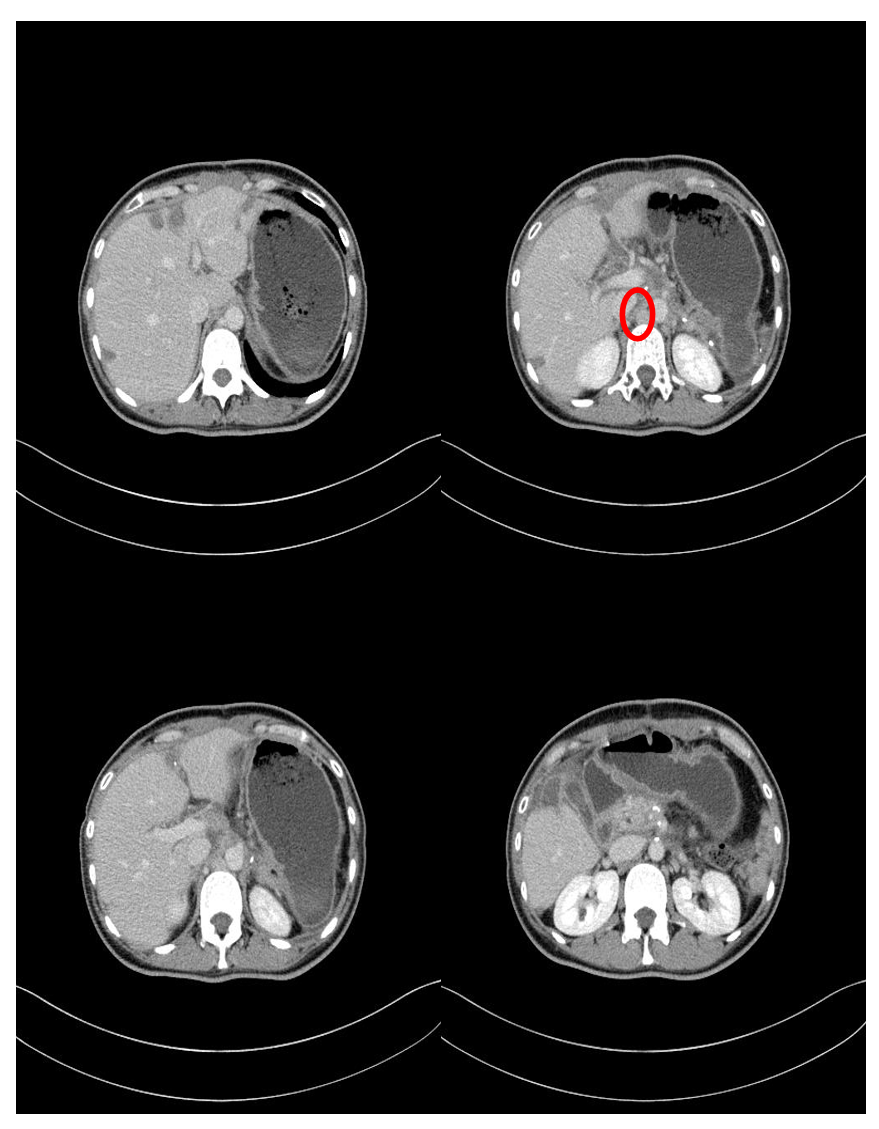
2019年,患者出现疾病进展后,调整治疗方案为奥曲肽(30 mg,q4w)联合CAPTEM方案(卡培他滨+替莫唑胺,q4w)进行姑息化疗。2019年11月1日复查68Ga PET/CT显示,病灶较前明显缩小。2020年3月CT复查显示疾病稳定(SD)。联合奥曲肽和CAPTEM方案治疗持续约1年,至2020年9月患者自行中断治疗,未继续接受奥曲肽维持治疗,也未进行规律复诊。2022年1月,因腹胀及乏力症状加重,患者再次就诊。
患者于2022年1月20日开始接受索凡替尼300 mg每日口服治疗,治疗1个月后腹胀症状明显缓解。2022年4月28日CT复查提示转移灶明显缩小。2022年9月,患者再次自行中断治疗。
2023年4月29日,患者开始接受PRRT试验药物177Lu-DOTATATE。2023年7月17日评估疗效为SD。此后,患者每4个月复查一次,疗效均为SD。末次复查时间为2024年3月,仍为SD。但此后患者再次失访。
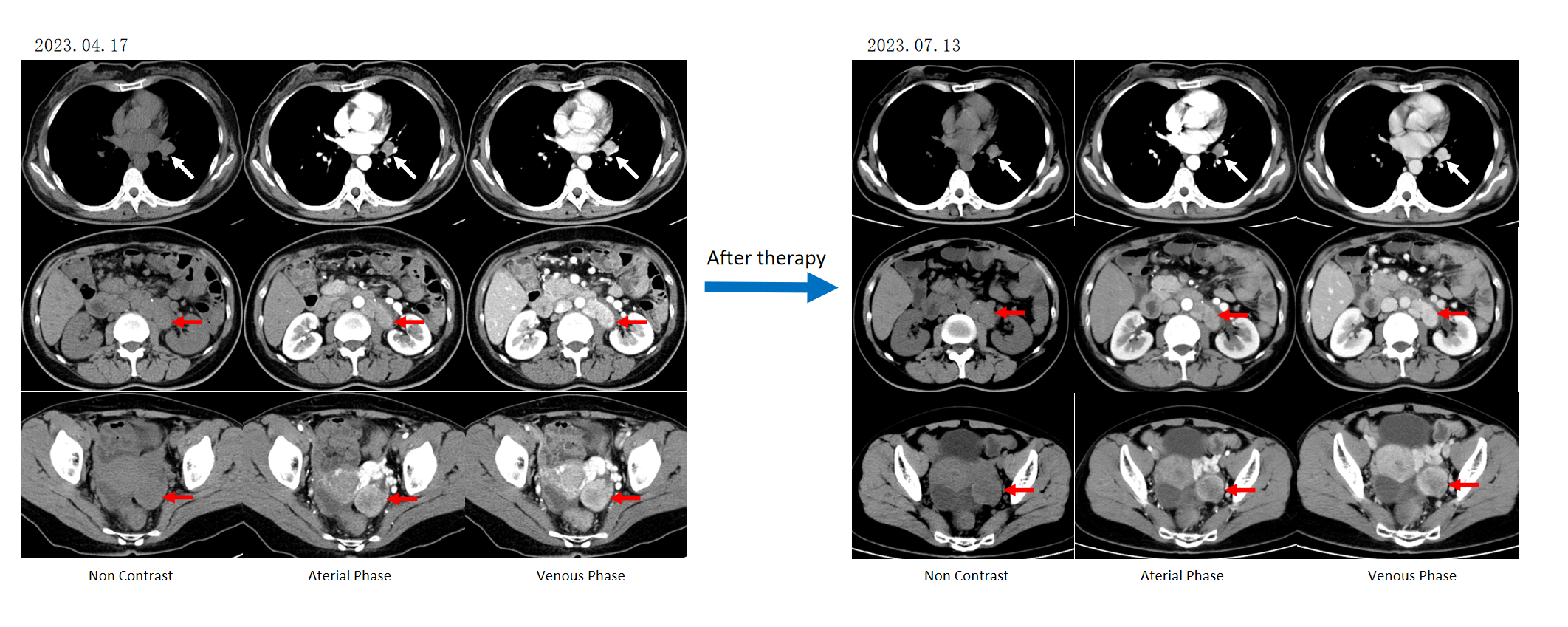
2024年6月,患者因腹胀症状加重再次就诊,复查提示疾病进展(PD),主要表现为盆腔巨大肿块。综合评估后,考虑以盆腔病灶进展为主,建议行姑息性减瘤手术,术后继续抗肿瘤治疗。2024年7月4日,患者接受双侧输卵管卵巢切除术。术后病理提示:左侧卵巢可见神经内分泌肿瘤G2合并局灶腺癌成分,右侧卵巢为神经内分泌肿瘤G2;左侧卵巢腺癌局灶浸润,建议术后随访复查;减瘤术后患者恢复良好,残余病灶与术前相比无明显进展。2024年8月,患者恢复口服索凡替尼300 mg每日一次治疗。
病例小结
患者因反复上腹部闷痛就诊,影像及活检提示胰腺神经内分泌肿瘤(NET G2),伴肝脏、淋巴结及左肾上腺转移。2018年11月行胰体尾切除、脾切除、肝部分切除及微波消融术,术后因SSTR-2阳性,予奥曲肽长效微球治疗。2019年病情进展,调整为奥曲肽联合CAPTEM化疗,疗效稳定至2020年9月患者自行停药。
2022年起因症状加重尝试索凡替尼治疗,效果良好但后中断。2023年入组PRRT试验,给予177Lu-DOTATATE治疗,疗效评估为SD。2024年6月因盆腔巨大病灶进展行双侧输卵管卵巢切除术,病理示双侧卵巢NET G2,左侧伴局灶腺癌成分。术后恢复良好,2024年8月重新启动索凡替尼治疗。目前处于靶向维持治疗阶段,需密切随访。
总结
奥曲肽作为经典的生长抑素类似物,在G1/G2级别神经内分泌肿瘤的治疗中仍处于核心推荐地位,不仅可延缓肿瘤进展、缓解症状,还具有良好的安全性和依从性。在本次分享的病例中,奥曲肽单药或联合CAPTEM方案治疗均取得了阶段性稳定疗效,为后续转化治疗赢得时间和机会。在缺乏更优可替代药物的情况下,其长期使用依然展现出持续稳定的效果。
综上所述,奥曲肽在神经内分泌肿瘤治疗中的关键地位再次在病例中得到印证。结合MDT决策体系,通过科学合理的多模式治疗路径,不仅优化了治疗节奏,也为患者争取到了长期生存的机会,具有重要的临床指导意义。
排版编辑:肿瘤资讯-jyy











 苏公网安备32059002004080号
苏公网安备32059002004080号


