过去50年,胸部肿瘤学发生了巨大的变革。我们从对肺癌生物学机制了解有限、筛查未被证实有效、治疗获益甚微的时代,迈入了分子谱分析、低剂量CT筛查能带来生存获益、治疗选择不断增多的时代。与此同时,支持治疗以及终末期护理相关方法也得到了显著改进。
随着不断取得进展,对于那些刚进入该领域的人来说,了解当前方法的发展历程至关重要。为此,
国际肺癌研究协会(IASLC)总结了过去50年肺癌领域一些重大问题的进展与历程,内容涵盖预防、筛查、分期、诊断、治疗和支持治疗等方面
。以下会对这6个方面进行详细阐述。
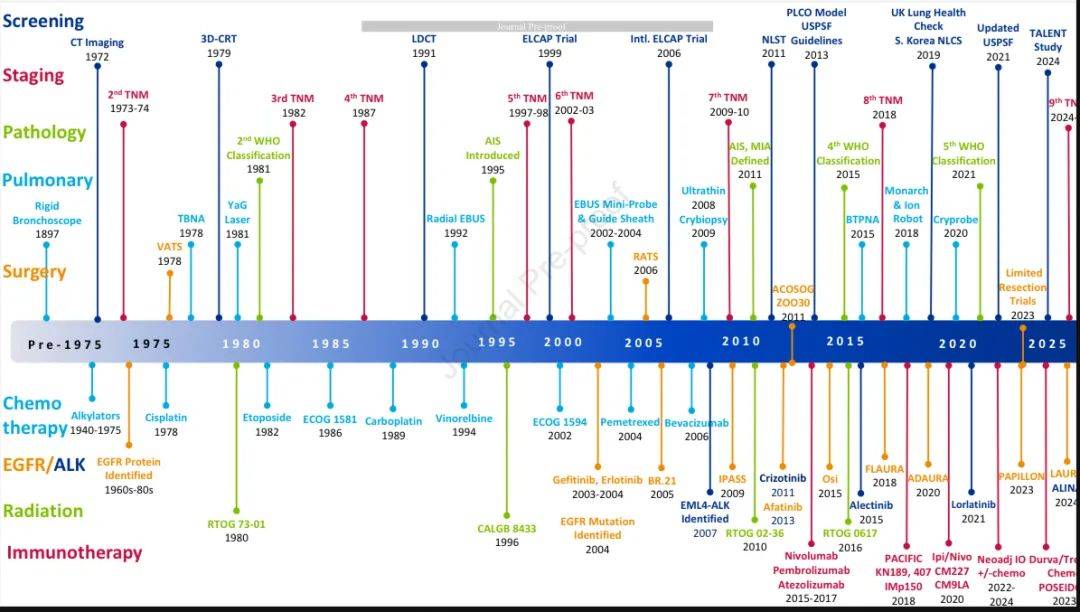
1. 预防
吸烟是肺癌的主要原因 ,也是可预防癌症和非癌症死亡(包括心血管和肺部疾病)的首要原因,尽管1964年美国外科医生就发表了相关声明,但全球目前仍有12.5亿吸烟者。
戒烟措施的建议包括,咨询和药物治疗对戒烟有效。简短建议能显著提高长期戒断率,个人咨询和电话干预有进一步益处,尼古丁替代疗法也能提高戒断率,安非他酮和伐尼克兰也被证实能提高戒烟率,且伐尼克兰效果优于安慰剂、尼古丁贴片和安非他酮,且不会增加神经精神风险。
此外也有其他风险因素,例如氡气是一种天然放射性气体,美国、欧盟等已发布减少氡暴露的指南;英国新数据表明空气污染物(特别是PM2.5)与不吸烟者及EGFR突变NSCLC的发病有关;家族史是筛查 eligibility标准的一部分;石棉是导致肺癌和胸膜间皮瘤的主要环境风险因素,在美国和欧盟已被禁止,但在俄罗斯、中国和非洲等地仍广泛使用。
2. 筛查
筛查有效性是基于 NLST和NELSON两项里程碑式研究 , 低剂量计算机断层扫描(LDCT)筛查对高危人群的肺癌特异性死亡率有显著益处 ,NLST还显示出对全因死亡率的益处,德国LUSI等试验也证明了筛查在更多人群中的价值。
筛查标准:最初的标准存在性别和种族差异,2021年USPSTF更新标准,纳入吸烟量低至20包年、年龄≥50岁的人群,但仍未完全消除差异。有提议进一步完善标准,如去除戒烟持续时间要求等。风险预测模型如PLCOm2012和 Liverpool Lung Check 评分敏感性和特异性更高,但临床应用未统一,其预测能力可能通过生物标志物等增强。在一些亚洲人群中,筛查对不吸烟者也有潜在益处。
偶发肺结节评估如何评估呢?系统性识别和按指南管理偶发肺结节(IPN)可促进肺癌早期检测,一些IPN项目效果优于基于风险的筛查项目。
不断提高筛查可及性,美国合格人群的筛查率在1%-16%,英国等社区筛查项目可达30%。IASLC于2011年成立CT筛查工作组,美国癌症协会等也在持续努力改善筛查的获取和 uptake 等。
3. 分期
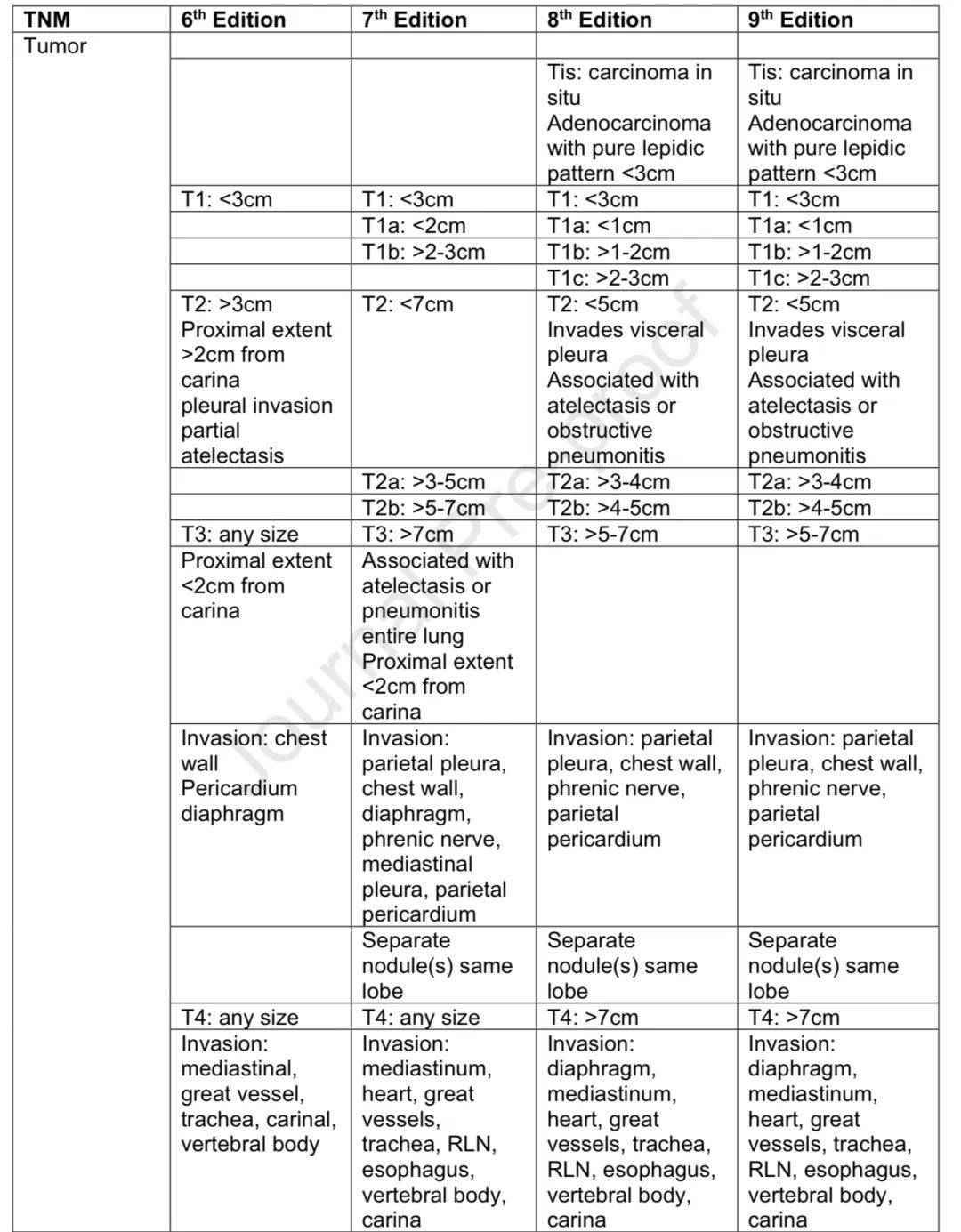
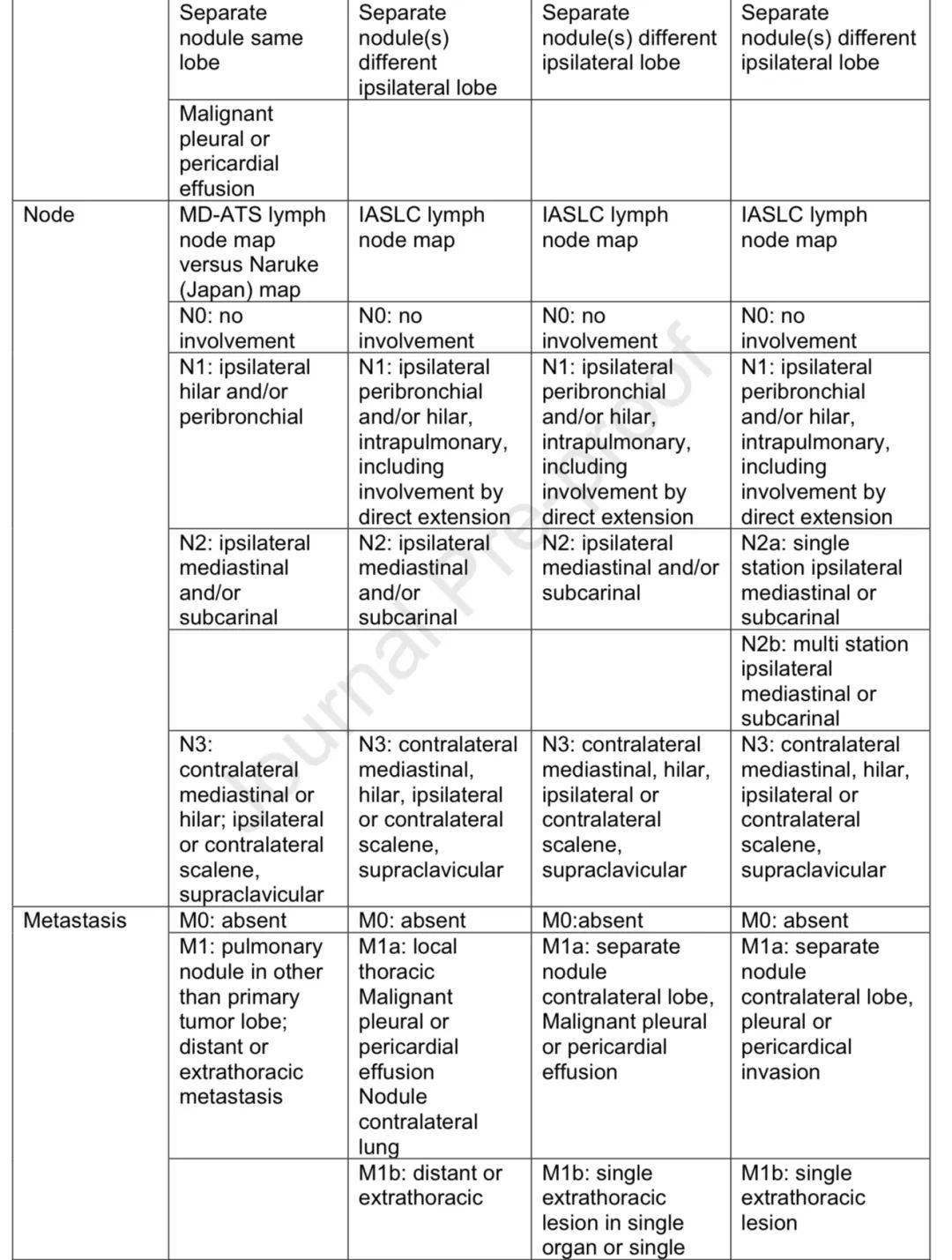
分期起源与发展
1968年肺癌被纳入TNM分期系统,1973年提出第二版分期系统,第2至6版基于美国两个机构的小数据集。IASLC从第6版后负责创建国际数据集,对第7、8、9版分期系统提出建议并获AJCC和UICC批准,且从第8版起负责间皮瘤和胸腺恶性肿瘤的分期。
分期变化
分析更大的IASLC数据集后,肿瘤大小的预后重要性被认识并纳入所有T分类,创建了多个M分类。N分类从第2版的简单分类逐步发展,第9版对N2和M1进行了细分,该分期系统也推荐用于SCLC和肺类癌肿瘤。
临床分期诊断工具演变
CT、MRI和PET扫描成为资源丰富地区常规分期的重要部分。有创纵隔淋巴结分期从纵隔镜发展到微创的EBUS和内镜超声,EBUS与纵隔镜相比非劣效且特异性、敏感性更高,并发症更少。其他有创技术可进入特定淋巴结区域。 2025年第9版TNM分期生效,第10版工作已启动,将基因定义亚组等纳入分期是一个待探索的问题。
淋巴结评估最低标准
ACOSOG Z0030发现对小的外周NSCLC,系统取样与纵隔淋巴结清扫结果相似,但观察性研究表明 病理淋巴结分期质量与生存率改善相关
。IASLC将病理淋巴结评估充分性纳入切除完整性定义,欧美相关机构也尝试定义标准,CoC要求检查≥1个肺门和3个纵隔站等。
分期:IASLC分期版本摘要

4.1 诊断之:肺内科
肺内科关键进展包括气管内镜(EBUS)和机器人支气管镜等微创诊断工具,以及气道梗阻和恶性胸腔积液的治疗程序 。
微创技术对诊断和分期的改善
胸部穿刺(TTNA)诊断准确性67-97%,但有气胸和出血风险,且不适用于纵隔淋巴结评估。柔性支气管镜对周围结节诊断率低,电磁导航支气管镜(EMN)提高了诊断率,近期随机试验显示其与CT引导TTNA诊断率相当但并发症更少。机器人支气管镜平台提高了准确性和诊断率,冷冻活检也有一定应用。
气管内镜(EBUS)在NSCLC分期中的作用
EBUS结合超声和支气管镜,能到达纵隔镜无法到达的区域,诊断准确性90%,是目前主要的纵隔分期工具。
肺干预在缓解肺癌症状中的作用
治疗性支气管镜对中央气道梗阻技术成功率93%,能改善呼吸困难和生活质量;恶性胸腔积液引流可减轻呼吸困难和改善运动耐力,超声引导胸膜干预等方法根据情况推荐使用。
4.2 诊断之:病理学
过去50年间,肺癌的组织学分类发生了重大演变。值得注意的是,2011年国际肺癌研究协会(IASLC)/美国胸科学会/欧洲呼吸学会推出的国际多学科肺腺癌分类,已成为当前肺腺癌分类的基础。肺癌病理分类方面的重大发现包括:对不同组织学亚型的认识、驱动癌基因改变的识别、程序性死亡配体1(PD-L1)表达用于指导免疫治疗,以及新辅助治疗后切除标本的评估。
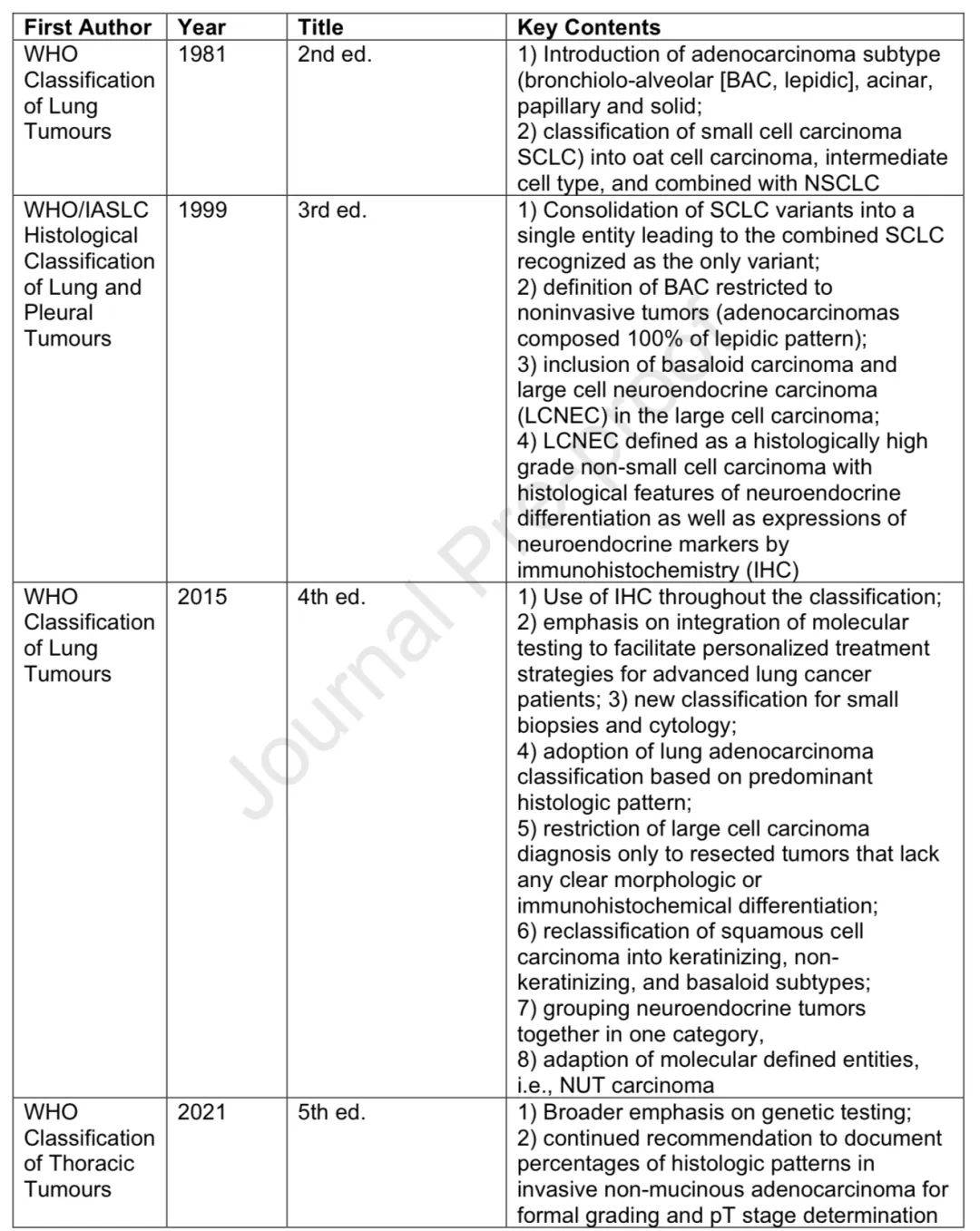
组织学分类演变
过去50年发生重大变化,2011年IASLC/ATS/ERS国际多学科肺腺癌分类成为当前分类基础,主要进展包括不同组织学亚型的认识、驱动癌基因改变的识别、PD-L1表达指导免疫治疗及新辅助治疗后切除标本的评估。
组织学亚型分类和分级
WHO系列肺肿瘤分类专著定义了亚型并根据生物学认识完善分类,最新版本强调整合分子检测。当前分类引入了AIS、MIA等术语,基于主要模式修订腺癌分类,IASLC提出的浸润性非黏液性肺腺癌分级系统被纳入WHO分类。
非小细胞肺癌病理相关的开创性研究
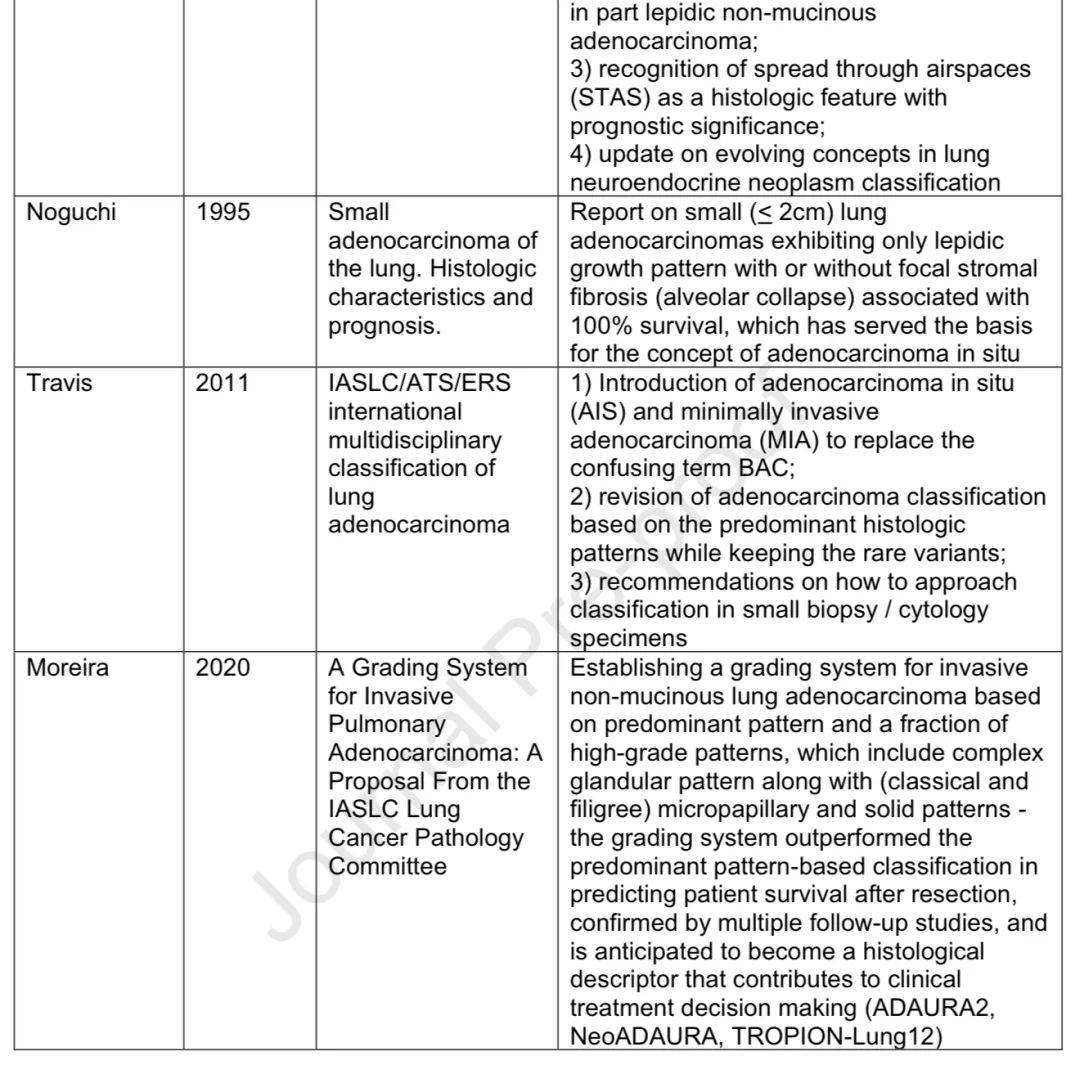
驱动基因改变的识别和分类
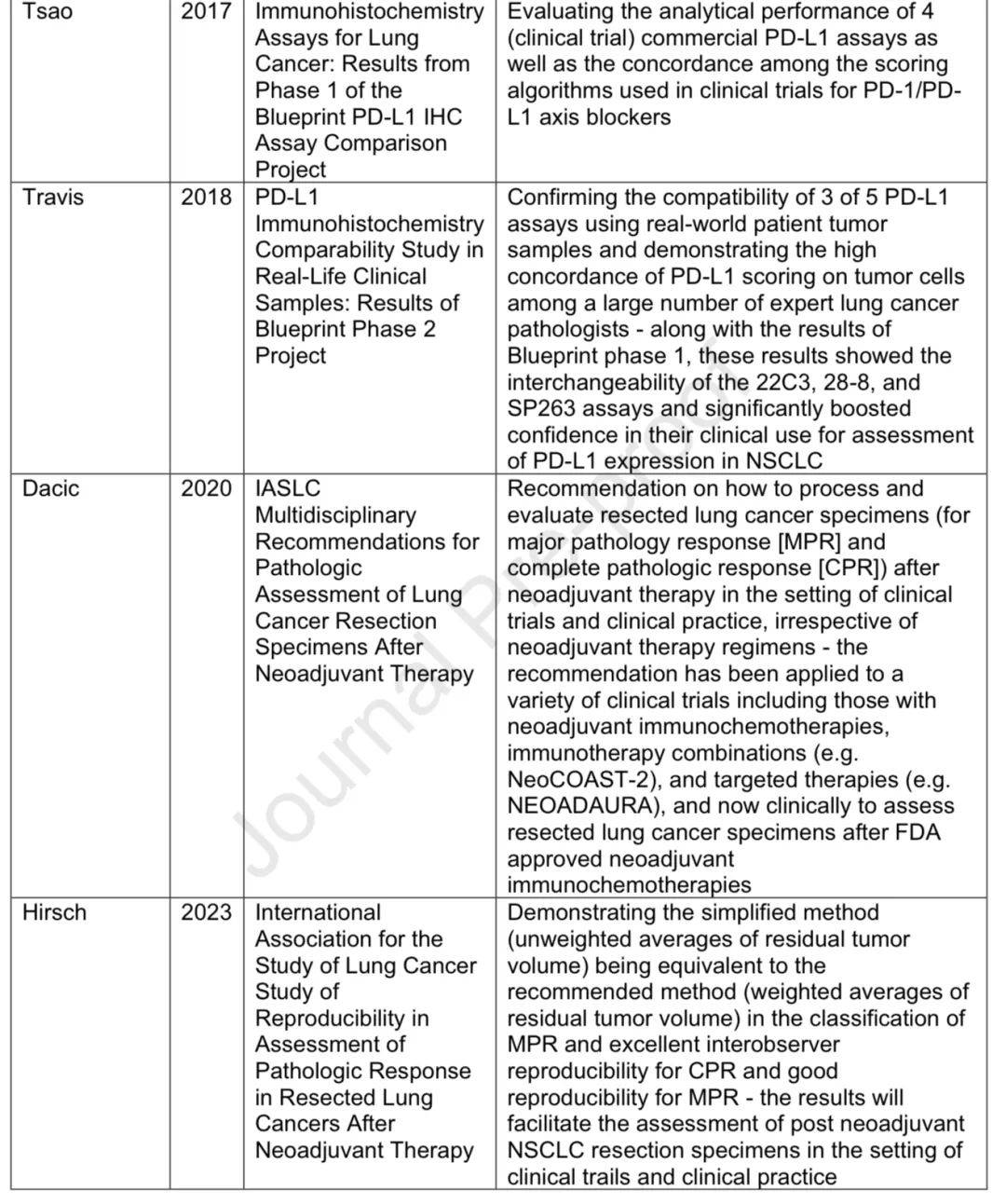
2004年发现EGFR突变与EGFR-TKI临床反应相关,日本团队发现EML4:ALK融合基因,随后ALK靶向治疗获批。EGFR突变被分为敏感突变、exon 20插入突变等。
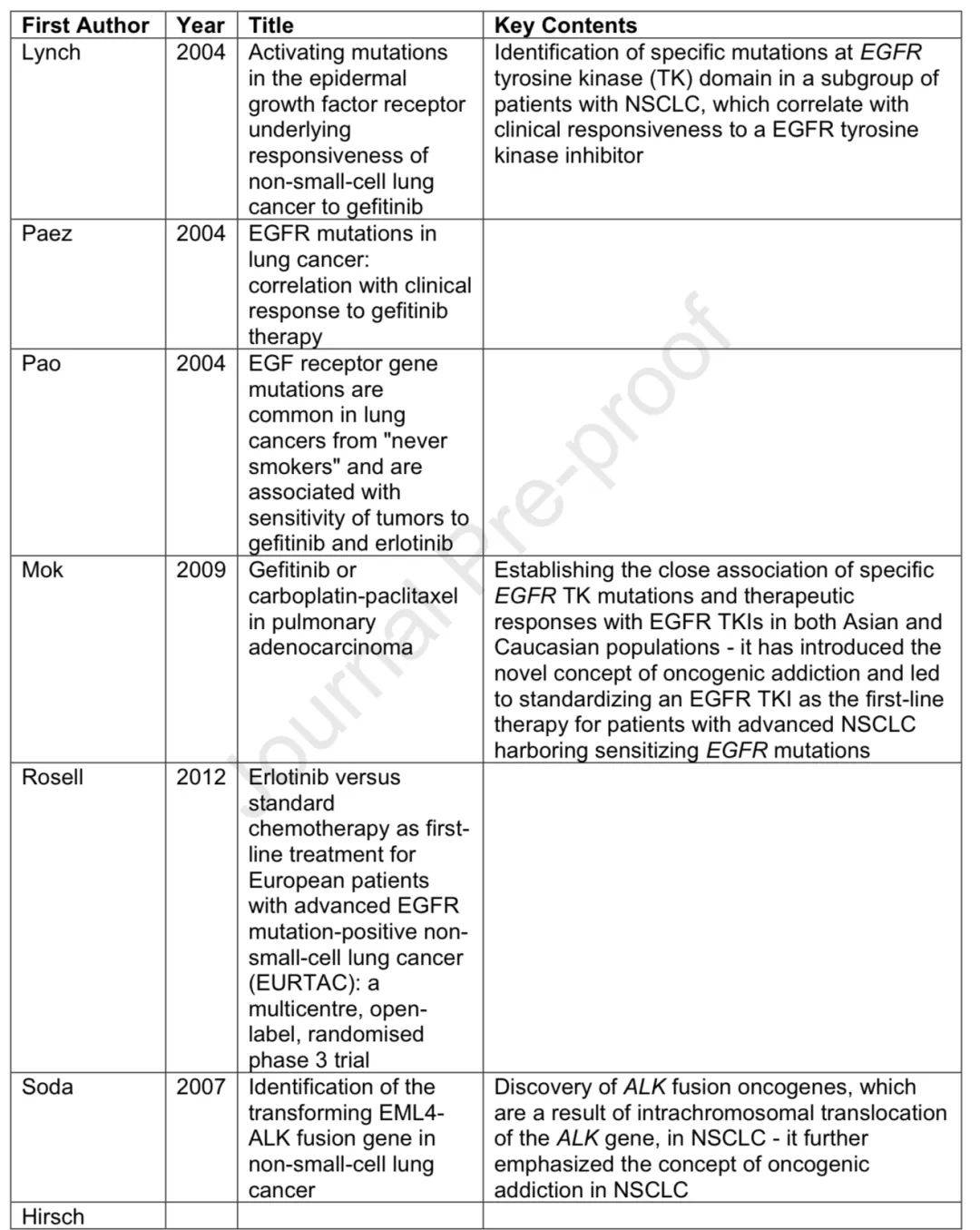
PD-L1免疫组化标准化
Blueprint项目评估了多种PD-L1 IHC检测的一致性,显示22C3、28-8和SP263检测可互换,增强了其临床应用信心。
新辅助治疗后NSCLC切除标本的病理评估标准
近5年多项试验确立了新辅助和围手术期 化免治疗的地位,提出了如IASLC标准和irPRC等病理反应标准,但PVC病理完全缓解或MPR主要病理反应作为OS替代终点尚未验证。
非小细胞肺癌生物标志物发现的开创性研究
5. 1 治疗之:肿瘤放疗
放射治疗和影像学技术的进步,促成了 立体定向消融体部放疗(SABR)等高精度技术的发展,这使得患者可在不到5天的时间内,接受针对小型、无淋巴结转移肺癌的根治性治疗。与此同时, 长疗程分次放疗与化疗、免疫治疗相结合,为局部晚期非小细胞肺癌患者带来了生存获益。
局
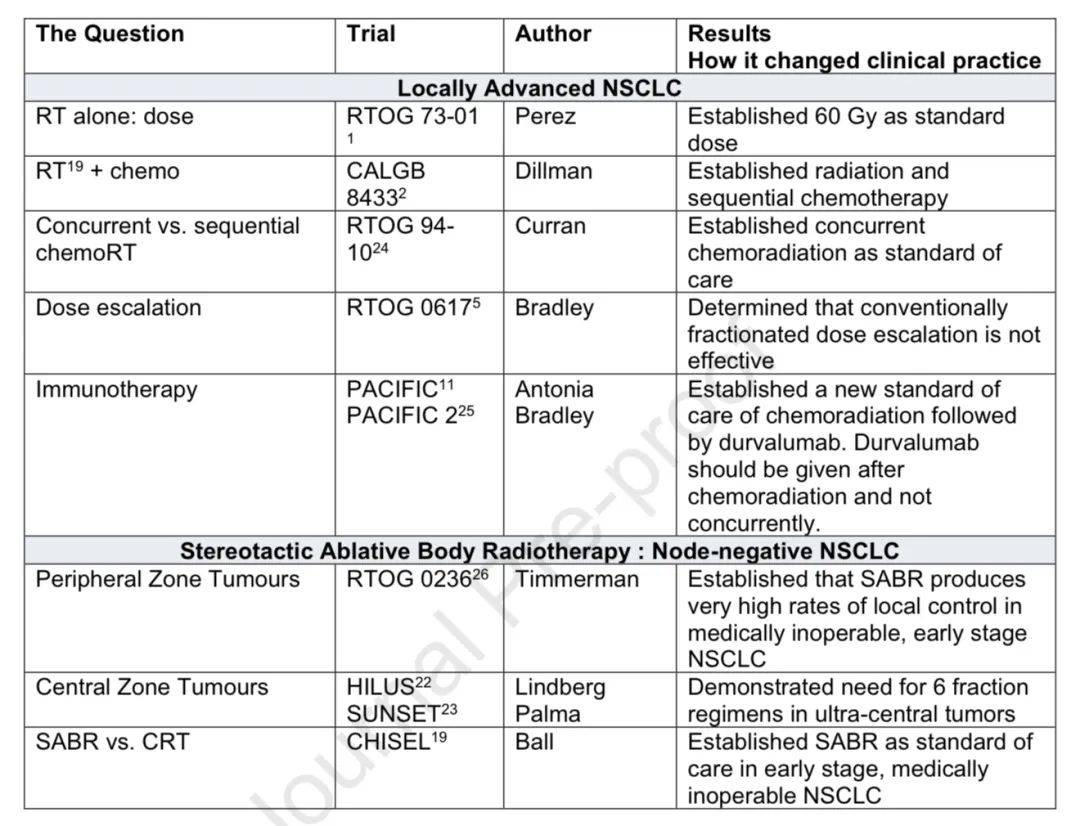
部晚期NSCLC同步放化疗的最佳剂量
1970年代RTOG 7301试验确定60Gy为标准剂量,CALGB 8433试验证明放化疗结合优于单纯放疗,RTOG 9410确立同步放化疗优于序贯放化疗。后续研究探索剂量递增但未获益处,且强调了减少心脏剂量和使用IMRT的重要性。
放疗和放化疗与免疫治疗的联合
PACIFIC研究显示放化疗序贯durvalumab治疗可显著改善生存率,PACIFIC-2研究显示同步使用durvalumab无益处,CM-73L研究显示ipilimumab联合nivolumab作为巩固治疗无益处且肺炎毒性增加。
SABR治愈早期肺癌的潜力及应用
SABR源于1990年代中期的颅内立体定向放疗,CHISEL研究显示其局部控制优于常规放疗,成为早期、淋巴结阴性且不能手术患者的首选治疗。对于靠近纵隔的肿瘤,特定方案可安全使用。
非小细胞肺癌的关键放射肿瘤学研究
5.2 治疗之:外科
在过去50多年里,肺癌切除技术和方法进展较为缓慢。
肺叶切除术与全肺切除术比较
1960年代的研究证实 肺叶切除术与全肺切除术结果相当,成为标准。LCSG 802研究虽在生存方面统计效力不足,但证实肺叶切除术局部复发率更低。
亚肺叶切除术与肺叶切除术比较
近十年JCOG0802和CALGB140503两项随机研究证实, 对于小的I期癌症,亚肺叶切除术与肺叶切除术效果相当,主要用于外周肿瘤。
微创技术效果
1990年代末微创切除术出现,CALGB140503证实其安全性、有效性和可重复性,英国VIOLET试验证实 胸腔镜肺叶切除术与开胸手术相当,且在疼痛、生活质量和成本方面有短期优势。
III期NSCLC的多模式治疗
1990年代研究证实新辅助化疗加切除优于单纯切除,2000年代SWOG 9416证实同步放化疗加切除对肺上沟瘤有效,近5年多项研究探讨了新辅助化疗免疫治疗的作用。
5.3 治疗之:化疗
在晚期NSCLC中的作用尽管靶向药物和免疫治疗发展迅速,细胞毒药物化疗仍是NSCLC治疗的重要部分。
化疗提高晚期NCSLC生存
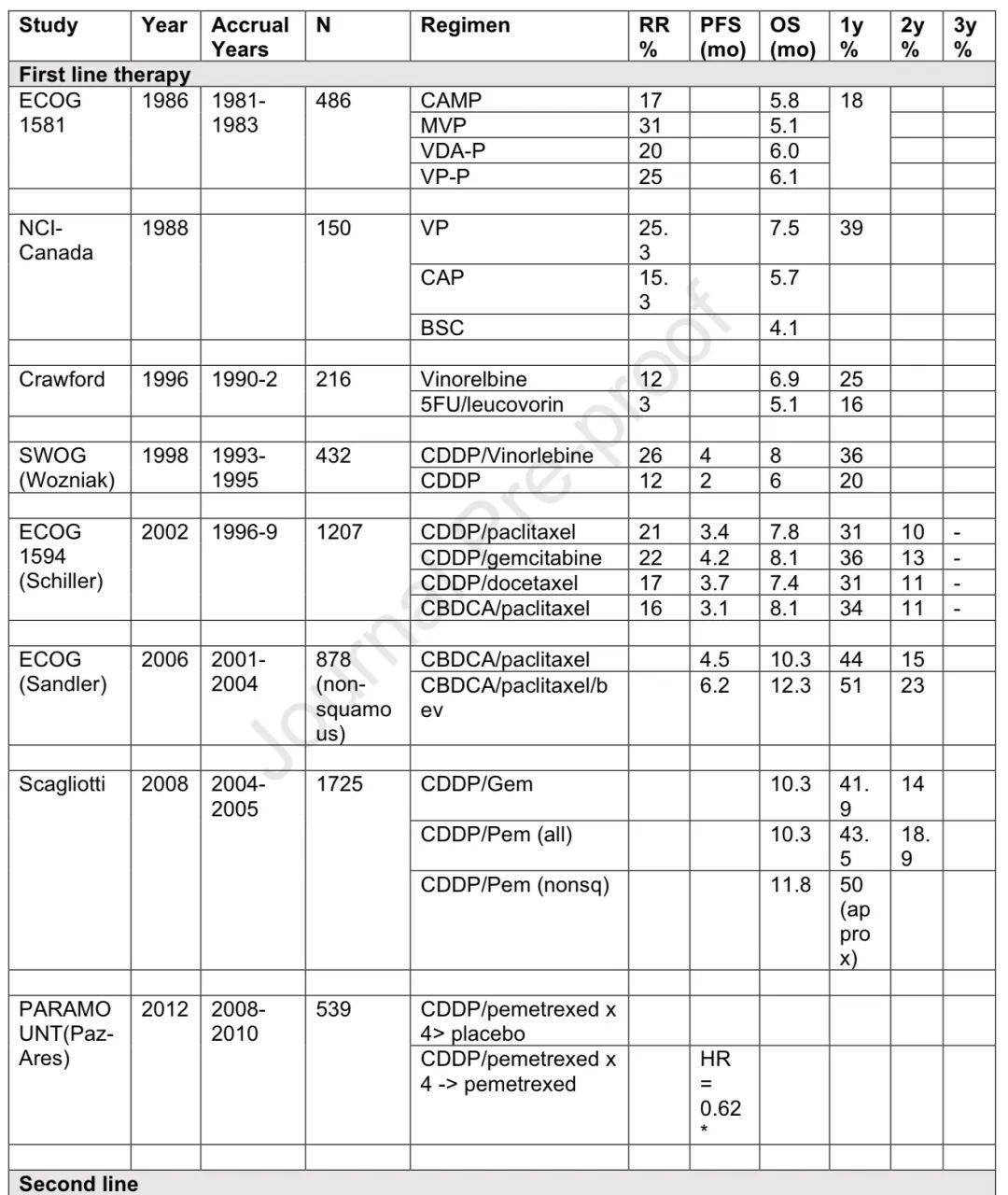
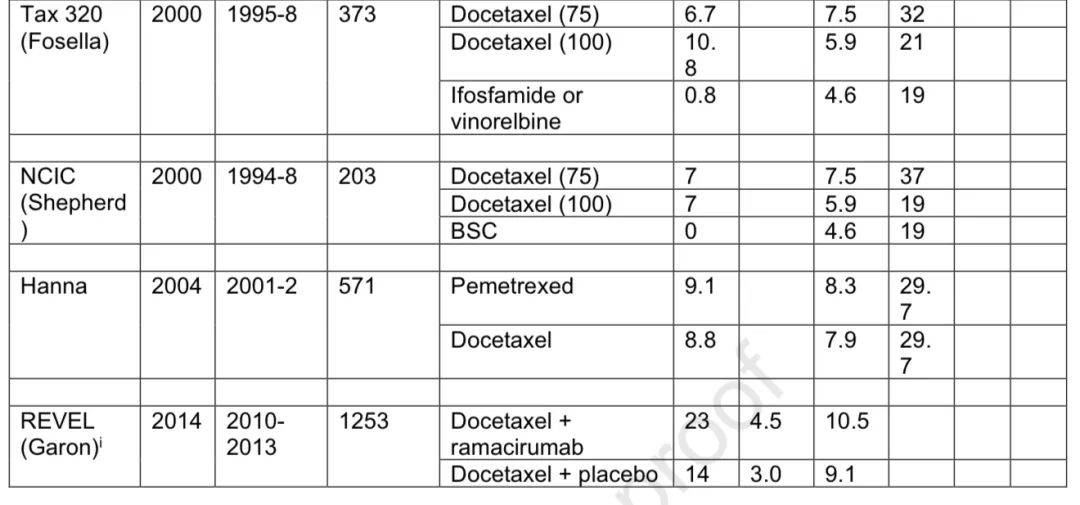
1960年代开始使用烷化剂等,顺铂在1970年代进入临床,到1980年代铂类单药或联合方案成为标准。1990年代出现新药物与铂类联合,效果优于单药顺铂,ECOG 1594显示不同联合方案生存结果相似但毒性不同。2000年代初多西他赛和培美曲塞获批为标准二线单药治疗。
组织学类型的作用
贝伐珠单抗和培美曲塞的开发使人们重新认识到组织学类型在治疗选择中的重要性,贝伐珠单抗在鳞状细胞癌中易导致严重出血,培美曲塞在非鳞状NSCLC中更有效。2010年代有多项试验比较化疗与新靶向药物但未成功,也有关于维持治疗的研究。
辅助化疗的作用
LACE荟萃分析显示术后四周期铂类化疗有约5%的总生存优势,2004年IALT研究验证了这一方法。
化疗的未来
化疗存在活性中等和毒性确定等问题,目前在抗体-药物偶联物及与靶向药物联合方面有新发展。
非小细胞肺癌的关键化疗研究
5.4 治疗之:抗血管生成药物
在过去二十年中,有很多利用血管生成抑制剂来阻断血管内皮生长因子(VEGF)通路的研究,该通路在肿瘤血管形成中起着关键作用。
与化疗联合的效果
REVEL研究显示在二线治疗中,ramucirumab联合多西他赛改善OS,但存在出血、高血压等风险。
与免疫治疗联合的作用
近期出现抗血管生成药物与免疫治疗的联合策略,但一些试验显示多靶点酪氨酸激酶抑制剂与免疫检查点抑制剂联合在二线治疗中未显示显著OS益处。
5.5 治疗之:EGFR突变NSCLC
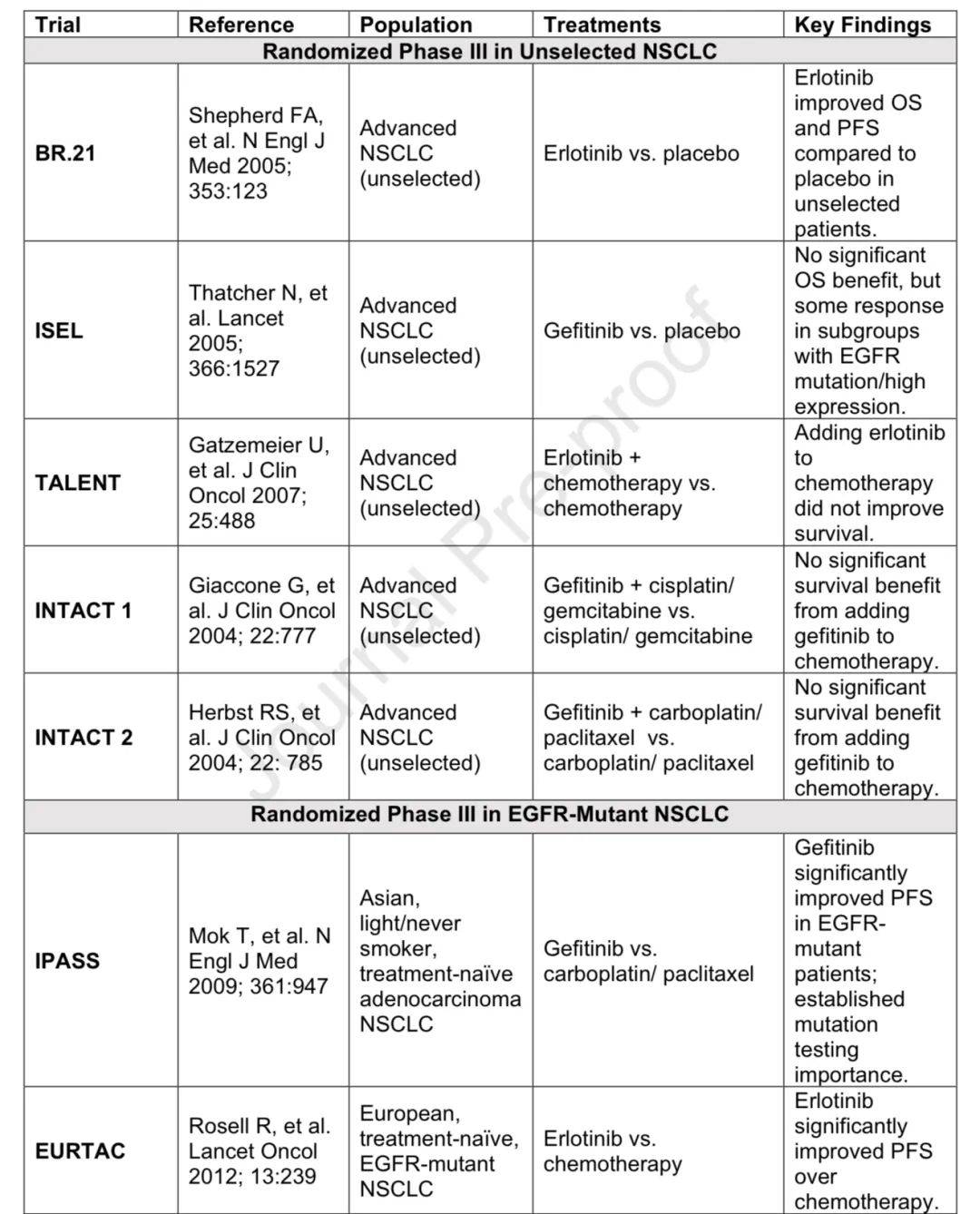
表皮生长因子受体(EGFR)于1963年首次被发现,它是一种跨膜酪氨酸激酶受体,通过激活下游信号通路来调控细胞增殖、分化和存活。癌症中可能存在EGFR的异常改变,包括突变、过表达和扩增。早期评估EGFR酪氨酸激酶抑制剂(TKIs)的临床研究在未经过筛选的非小细胞肺癌(NSCLC)患者群体中进行,结果并不理想。
EGFR突变与EGFR-TKIs的关系
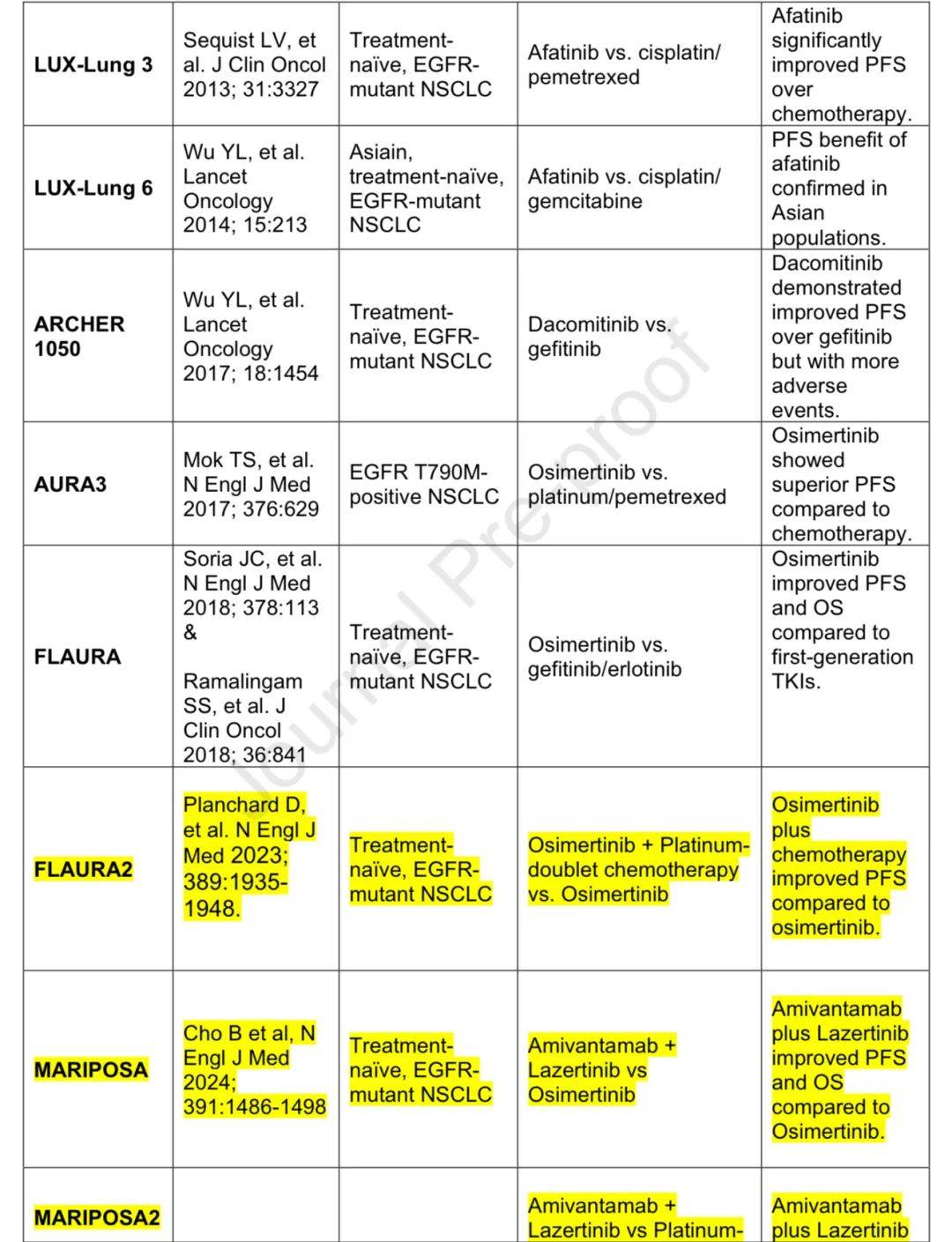
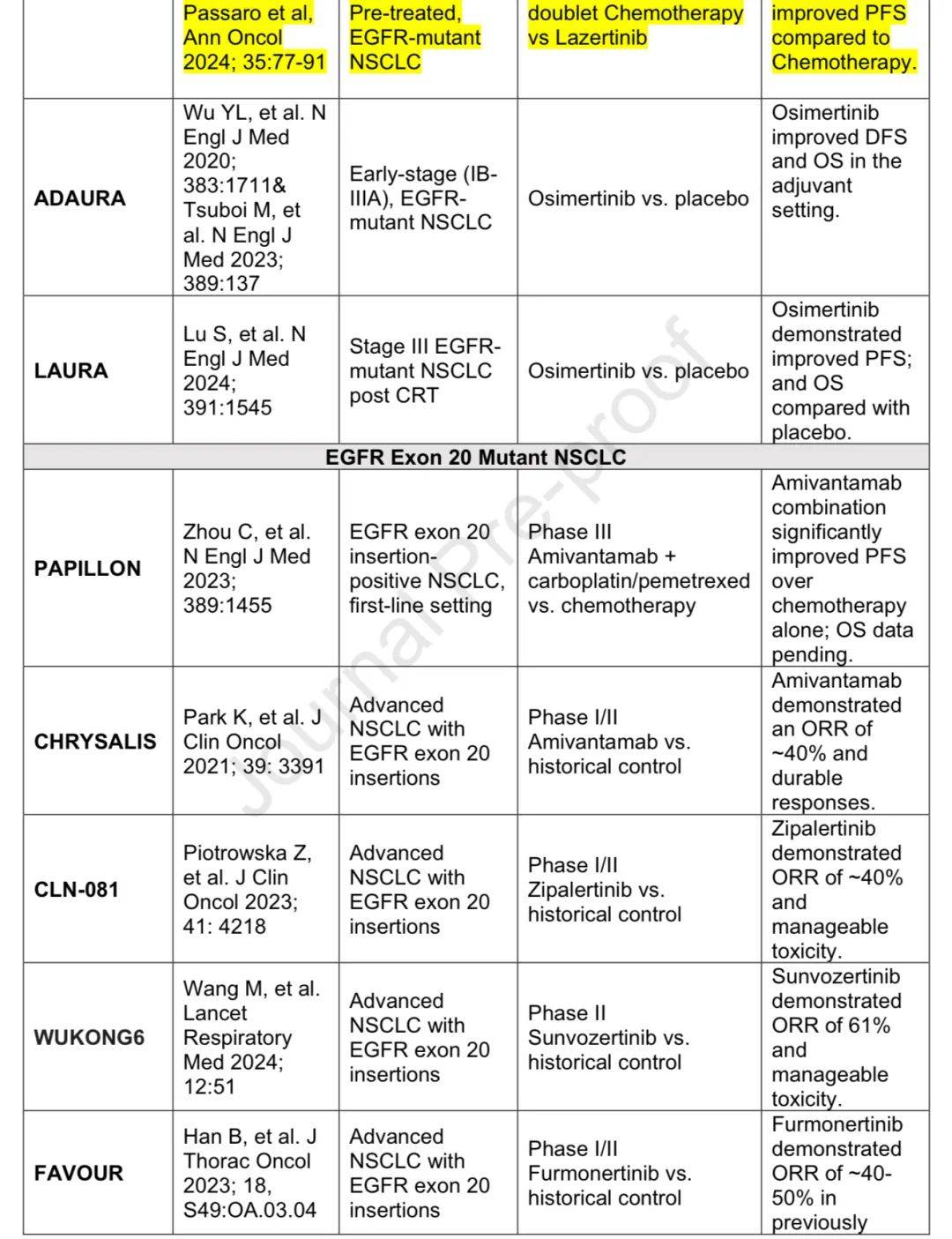
2004年发现EGFR突变,在白种人中约10-15%,亚洲人中约40%。 IPASS试验显示吉非替尼在敏感EGFR突变NSCLC患者中PFS改善,证实了基因组检测的重要性。exon 20 T790M突变是获得性耐药机制,第三代EGFR-TKIs对其有效且毒性更低。奥希替尼最初用于获得性耐药患者,FLAURA试验显示其一线使用PFS和OS更优。
EGFR-TKIs在局部和局部晚期疾病中的作用
ADAURA试验显示奥希替尼作为早期EGFR突变NSCLC术后辅助治疗可提高DFS和OS,减少CNS进展;LAURA试验显示奥希替尼在局部晚期不可切除患者放化疗后巩固治疗可改善PFS和OS。
其他治疗方法
针对耐药途径的治疗是研究重点,免疫治疗获益不显著。FLAURA-2试验显示奥希替尼联合化疗PFS优于单药,MARIPOSA方案显示amivantamab联合lazertinib有PFS和OS益处但毒性增加,MARIPOSA-2方案显示奥希替尼治疗后amivantamab联合化疗PFS优于单纯化疗。
EGFR exon 20插入+ NSCLC的治疗
EGFR exon 20插入是第三常见EGFR突变亚型,对传统EGFR-TKIs反应差,预后差。PAPILLON试验基于amivantamab联合化疗获批为一线治疗,还有其他药物在研究中。
EGFR突变性非小细胞肺癌的关键研究

5.6 治疗之:ALK、ROS、RET
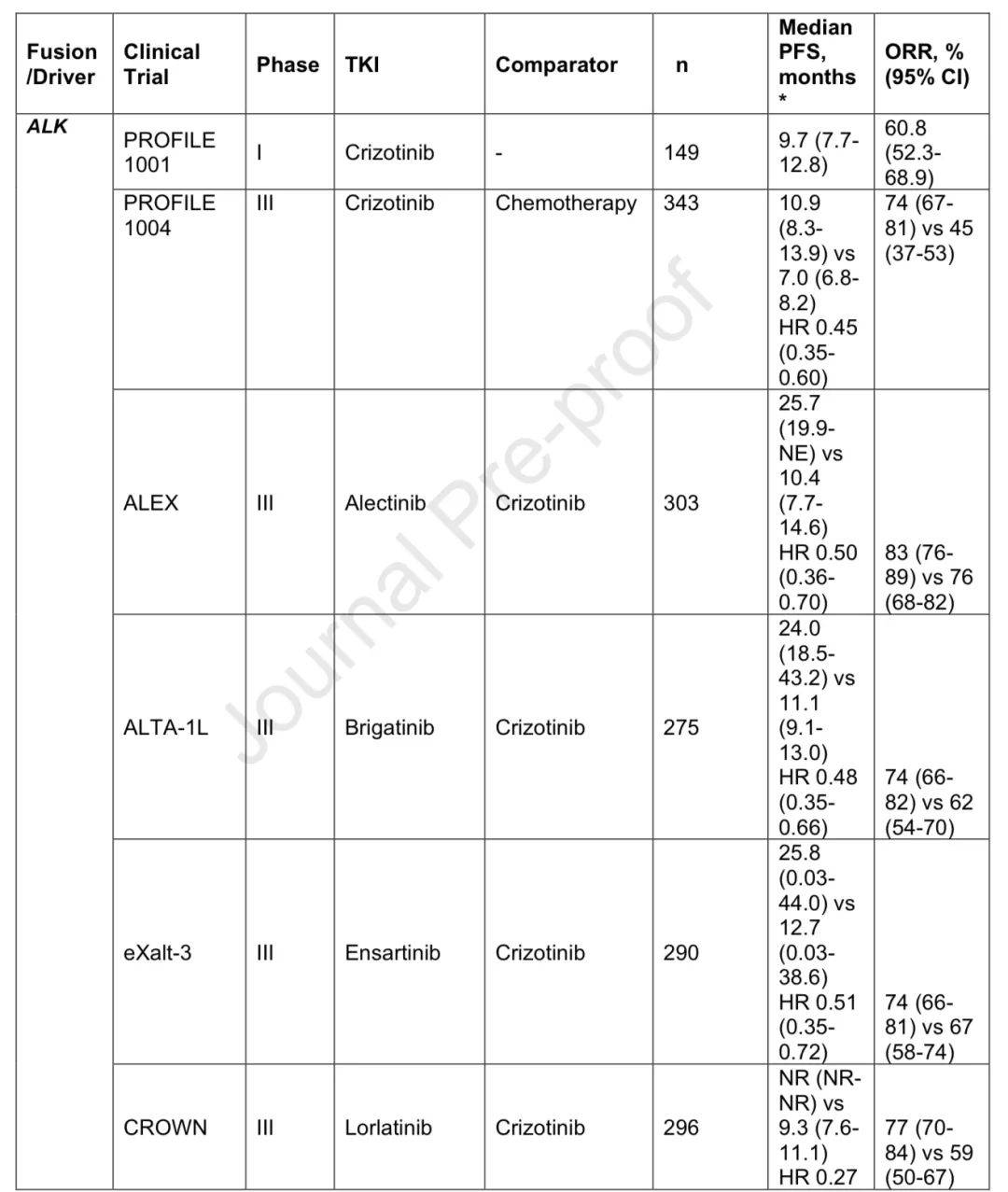
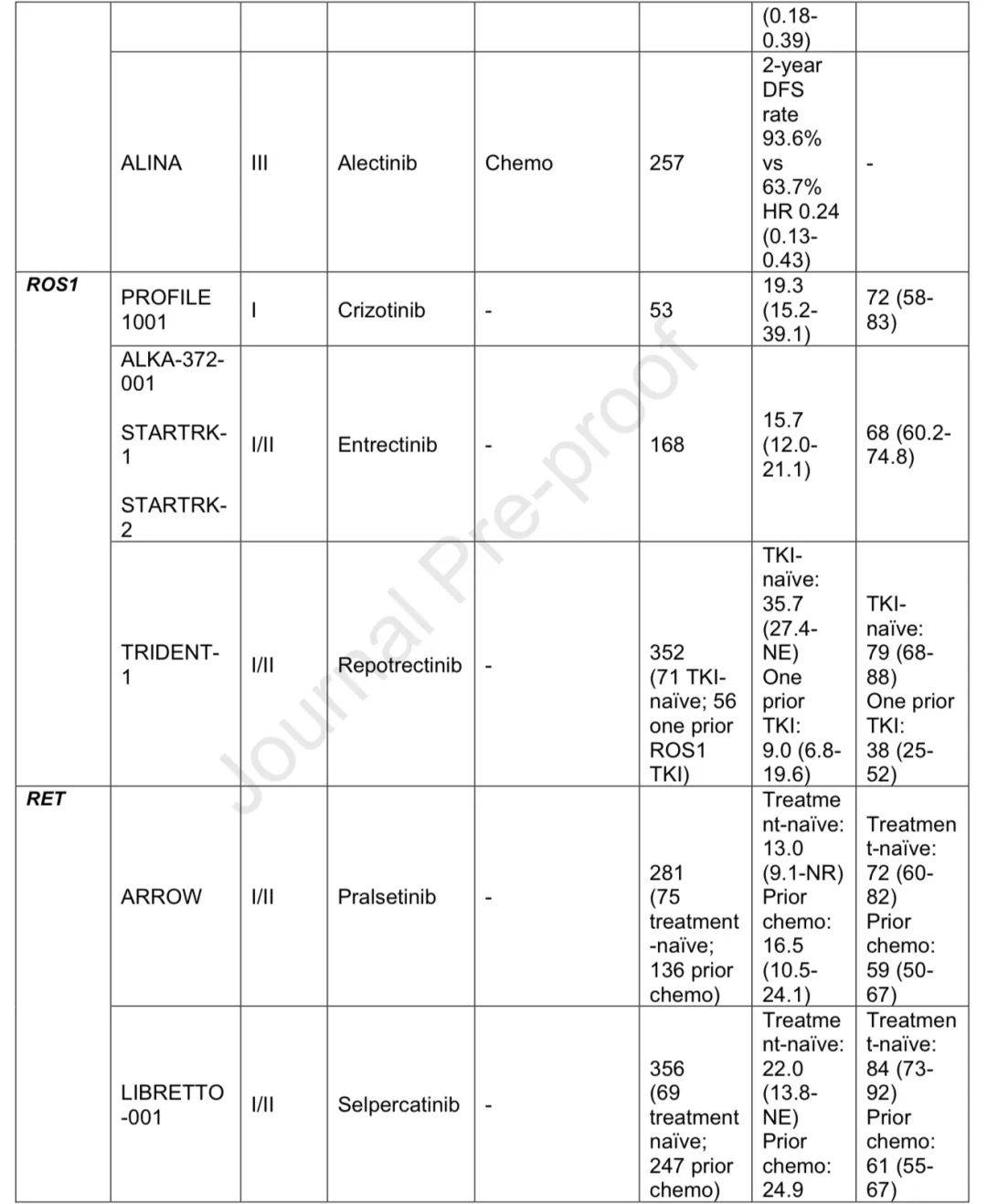
2007年发现ALK基因重排,crizotinib对转移性ALK重排NSCLC有显著疗效,随后多种ALK抑制剂获批。除ALK外,ROS1和RET融合也成为治疗靶点,有相应的基因型匹配疗法。
新一代TKI的改进
crizotinib存在脑穿透性差和早期耐药等问题,新一代ALK和ROS1抑制剂疗效更优,如ALEX试验中alectinib优于crizotinib,CROWN试验中lorlatinib一线使用效果显著。在ROS1重排NSCLC中,新一代抑制剂也显示出更优疗效。ALINA试验显示alectinib在切除的ALK+ NSCLC辅助治疗中DFS获益显著。
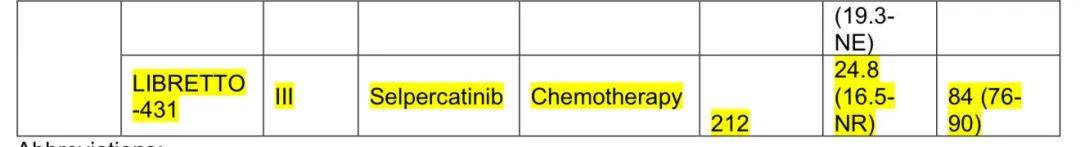
RET重排NSCLC的靶向治疗益处
在选择性RET抑制剂出现前,多激酶抑制剂疗效有限且毒性大。pralsetinib和selpercatinib在临床试验中显示出良好疗效和耐受性,LIBRETTO-431试验确立selpercatinib作为一线治疗的地位。目前在切除的ROS1或RET重排NSCLC中尚无获批的辅助靶向治疗,耐药仍是问题。
ALK、ROS1、RET变异相关研究
5.7 治疗之:KRAS、BRAF及少见突变
KRAS是首个在肺癌中发现的致癌驱动突变,曾被认为不可成药。研究发现可通过结合KRAS G12C突变的半胱氨酸残基抑制KRAS,sotorasib和adagrasib在二线治疗中显示出优于多西他赛的效果,目前在一线治疗中评估,还有其他相关药物在研发。
罕见致癌突变的识别和靶向治疗
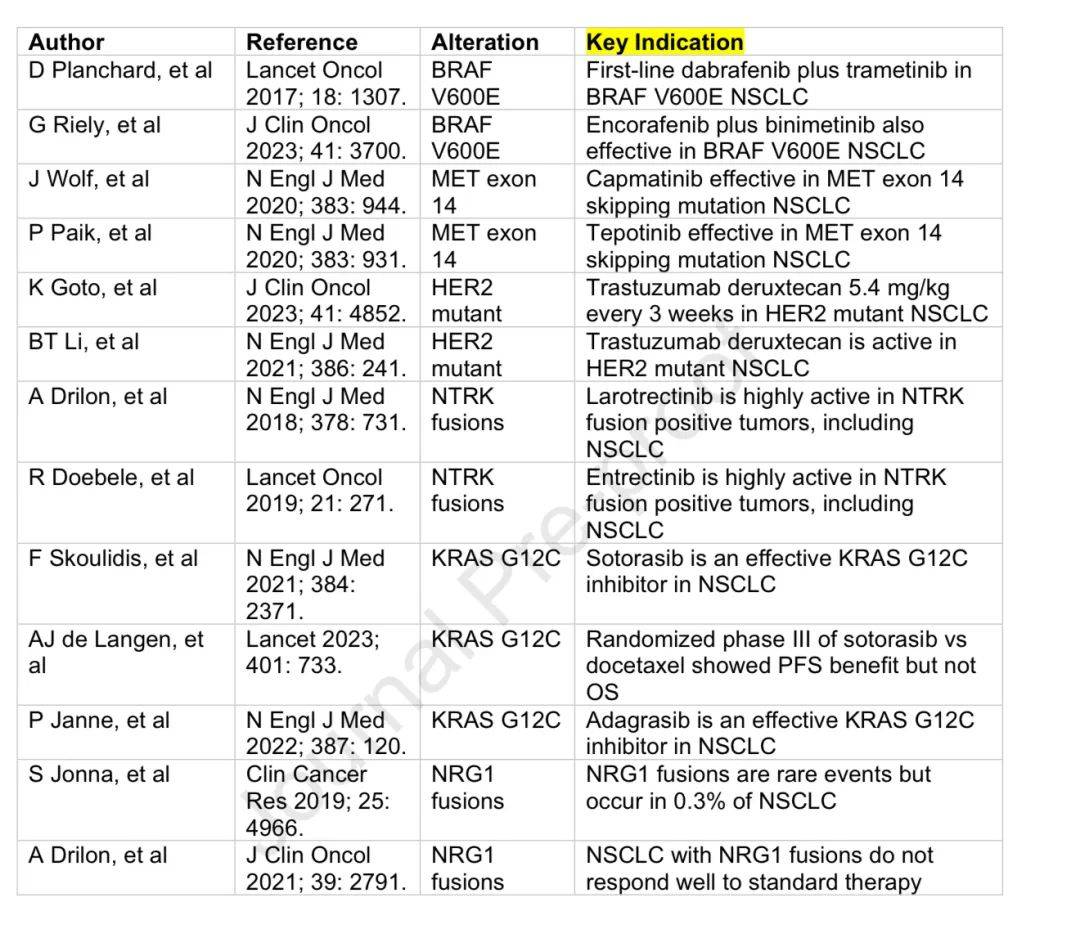
除上述靶点外,还有多种其他突变,一些可被特定靶向治疗。如HER2突变对HER2靶向ADC有反应,BRAF V600E突变和MET exon 14跳跃突变有相应靶向药物,NTRK1-3和NRG1融合虽罕见但有获批药物。
少见突变关键研究
5.8 治疗之:免疫治疗
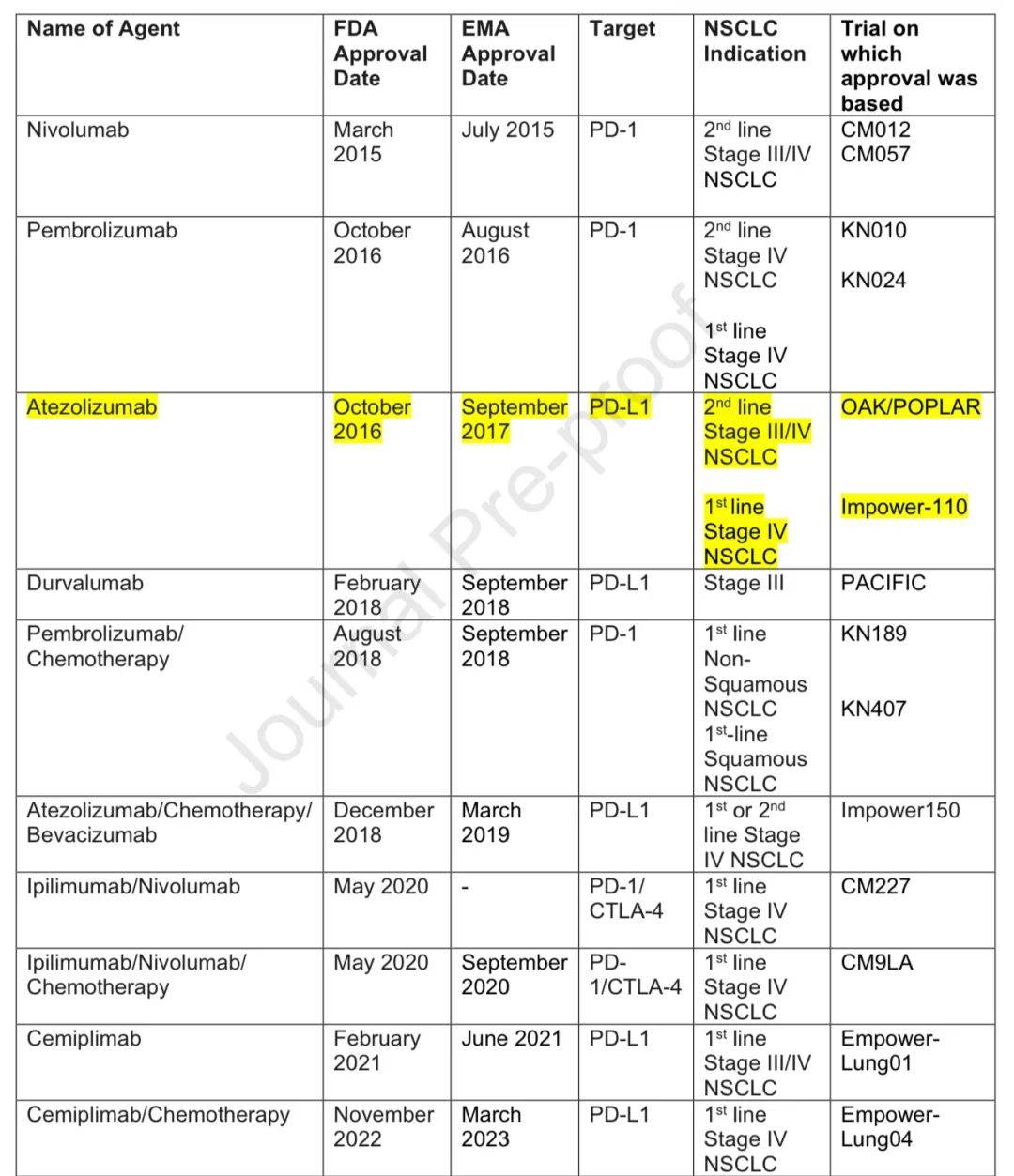
2012年一项I期研究评估了首个抗PD-1药物nivolumab,NSCLC患者ORR达18%,随后多项III期试验显示其在二线治疗中OS等优于多西他赛,5年生存率提高。后续在一线治疗中也有突破,如KEYNOTE-024试验显示pembrolizumab优于化疗。
化疗与免疫治疗的联合
ipilimumab + nivolumab在黑色素瘤中有效,CheckMate-227试验显示其在晚期NSCLC中获益,CheckMate-9LA试验显示加用两周期化疗效果更优。durvalumab + tremelimumab联合化疗也有获益。pembrolizumab联合化疗在转移性NSCLC中无论PD-L1状态均显示改善PFS和OS。
免疫治疗在根治性治疗后的长期益处
PACIFIC试验确立了免疫治疗在局部晚期NSCLC放化疗后的地位。IMpower010和PEARLS试验评估了辅助抗PD-(L)1治疗,显示在特定人群中获益。
围手术期 化疗免疫治疗的地位
两项研究者发起的试验显示新辅助免疫治疗有较好的病理反应率和长期生存率,CheckMate816和KEYNOTE-671等III期试验证实了新辅助或围手术期 chemo-immunotherapy 的益处。
免疫治疗获益人群的识别
PD-L1表达是唯一经验证的生物标志物,TMB也被评估,pembrolizumab获批用于高TMB肿瘤。STK11和KEAP1突变与抗PD-L1 ICI耐药相关,联合治疗可能克服。
免疫治疗关键研究

6. 支持与姑息治疗
1970-80年代,肺癌症状管理的重要性得到认可,WHO制定了疼痛管理指南;1990-2000年代,强调姑息治疗与肿瘤学的整合,注重整体护理;2010年代的一项III期试验显示,转移性NSCLC患者早期接受姑息治疗,生活质量、情绪显著改善,生存期平均延长2.7个月。
目前采用多学科方法管理癌症及其治疗引起的症状,如呼吸困难、咳嗽等,包括药物干预、非药物策略和必要的手术。现代姑息治疗还涉及心理和情感支持,由肿瘤学家、姑息治疗专家等共同参与。
未来方向
过去50年NSCLC的理解和治疗取得巨大进步,未来方向包括进一步发现生物标志物、使用ctDNA等动态生物标志物、开发新型免疫治疗和其他化合物(如双特异性抗体、CAR-T细胞疗法等)、探索局部治疗新方法,以及人工智能在筛查评估和治疗优化中的应用。
Ref: 50 years of Progress in Non-Small Cell Lung Cancer: A New Fellow’s Guide in the











 苏公网安备32059002004080号
苏公网安备32059002004080号


