浙江大学医学院附属第二医院大肠外科 住院医师
医学博士,德国慕尼黑大学( Summa Cum Laude )
以第一作者累计在Annals of Surgery, npj Precision Oncology等国际高水平杂志发表论著六篇,累计影响因子31分
参与国家自然科学基金青年和面上项目2项
中关村人才协会医学多学科融合专委会青年委员
ASCO 解读文献
LBA3502
Anlotinib versus bevacizumab added to standard first-line chemotherapy among patients with RAS/BRAF wild-type, unresectable metastatic colorectal cancer: A multicenter, prospective, randomised, phase 3 clinical trial (ANCHOR trial).
安罗替尼 VS 贝伐珠单抗联合一线化疗在RAS/BRAF野生型、无法切除的转移性结直肠癌患者中的疗效对比:多中心、前瞻性、随机对照、III期临床研究(ANCHOR 临床研究)
研究背景
抗VEGF抗体联合化疗是目前无法切除、转移性结直肠癌(metastatic colorectal cancer, mCRC)患者的一线治疗策略,但尚无随机对照临床研究评估口服VEGFR-TKI抑制剂联合化疗在此类患者中的疗效。
研究方法
本项研究为中国多中心、随机对照、非劣性的III期临床研究。纳入人群为初治的RAS/BRAF野生型、经多学科评估无法切除的mCRC患者,按照1∶1的比例将入组人群随机分为安罗替尼组(每日12mg,第1~14天)或贝伐珠单抗组(7.5mg/Kg,静滴,第1天),上述两组均联合奥沙利铂(130mg/m2,静滴,第1天)和卡培他滨(安罗替尼组:850mg/m2, 贝伐珠单抗组:1000mg/m2,Bid,第1~14天)的三周治疗方案。患者首先接受4~8个诱导化疗周期,之后接受安罗替尼或贝伐珠单抗联合卡培他滨的维持治疗方案,直至肿瘤出现进展或严重药物不良事件。分层因素包括肿瘤位置(右/左)和既往辅助化疗史(是/否)。主要研究终点为独立审查委员会(Independent review committee,IRC)所评估的无进展生存期(非劣性界限为风险比低于1.09);次要研究终点包括:研究者所评估的无进展生存期(Progression free survival, PFS)、客观反应率(Objective response rate, ORR)、疾病控制率(Disease control rate, DCR)、反应持续时间(Duration of response, DoR)、总生存时间(Overall survival, OS)、肝转移灶切除率和生活质量。本研究的样本量计算基于如下参数设定:单侧显著性水平α= 0.025、统计功效(power)为 81.2%、无进展生存期的事件目标值为 524。
研究结果
自2021-05-25至2023-08-30,本研究共纳入748例意向性治疗的结直肠癌患者,其被随机分为安罗替尼组(373例)和贝伐珠单抗组(375例)。该人群的中位年龄为59岁(95% CI:53~67岁),30.35%的入组患者为女性。中位随访时间为25.10个月(95% CI:23.82~26.25个月)。安罗替尼组和贝伐珠单抗的IRC所评估的中位PFS分别为11.04个月(95% CI: 9.82~11.17个月)和11.04个月(95% CI:9.69~11.17个),两组的风险比为1(0.84~1.18)。严重不良事件的发生率为:安罗替尼组38.34%,贝伐珠单抗组34.40%。
研究结论
在无法切除、RAS/BRAF野生型的mCRC患者中,安罗替尼联合奥沙利铂和卡培他滨(CapeOX)的治疗方案可获得与贝伐珠单抗联合CapeOX方案所等同的PFS和安全性。该结果为无法切除、RAS/BRAF野生型的mCRC患者提供了新的治疗选择。
临床研究登记号:NCT04854668
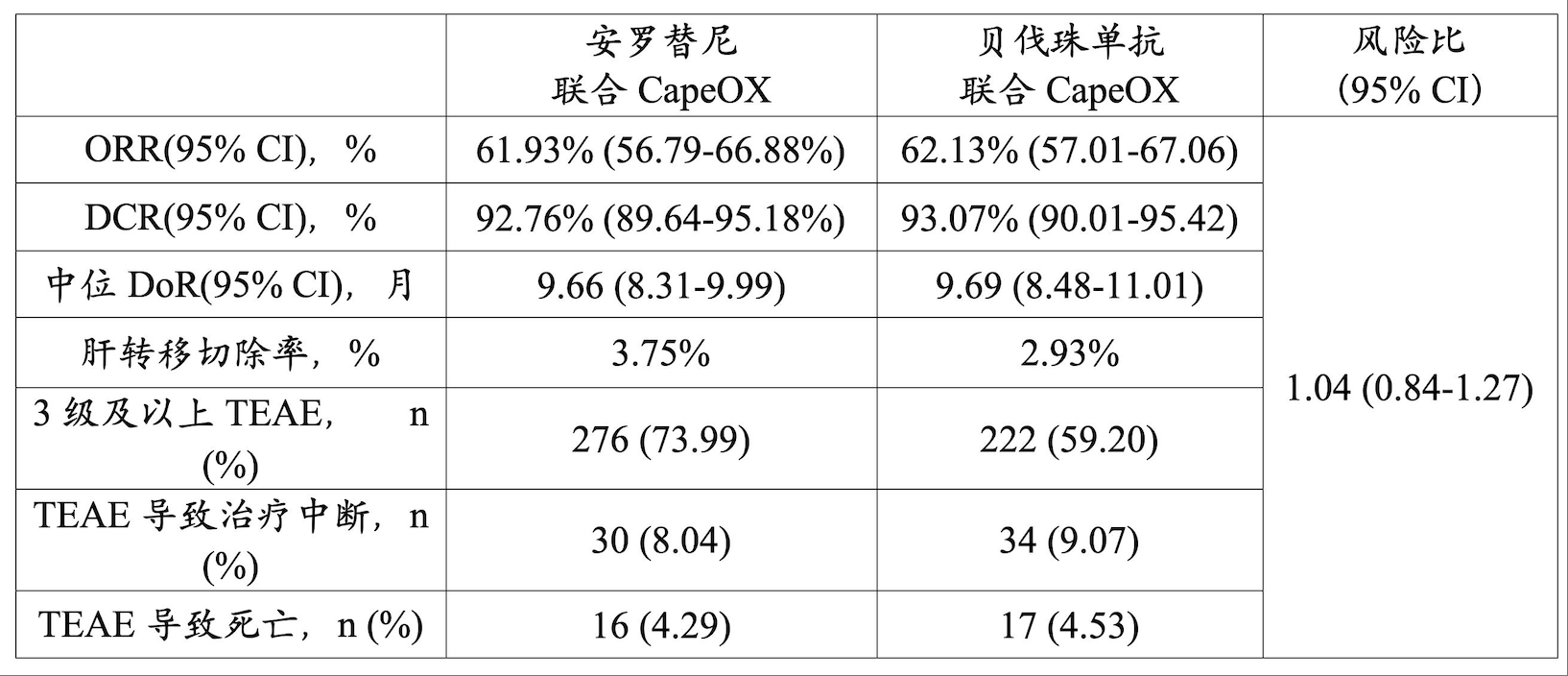
TEAE: Treatment emergent adverse event,治疗相关不良事件。
解读
结直肠癌在我国恶性肿瘤的发病率和死亡率分别位居第2位和第4位,2022年发病例数51.71万人和死亡例数24.00万人[1],约占全球结直肠癌的新发和死亡病例数的25%[2]。20%的结直肠癌患者在诊断时即存在转移,且另外40%的患者随着病情进展也会出现肿瘤转移。转移性结直肠癌(metastatic colorectal cancer, mCRC)患者的预后不佳,5年生存率低于15%[3]。
全身化疗能够显著延长无法切除mCRC患者的生存期和改善其生活质量[4]。微卫星高度不稳定性(Microsatellite instability-high, MSI-H)或错配修复缺陷(mismatch repair-deficient, dMMR)患者仅占mCRC人群的4%,此类人群适合使用免疫治疗[5]。然而,绝大部分mCRC患者的一线标准全身治疗方案为基于5-氟尿嘧啶、奥沙利铂和伊利替康的化疗联合抗血管内皮生长因子(Anti-vascular endothelial growth factor, VEGF)或抗表皮生长因子受体(anti-epidermal growth factor receptor, EGFR)单克隆抗体,包括贝伐珠单抗、帕尼单抗和西妥昔单抗。抗EGFR抗体仅适用于左半、RAS/RAF野生型的mCRC患者,而抗VEGF抗体则广泛适用于mCRC患者[6]。研究表明,抗VEGF抗体联合化疗相较于单独化疗能够显著改善mCRC患者的PFS和OS[7, 8],贝伐珠单抗或西妥昔单抗联合标准化疗方案在RAS野生型mCRC中可获得相似的PFS[9, 10]。此外,化疗联合贝伐珠单抗-西妥昔单抗/帕尼单抗治疗非但无法改善预后,而且可导致毒性增加[4, 11]。在过去的15年间,尚无新的生物制剂被允许作为mCRC患者的一线治疗策略。
抗血管新生的酪氨酸激酶抑制剂(Tyrosine kinase inhibitors, TKI)是能够抑制抗体与受体结合时所触发的胞内信号传导的小分子抑制剂。当前,抗血管新生的TKI已被批准用于治疗肾细胞癌、非小细胞肺癌等恶性肿瘤,且显现出高选择性、效果佳、低副作用和制备简单等优点[12]。并且,该药物已被批准用于mCRC患者的三线治疗方案[13, 14]。但是,既往研究未能找到可作为mCRC患者一线治疗的化疗联合TKI的治疗策略[15-17]。
安罗替尼为口服的小分子TKI药物,主要靶向作用于抗VEGF受体1/2/3,成纤维细胞生长因子受体1~4,以及血小板来源的生长因子受体 α/β[18]。该药物已被证明在多种晚期恶性肿瘤内显示出抗癌作用,包括食管鳞状细胞癌[19]、肝细胞癌[20]、肾细胞癌[21]和结直肠癌[22]。ALTER-0703的III期临床研究证实安罗替尼可显著改善难治性mCRC患者的PFS,且亚组分析证明该药物可延长RAS/BRAF野生型mCRC患者的总生存期,表明此类患者为安罗替尼的潜在适用人群[22]。同时,将安罗替尼联合CapeOX作为RAS/BRAF野生型mCRC患者一线治疗方案的II期临床研究表明,该方案可显著延长PFS、改善客观反应率和疾病控制率[23]。
尽管安罗替尼可导致治疗相关不良事件发生率显著增加,但通过间歇给药和调整卡培他滨的药物剂量,患者停药率和死亡风险与贝伐珠单抗组无异。本研究的中期实验结果表明安罗替尼联合CapeOX有望作为RAS/BRAF野生型mCRC患者的一线替代治疗策略,这为此类患者的治疗提供了多样化的选择,但仍需进一步的总生存期结果,以期为mCRC患者提供更具期望的治疗。
刘月教授 浙江大学医学院附属第二医院
安罗替尼作为一种泛靶点酪氨酸激酶抑制剂(TKI),其抗肿瘤机制在很大程度上与抗VEGF抗体重叠,均通过抑制肿瘤血管生成发挥作用。尽管此前多种TKI类药物在mCRC一线治疗中尝试受挫,未能找到合适的治疗策略,但本研究为无法手术切除、RAS/BRAF野生型的转移性结直肠癌(mCRC)患者提供了一个具有潜力的一线治疗新方案。
路医生以简明精炼的语言梳理了肿瘤生物制剂的发展背景与研究脉络,逻辑清晰、重点突出,不仅揭示了安罗替尼在mCRC治疗中的机制基础,也客观指出了其在临床转化方面的应用前景,体现了良好的科研素养与临床思辨能力。
【温馨提示】:如果您觉得路灿医生解读的好,请在下方为他点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
[1] HAN B, ZHENG R, ZENG H, et al. Cancer incidence and mortality in China, 2022 [J]. J Natl Cancer Cent, 2024, 4(1): 47-53.
[2] BRAY F, LAVERSANNE M, SUNG H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]. 2024, 74(3): 229-63.
[3] SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer Statistics, 2021 [J]. CA Cancer J Clin, 2021, 71(1): 7-33.
[4] BILLER L H, SCHRAG D. Diagnosis and Treatment of Metastatic Colorectal Cancer: A Review [J]. Jama, 2021, 325(7): 669-85.
[5] GROTHEY A. Pembrolizumab in MSI-H-dMMR Advanced Colorectal Cancer - A New Standard of Care [J]. N Engl J Med, 2020, 383(23): 2283-5.
[6] THOMPSON J A, SCHNEIDER B J, BRAHMER J, et al. Management of Immunotherapy-Related Toxicities, Version 1.2022, NCCN Clinical Practice Guidelines in Oncology [J]. J Natl Compr Canc Netw, 2022, 20(4): 387-405.
[7] SALTZ L B, CLARKE S, DíAZ-RUBIO E, et al. Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study [J]. J Clin Oncol, 2008, 26(12): 2013-9.
[8] CUNNINGHAM D, LANG I, MARCUELLO E, et al. Bevacizumab plus capecitabine versus capecitabine alone in elderly patients with previously untreated metastatic colorectal cancer (AVEX): an open-label, randomised phase 3 trial [J]. Lancet Oncol, 2013, 14(11): 1077-85.
[9] VENOOK A P, NIEDZWIECKI D, LENZ H J, et al. Effect of First-Line Chemotherapy Combined With Cetuximab or Bevacizumab on Overall Survival in Patients With KRAS Wild-Type Advanced or Metastatic Colorectal Cancer: A Randomized Clinical Trial [J]. Jama, 2017, 317(23): 2392-401.
[10] HEINEMANN V, VON WEIKERSTHAL L F, DECKER T, et al. FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment for patients with metastatic colorectal cancer (FIRE-3): a randomised, open-label, phase 3 trial [J]. Lancet Oncol, 2014, 15(10): 1065-75.
[11] TOL J, KOOPMAN M, CATS A, et al. Chemotherapy, bevacizumab, and cetuximab in metastatic colorectal cancer [J]. N Engl J Med, 2009, 360(6): 563-72.
[12] JIAO Q, BI L, REN Y, et al. Advances in studies of tyrosine kinase inhibitors and their acquired resistance [J]. Mol Cancer, 2018, 17(1): 36.
[13] LI J, QIN S, XU R H, et al. Effect of Fruquintinib vs Placebo on Overall Survival in Patients With Previously Treated Metastatic Colorectal Cancer: The FRESCO Randomized Clinical Trial [J]. Jama, 2018, 319(24): 2486-96.
[14] GROTHEY A, VAN CUTSEM E, SOBRERO A, et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial [J]. Lancet, 2013, 381(9863): 303-12.
[15] ARGILéS G, SAUNDERS M P, RIVERA F, et al. Regorafenib plus modified FOLFOX6 as first-line treatment of metastatic colorectal cancer: A phase II trial [J]. Eur J Cancer, 2015, 51(8): 942-9.
[16] TABERNERO J, GARCIA-CARBONERO R, CASSIDY J, et al. Sorafenib in combination with oxaliplatin, leucovorin, and fluorouracil (modified FOLFOX6) as first-line treatment of metastatic colorectal cancer: the RESPECT trial [J]. Clin Cancer Res, 2013, 19(9): 2541-50.
[17] SCHMOLL H J, CUNNINGHAM D, SOBRERO A, et al. Cediranib with mFOLFOX6 versus bevacizumab with mFOLFOX6 as first-line treatment for patients with advanced colorectal cancer: a double-blind, randomized phase III study (HORIZON III) [J]. J Clin Oncol, 2012, 30(29): 3588-95.
[18] SYED Y Y. Anlotinib: First Global Approval [J]. Drugs, 2018, 78(10): 1057-62.
[19] HUANG J, XIAO J, FANG W, et al. Anlotinib for previously treated advanced or metastatic esophageal squamous cell carcinoma: A double-blind randomized phase 2 trial [J]. Cancer Med, 2021, 10(5): 1681-9.
[20] SUN Y, ZHOU A, ZHANG W, et al. Anlotinib in the treatment of advanced hepatocellular carcinoma: an open-label phase II study (ALTER-0802 study) [J]. Hepatol Int, 2021, 15(3): 621-9.
[21] ZHOU A P, BAI Y, SONG Y, et al. Anlotinib Versus Sunitinib as First-Line Treatment for Metastatic Renal Cell Carcinoma: A Randomized Phase II Clinical Trial [J]. Oncologist, 2019, 24(8): e702-e8.
[22] CHI Y, SHU Y, BA Y, et al. Anlotinib Monotherapy for Refractory Metastatic Colorectal Cancer: A Double-Blinded, Placebo-Controlled, Randomized Phase III Trial (ALTER0703) [J]. Oncologist, 2021, 26(10): e1693-e703.
[23] LIU Y, XIAO Q, HE J, et al. Phase II study of anlotinib in combination with oxaliplatin and capecitabine for patients with RAS/BRAF wild-type metastatic colorectal adenocarcinoma as the first-line therapy [J]. BMC Med, 2022, 20(1): 155.











 苏公网安备32059002004080号
苏公网安备32059002004080号


