青岛大学附属医院肿瘤 放疗科 市南院区
青岛市抗癌协会肿瘤心脏病专业委员会 委员
加州大学旧金山分校公派访问学生
国际消化病大会 青年研究者奖
UCSF ICBI Hackathon 单细胞数据分析大赛 冠军团队
以第一、通讯作者在发表多篇SCI
主持国家自然科学基金青年项目1项
ASCO 解读文献
食管癌或胃食管交界处肿瘤新辅助放化疗后术后纳武利尤单抗辅助治疗:CheckMate 577 的总体生存期的初步结果
研究背景
全球III期CheckMate 577研究(NCT02743494)中位随访时间为24.4个月,初步分析显示纳武利尤单抗辅助治疗在食管癌或胃食管交界处肿瘤(EC/GEJC)患者新辅助放化疗和手术后残留病理病变的患者中,显示出与安慰剂相比具有统计学意义的无病生存期(DFS)改善,且安全性良好。我们报告了经分级检验的次要终点总体生存期(OS)的最终分析结果,以及更长期随访的DFS。
研究方法
接受新辅助放疗化疗后R0切除且术后残留病理病变的II/III期EC/GEJC患者按照2:1比例随机分配至纳武利尤240mg组和安慰剂组Q2W 16周组,随后接受纳武利尤480mg或安慰剂Q4W。最长治疗时间为1年。主要研究终点为DFS。次要研究终点为OS,探索性研究终点包括安全性、无远处转移生存期(DMFS)以及后续全身治疗的无进展生存期(PFS2)。
研究结果
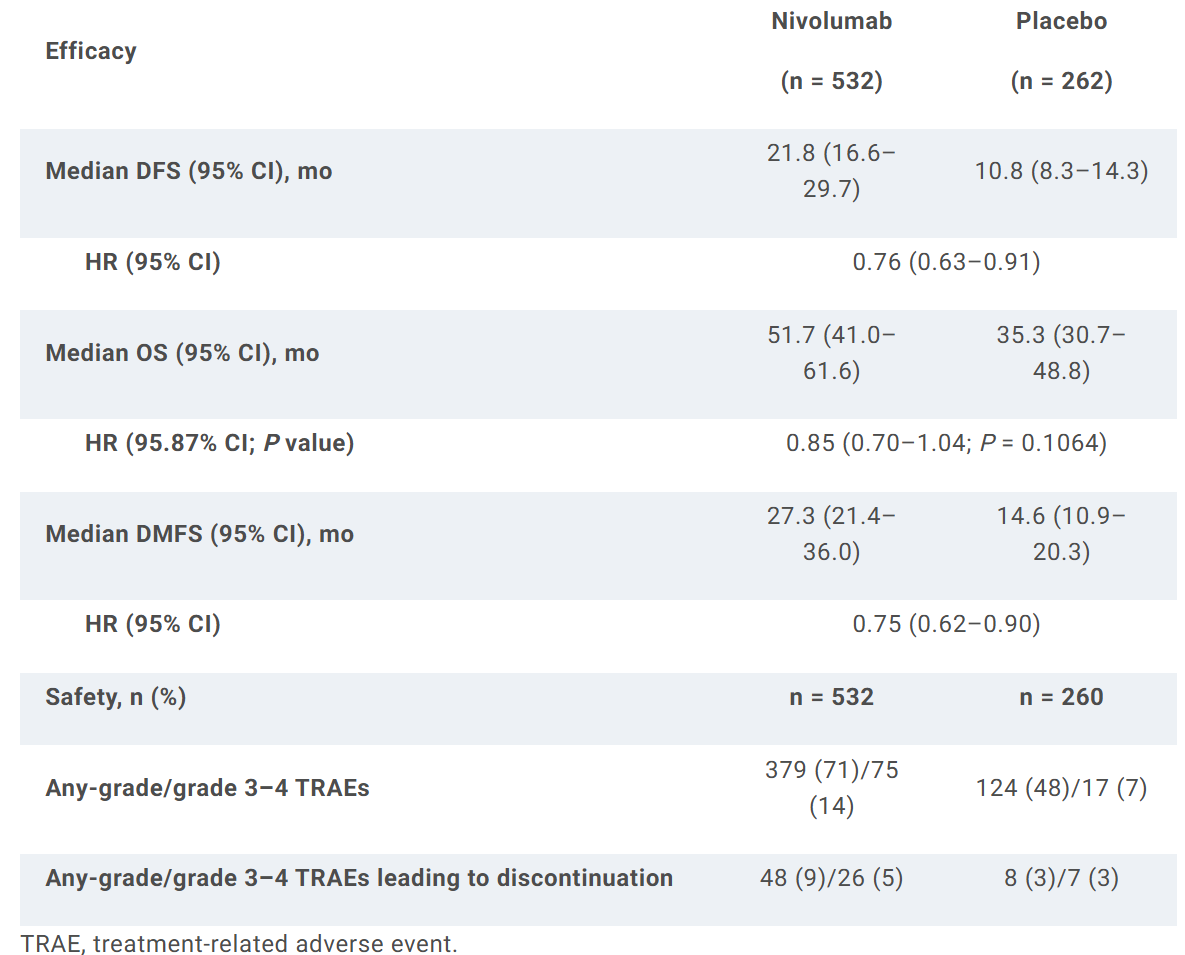
794名患者接受随机分组(纳武利尤组,n = 532;安慰剂组,n = 262)。中位随访时间为78.3个月(范围:60.1–96.6个月),纳武利尤辅助治疗组持续显示出优于安慰剂组的DFS(HR 0.76 [95% CI 0.63–0.91];见表格)。纳武利尤组的中位OS在数值上优于安慰剂组(51.7个月 vs 35.3个月),但差异无统计学意义(HR 0.85 [95.87% CI 0.70–1.04];P = 0.1064;见表格)。纳武利尤组与安慰剂组的3年和5年OS率分别为57% vs 50%和46% vs 41%。OS亚组分析结果也将公布。与安慰剂组相比,纳武利尤组具有显著的 DMFS 改善(表格)。PFS2结果显示纳武利尤组优于安慰剂组(HR 0.81 [95% CI 0.67–0.98])。纳武利尤 组46%的患者接受了后续治疗,而安慰剂组为60%;纳武利尤5%的患者接受了后续免疫治疗,而安慰剂组为15%。未发现新的安全性信号。
研究结论
对于接受放化疗后手术切除且术后残留病理病变的II/III期EC/GEJC患者,纳武利尤辅助治疗显示出持续的长期DFS获益,且OS数值改善优于安慰剂组。纳武利尤辅助治疗的安全性在长期随访中仍然保持良好。这些结果进一步支持在该患者群体中使用纳武利尤辅助治疗。
解读
对于可切除的局部晚期食管癌或胃食管连接部癌(EC/GEJC)患者,新辅助放化疗后手术是标准治疗方案。然而,即便接受标准治疗,患者的复发风险仍然较高,尤其是未达到病理完全缓解(pCR)的患者,其中位总生存期(mOS)短于pCR的患者,淋巴结阳性患者的预后更差。因此,急需辅助治疗来改善预后。然而,辅助治疗仍缺乏证据,目前的指南中,新辅助放化疗后手术后的治疗仍推荐随访。CheckMate 577研究旨在探索新辅助放化疗和手术后辅助治疗效果,为辅助治疗提供证据。
CheckMate 577研究为全球性大型III期随机对照研究,研究于2016年7月至2019年8月在全球29个国家/地区的170个研究中心开展,共对1,085例患者进行了纳入资格评估,最终794例患者被随机分配接受纳武利尤单抗治疗(532例)或安慰剂治疗(262例)。2020年,该研究首次在ESMO大会上公布了无病生存期(DFS)数据,后其研究结果发表在The New England Journal of Medicine杂志[1];2025年在ASCO大会上进一步公布了OS数据。研究结果显示,纳武利尤辅助治疗组较安慰剂组DFS延长了11个月(21.8 vs. 10.8个月),HR(95% CI)为0.76 (0.63–0.91);mOS较安慰剂组延长了16.4个月(51.7 vs. 35.3个月),HR(95% CI)为0.85 (0.70–1.04; P = 0.1064),尽管mOS未达到统计学显著差异,但在临床上仍具有重要意义。且纳武利尤单抗辅助治疗组表现出较好的安全性,3-4级治疗相关不良反应(TRAEs)的发生率为14%,安慰剂组为7%。
(一)患者基线特征及获益人群的选择
1、CPS评分(Combined Positive Score)对疗效的影响
CPS评分在患者选择中具有重要的指导意义。本研究中,在CPS<1的患者中,纳武利尤辅助治疗组并未观察到明显获益。而CPS≥1的患者则表现出明显获益,其mOS较安慰剂组延长,HR为0.79。值得注意的是,虽然该研究在入组时未限定患者PD-L1表达情况,但纳入的病人中仍有90%以上的患者CPS评分≥1。提示在真实世界中,大部分患者可能在纳武利尤单抗辅助治疗中获益,患者的CPS评分也为医生对治疗方案的选择提供参考。
2、不同解剖部位及病理类型的疗效差异
本研究共纳入462例食管癌患者和332例食管胃结合部患者。结果表明,食管胃交界处肿瘤患者的HR为1.14,提示该亚组人群可能从治疗中获益有限。该研究共纳入563例食管腺癌患者和230例食管鳞癌患者。食管鳞癌患者获益最为明显,mOS较安慰剂组有19个月的提升,HR为0.69。食管腺癌患者获益相对有限,需结合CPS评分进行评估,CPS≥1的患者有显著获益,HR为0.79,而CPS<1的患者无明显获益,HR为1.4。

3、肿瘤退缩程度对疗效的影响
值得注意的是,该研究在设计之初,有意剔除了pCR的患者(约占总体的25%-30%),以聚焦于高风险群体。其中,约有58%淋巴结阳性患者。由于该研究未纳入pCR患者,目前尚无证据支持这类患者在接受新辅助放化疗及手术后是否仍需进行纳武利尤单抗辅助治疗。

(二)该方案的安全性
该治疗方案具有良好的安全性,约有86%的患者成功耐受了90%以上的剂量强度,绝大多数患者基本完成了为期一年的治疗周期,相比术后辅助化疗具有更高的耐受性。研究中未发现新的严重毒性反应,进一步证实了该方案的安全性,特别是对于年龄较大或基础状况较差的患者,该方案提供了一种较为理想的治疗选择。
(三)CheckMate 577研究的意义及后期研究设计的展望
对于年龄较轻、身体状况良好的患者,可考虑更为积极的治疗策略,例如联合化疗、靶向治疗等,以进一步改善预后。加入化疗,加入靶向治疗。
(四)我们的探索与创新
在我国,食管癌发病率、死亡率分居恶性肿瘤第六和第四位,而与CheckMate 577研究纳入较多食管腺癌不同的是,我国的食管癌中90%以上为食管鳞癌。可手术食管鳞癌患者,新辅助放化疗是标准治疗方案[2]。然而,新辅助放化疗复发转移率高达33.7%-48%[3, 4]。在CheckMate 577开展之时,免疫治疗还未进入广泛的应用。2019年,FDA批准PD-1抑制剂用于晚期食管鳞癌的治疗,预示着免疫治疗策略的成功,为食管鳞癌的综合治疗带来了新的希望。近期,新辅助放(化)疗联合免疫相关临床研究陆续公布,对于可手术患者,新辅助化疗联合免疫治疗的pCR率为29%[5];新辅助放化疗联合免疫治疗的pCR率为23.1%-55.6%[6, 7];
而我们团队对新辅助放疗联合免疫治疗这一新的治疗模式进行了探索,该研究的前期结果在2025年的ESTRO大会上进行了口头汇报,并入选Top 5%研究。在这项新辅助放疗联合抗PD-1单抗用于可手术食管鳞癌新辅助治疗的Ib期临床研究中,接受手术的患者pCR率为36.2% (17/47),主要病理缓解率为51.1% (24/47),1年和2年OS率分别为89.3%和76.3%,mDFS为32.66个月。
尽管该研究达到了36.2%的pCR率,但仍有许多患者无法从新辅助放疗联合免疫治疗中获益。对新辅助放疗联合免疫治疗抵抗的患者,盲目的进行新辅助治疗可能会延误病人的病情,增加手术难度,增加免疫相关副反应的风险。因此,在未来,我们也将进一步探索可手术食管鳞癌患者对新辅助放疗联合免疫治疗抵抗的分子机制,帮助抵抗患者在治疗中获益。
李宝生教授评语:
尹晓阳医生对CheckMate 577最新数据进行了详细的解读,解读内容结构清晰、逻辑严谨,能够较为系统地呈现CheckMate 577研究的设计背景、主要研究结果及其在不同亚组中的疗效差异,并结合ESMO、ASCO等大会的进展,显示出对领域前沿的紧密跟踪能力。在总结国外研究的基础上,能够结合我国食管癌病理类型以鳞癌为主的流行病学特征,强调CheckMate 577研究对中国人群的借鉴意义,并介绍了本团队的研究工作。体现了良好的临床基础与学术潜力。
【温馨提示】:如果您觉得尹晓阳医生解读的好,请在下方为她点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
[1] Kelly, Ronan J et al. “Adjuvant Nivolumab in Resected Esophageal or Gastroesophageal Junction Cancer.” The New England journal of medicine vol. 384,13 (2021): 1191-1203. doi:10.1056/NEJMoa2032125
[2] Lagergren, Jesper et al. “Oesophageal cancer.” Lancet (London, England) vol. 390,10110 (2017): 2383-2396. doi:10.1016/S0140-6736(17)31462-9
[3] Eyck, Ben M et al. “Ten-Year Outcome of Neoadjuvant Chemoradiotherapy Plus Surgery for Esophageal Cancer: The Randomized Controlled CROSS Trial.” Journal of clinical oncology : official journal of the American Society of Clinical Oncology vol. 39,18 (2021): 1995-2004. doi:10.1200/JCO.20.03614
[4] Liu, Shiliang et al. “Recurrence patterns after neoadjuvant chemoradiotherapy compared with surgery alone in oesophageal squamous cell carcinoma: results from the multicenter phase III trial NEOCRTEC5010.” European journal of cancer (Oxford, England : 1990) vol. 138 (2020): 113-121. doi:10.1016/j.ejca.2020.08.002
[5] He, Wenwu et al. “The efficacy and safety of neoadjuvant immunotherapy in resectable locally advanced esophageal squamous cell carcinoma: A systematic review and meta-analysis.” Frontiers in immunology vol. 14 1118902. 17 Feb. 2023, doi:10.3389/fimmu.2023.1118902
[6] Li, Chengqiang et al. “Preoperative pembrolizumab combined with chemoradiotherapy for oesophageal squamous cell carcinoma (PALACE-1).” European journal of cancer (Oxford, England : 1990) vol. 144 (2021): 232-241. doi:10.1016/j.ejca.2020.11.039
[7] Hong, Min Hee et al. “A phase II trial of preoperative chemoradiotherapy and
pembrolizumab for locally advanced esophageal squamous cell carcinoma (ESCC).” Journal of Clinical Oncology vol 37 (2019): 4027-4027.











 苏公网安备32059002004080号
苏公网安备32059002004080号


