主要从事消化系病的临床及基础研究,专注于肝胆胰肿瘤及新药研发方向
北京癌症防治学会肝胆胰临床研究专委会委员
Journal of Clinical and Translational Hepatology、Exploratory Rearch and Hypothesis in Medicine、Cancer advances、Life research及《中华生物医学工程》杂志青年编委
入选北京市医管局第八批“青苗”计划
主持国自然青年基金、北大青年培育A类、美捷登青年科学家基金
以第一作者及通讯作者发表SCI论文10余篇,影响因子累计超过110分
先后多次获ESMO Merit awards和UEG Travel Awards资助
获华夏医学科技奖三等奖
ASCO 解读文献
Abstract 4010
Efficacy and safety of cafelkibart (LM-108), an anti-CCR8 monoclonal antibody, in
combination with anti-PD-1 therapy in patients with pancreatic cancer: Results
from phase 1/2 studies.
抗CCR8单克隆抗体cafelkibart(LM-108)联合抗PD-1治疗在胰腺癌患者中疗效和安全性研究:1/2期研究结果
摘要
研究背景及目的
靶向肿瘤浸润性调节性T细胞(Tregs)是克服免疫治疗耐药的一种很有前途的抗肿瘤治疗策略。LM-108是一种新型Fc段优化的抗CCR8单克隆抗体,旨在选择性地清除肿瘤浸润性Tregs,同时保留外周Tregs。这项对1/2期试验的汇总分析评估了LM-108联合抗PD-1治疗晚期胰腺癌患者的疗效和安全性。
研究方法
符合条件的胰腺癌患者(pts)曾接受过至少一线全身治疗,并在治疗后病情进展,被纳入研究。治疗方案包括LM-108,剂量为3 mg/kg Q3W、3 mg/kg Q2W、10 mg/kg Q3W或10 mg/kg Q2W,联合帕博利珠单抗(pembrolizumab)(400 mg Q6W)或特瑞普利单抗(toripalimab)(240 mg Q3W)。主要终点是客观缓解率(ORR)。次要终点包括疾病控制率(DCR)、无进展生存期(PFS)、总生存期(OS)、缓解持续时间(DoR)、安全性以及生物标志物分析。数据截止日期:2024年12月2日。
研究结果
共计80名来自中国和澳大利亚的患者接受了治疗(中位年龄:63岁;58.8%为男性)。其中,48名患者为接受一线治疗后病情进展,32名患者接受了≥2线治疗。14名患者(17.5%)曾接受过抗PD-1治疗,52名患者(65.0%)在基线时存在肝转移。76名患者(95.0%)报告了治疗相关不良事件(TRAEs)。常见的TRAEs(≥25%)包括AST升高、ALT升高、贫血、皮疹、发热、血小板计数降低和结合胆红素升高。42名患者(52.5%)发生了≥3级TRAEs,最常见的事件(≥5%)是脂肪酶升高(7.5%)、ALT升高(6.3%)、AST升高(5.0%)、免疫性小肠结肠炎(5.0%)、低钾血症(5.0%)和皮疹(5.0%)。中位随访时间为10.48个月(95% CI 7.20-12.65)。在74例可评估疗效的患者中,ORR为20.3%(95% CI 11.8-31.2%),DCR为62.2%(95% CI 50.1-73.2%)。中位DoR为5.5个月(95% CI 3.0-8.9),PFS为3.12个月(95% CI 1.61-4.86),OS为10.02个月(95% CI 6.41-13.11)。在45名接受过一线治疗后病情进展的患者中,ORR为24.4%(95% CI 12.9-39.5%),DCR为71.1%(95% CI 55.7-83.6%),中位DoR为6.93个月(95% CI 3.02-NA),PFS为4.86个月(95% CI 2.79-6.90),OS尚未达到。12个月OS率为51.6%(95% CI 31.4-68.5%)。其中,9名CCR8高表达患者(7名基线肝转移患者)的ORR为33.3%(95% CI 7.5-70.1%),DCR为77.8%(95% CI 40.0-97.2%)。中位PFS为6.90个月(95% CI 1.22-NA),OS为9.15个月(95% CI 3.61-NA)。
研究结论
LM-108联合抗PD-1治疗在既往接受过全身治疗后病情进展的胰腺癌患者中,显示出令人鼓舞的抗肿瘤活性和可控的安全性。这些发现支持进一步研究LM-108联合抗PD-1疗法作为胰腺癌的潜在治疗选择。
解读
在晚期胰腺癌治疗领域,探索更有效的治疗策略一直是临床研究的重点与难点。此次关于抗CCR8单克隆抗体 cafelkibart(LM-108)联合抗PD-1治疗胰腺癌的1/2期研究,为我们带来了许多值得深入探讨与分析的信息。
本研究是全球首个针对肿瘤浸润性调节性T细胞(Tregs)的双免疫联合治疗策略在胰腺癌中的临床探索。研究设计聚焦于通过Fc段优化的抗CCR8单克隆抗体LM-108选择性清除肿瘤微环境中的Tregs,同时保留外周免疫稳态,从而解除免疫抑制并增强抗PD-1治疗的疗效。研究纳入80例经治晚期胰腺癌患者,联合使用LM-108(3-10mg/kg Q2W/Q3W)与帕博利珠单抗或特瑞普利单抗,主要终点ORR达20.3%,二线治疗患者ORR提升至24.4%,12个月OS率达51.6%。值得关注的是,在CCR8高表达(≥2%肿瘤细胞)的亚组中,ORR进一步提升至33.3%,DCR达77.8%,提示精准筛选生物标志物的重要性。
疗效和安全性数据分析
1.1后线治疗潜力 vs 前线推进可行性
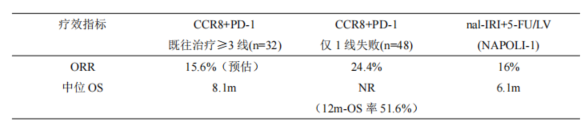
胰腺癌二线治疗目前存在巨大未满足需求(现有ORR仅10-15%,OS 6-8个月)。本研究中在既往接受≥1线治疗(48%≥2线)的难治性患者中,LM-108联合方案ORR可达到 20.3%,远超现有二线方案(如脂质体伊立替康+5-FU ORR 16%)[1],尤其一线失败亚组ORR可达到24.4%,具有里程碑价值。对比NAPOLI-1研究中nal-IRI+5-FU/LV二线OS 6.1个月,本研究的中位OS 10.02个月的全组数据,生存期延长近50%,且12个月OS率51.6%(一线失败亚组)更具临床意义,这意味着半数患者生存突破1年关口,强烈支持该联合方案向二线治疗推进。
虽然该方案中位PFS仅3.12个月(全组),但其OS却达10.02个月,提示生存获益超越疾病进展。可能的原因涉及Treg清除可能改变肿瘤免疫微环境,延缓后续进展速度(如肝转移灶控制更持久)。
1.2肝转移人群获益
胰腺癌肝转移患者通常预后极差。本研究中,52例患者(65.0%)在基线时存在肝转移,且在这部分肝转移患者中,联合治疗显示出一定疗效。尤其在CCR8高表达组肝转移患者占7/9且DCR达77.8%,提示该策略或能逆转转移灶的免疫抑制生态,为胰腺癌肝转移人群带来希望。既往研究表明,肝转移灶中肿瘤微环境可能与原发灶存在差异,分子机制涉及肝脏独特的免疫微环境和丰富的血液循环[2-3],如肝脏Kupffer细胞分泌CCL1→招募CCR8+Treg;肝窦内皮细胞高表达PD-L1→LM-108清除Treg→解除局部免疫抑制→联合PD-1抑制剂可产生协同效应。具体原因需进一步深入研究,未来可通过对肝转移灶和原发灶的肿瘤微环境、CCR8表达等进行对比分析,明确肝转移患者对该联合治疗有效的机制。
1.3 CCR8生物标志物指导的精准治疗
本研究首次在胰腺癌中验证了CCR8表达水平与联合治疗疗效的相关性。CCR8高表达患者的ORR 33.3%(n=9),明显高于整体患者的疗效数据,虽样本量小但效应值亮眼。这提示未来可通过免疫组化或基因检测筛选优势人群,实现个体化治疗。这种生物标志物驱动的研究设计,为突破胰腺癌免疫治疗瓶颈提供了关键线索。若后续研究证实CCR8表达可预测疗效,将推动胰腺癌进入"靶向免疫微环境"的精准治疗时代。同时,未来应探索CCR8与PD-L1表达、KRAS特定突变亚型及TMB水平等其他生物标志物的联合应用价值,以建立多维度预测模型。
除生物标志物外,患者的一般状况、既往治疗史等也可能影响治疗效果。不同的胰腺癌分子分型,如经典型、基底型等,对该联合治疗的反应也可能不同。未来需开展大规模、多中心的研究,综合分析各种因素,精准识别出能够从CCR8联合抗PD-1治疗中显著获益的人群,实现胰腺癌的精准治疗。
1.4安全性管理的核心关注点
在安全性方面,76名患者(95.0%)报告了治疗相关不良事件(TRAEs) 。常见的TRAEs(≥25%)包括AST升高、ALT升高、贫血、皮疹、发热、血小板计数降低和结合胆红素升高。42 名患者(52.5%)发生了≥3级TRAEs,最常见的事件(≥5%)是脂肪酶升高(7.5%)、ALT 升高(6.3%)、AST升高(5.0%)、免疫性小肠结肠炎(5.0%)、低钾血症(5.0%)和皮疹(5.0%)。在处理这些不良反应时,应根据不同的症状和严重程度采取相应措施。其中,需要重点关注肝毒性(ALT/AST升高≥3级 6.3/5.0%)及免疫性肠炎(5.0%),需建立预防性监控体系,建议临床应用中基线评估肝损伤风险,监测肝酶。皮疹(≥3级 5.0%),可能与Treg清除后免疫激活相关,需及时干预避免治疗中断。脂肪酶升高(7.5%)作为胰腺特异性毒性,需在临床实践中加强胰腺功能监测。CCR8联合抗PD-1治疗方案整体安全性可控,支持该方案在临床中的进一步推广。
创新性破解免疫耐药机制:从"冷肿瘤"到"热肿瘤"→靶向肿瘤微环境Treg的破冰尝试→CCR8
胰腺癌通常被认为是“冷肿瘤”,其肿瘤微环境中免疫细胞浸润少,免疫抑制强。Tregs在其中发挥了关键的免疫抑制作用。CCR8作为Tregs特异性趋化因子受体,对Tregs介导的免疫抑制具有显著影响,其表达水平与肿瘤免疫抑制微环境及不良预后显著相关。LM-108作为抗CCR8单克隆抗体,通过Fc段改造实现对肿瘤浸润Tregs的选择性清除,同时避免外周Tregs耗竭,将“冷肿瘤”微环境向“热肿瘤”转化,增加免疫细胞浸润,为免疫治疗创造有利条件。同时,这一设计显著降低了传统Treg清除策略的免疫毒性风险,为实体瘤免疫治疗提供了全新思路。
PD-1抑制剂通过解除效应T细胞的免疫耗竭状态发挥作用,但在胰腺癌中,除外dMMR人群,单独使用PD-1抑制剂在晚期胰腺癌中多数效果不佳,其主要原因之一在于胰腺癌的免疫抑制微环境阻碍了其发挥作用。PD-1抑制剂联合LM-108后,LM-108通过清除抑制性Tregs重构免疫微环境,打破了这种免疫抑制,使得PD-1抑制剂能够更好地激活效应T细胞,发挥抗肿瘤作用,即两者形成"解除刹车+激活引擎"的协同效应。本研究中的疗效数据显著优于历史数据,印证了这一机制的临床价值。且本研究入组患者中,14名患者(17.5%)既往曾接受过PD-1抑制剂治疗。这一调控机制为胰腺癌免疫治疗带来了新的希望,未来可深入研究该过程中具体的分子机制和信号通路,进一步优化治疗策略。
同类靶点竞争格局
CCR(C-C趋化因子受体)系列靶点作为GPCR超家族的重要成员,在多种生理和病理过程中扮演核心角色,特别是在免疫细胞迁移、炎症反应、肿瘤微环境调控、组织修复等方面[4]。其作为药物靶点的前景非常广阔,但也伴随着挑战。
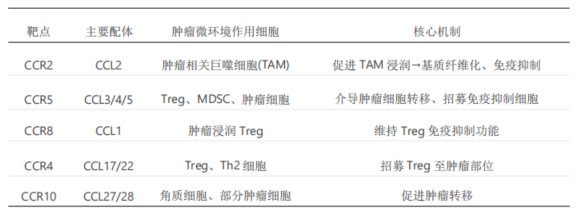
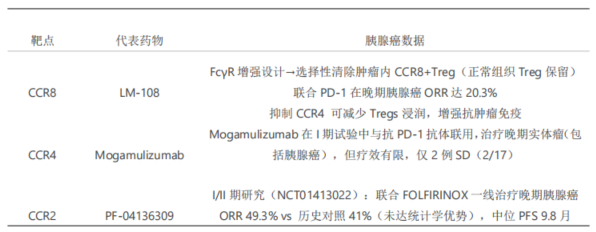
除外CCR8,其他CCR家族成员在肿瘤免疫微环境中也发挥关键作用。同类型CCR系列产品可能通过不同分子机制,调节肿瘤免疫微环境,发挥抗肿瘤作用。CCR8因直接清除Treg而非阻断招募,可能更具转化潜力。虽然目前研究主要聚焦于CCR8,但未来可探索其他CCR靶点的治疗潜力,以及不同CCR靶向药物之间联合应用的可能性。
结语
本研究的20.3%ORR与10个月OS数据如同胰腺癌免疫治疗领域的"破晓之光",首次证明靶向肿瘤浸润Treg可实质性逆转免疫耐药。尽管≥3级TRAEs发生率较高(52.5%),但毒性谱可监测、可管理。期待III期研究进一步验证该策略,推动胰腺癌进入"免疫微环境重塑"的新纪元。
周军教授-北京大学肿瘤医院
【温馨提示】:如果您觉得薛冉医生解读的好,请在下方为她点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
1. Andrea Wang-Gillam , Chung-Pin Li , György Bodoky , et al. Nanoliposomal irinotecan with fluorouracil and folinic acid in metastatic pancreatic cancer after previous gemcitabine-based therapy (NAPOLI-1): a global, randomised, open-label, phase 3 trial.Lancet.2016;387(10018):545-557.
2. Jiali Yu, Michael D Green, Shasha Li, et al.Liver metastasis restrains immunotherapy efficacy via macrophage-mediated T cell elimination. Nat Med.2021;27(1):152-164.
3. Zhenyu Luo, Mengshi Jiang, Ningtao Cheng, et al. Remodeling the hepatic immune microenvironment and demolishing T cell traps to enhance immunotherapy efficacy in liver metastasis. J Control Release. 2024:373:890-904.
4. Jan Korbecki , Szymon Grochans, Izabela Gutowska, et al. CC Chemokines in a Tumor: A Review of Pro-Cancer and Anti-Cancer Properties of Receptors CCR5, CCR6, CCR7, CCR8, CCR9, and CCR10 Ligands. Int J Mol Sci. 2020 ;21(20):7619.











 苏公网安备32059002004080号
苏公网安备32059002004080号


