手术特长:乳腺癌改良根治术,乳腺癌保乳手术,前哨淋巴结活检术,腋窝淋巴结清扫术,输液港置入、取出手术,腔镜下乳房切除术,假体置入,带蒂腹直肌皮瓣/背阔肌皮瓣乳房重建术,脂肪移植整形术等。
发表多篇学术论文
山东省抗癌协会肿瘤整形外科分会委员
山东省医学会中西医协同分会基层学组委员
山东省抗癌协会肿瘤整形外科分会青年委员会 委员
山东省青年医务工作者协会乳腺肿瘤多学科诊疗分会 委员
山东省医药教育协会肿瘤干细胞与耐药专业委员会委员
山东省抗癌协会近距离放射分会委员
青岛市抗癌协会乳腺专业委员会委员、秘书
青岛市健康科技学会乳腺专委会委员
青岛市抗癌协会肿瘤腔镜委员会委员
青岛市抗癌协会妇科肿瘤委员会常委
青岛市健康科普专家库成员
ASCO 解读文献
HER2-ADC trastuzumab rezetecan (SHR-A1811) in HER2-positive breast cancer with brainmetastases:Updated results from REIN trial
HER2-ADC瑞康曲妥珠单抗(SHR-A1811)治疗伴脑转移的HER2阳性乳腺癌:REIN试验的最新结果
摘要
研究背景
脑转移是乳腺癌,尤其是HER2阳性乳腺癌常见的远处转移部位之一,发生率高达30% - 50%,且预后极差,严重影响患者生存质量,中位总生存期(OS)仅1-2年。目前对于HER2阳性乳腺癌伴脑转移的系统治疗选择有限,传统化疗药物因血脑屏障的存在,颅内疗效不佳。近年来,HER2靶向治疗药物不断涌现,其中抗体药物偶联物(ADC)因其独特的机制,在HER2阳性乳腺癌伴脑转移的治疗中展现出良好前景。
研究目的
本研究旨在进一步探索SHR-A1811在HER2阳性乳腺癌伴脑转移患者中的疗效和安全性,为临床实践提供更充分的证据。具体包括:确定SHR-A1811单药及联合贝伐珠单抗治疗HER2阳性乳腺癌伴脑转移患者的颅内客观缓解率(ORR-IC)、无进展生存期(PFS)等 疗效终点,评估其安全性指标,并探索潜在的生物标志物与疗效的相关性。
方法流程
REIN试验是一项两队列、多臂、II期研究。队列A纳入HER2阳性乳腺癌伴脑转移患者,队列B则纳入HER2低表达乳腺癌伴脑转移患者。两队列均有SHR-A1811(6.4mg/kg)单药治疗组(臂1、臂4)以及SHR-A1811(4.8mg/kg)联合贝伐珠单抗治疗组(臂3、臂5),队列A还包括了SHR-A1811(4.8mg/kg)联合吡咯替尼(320mg/天)治疗组(臂2)。研究的主要终点为颅内客观缓解率(ORR-IC),关键次要终点包括无需立即局部放疗的活性脑转移灶比例、无进展生存期(PFS)、总生存期(OS)和安全性。
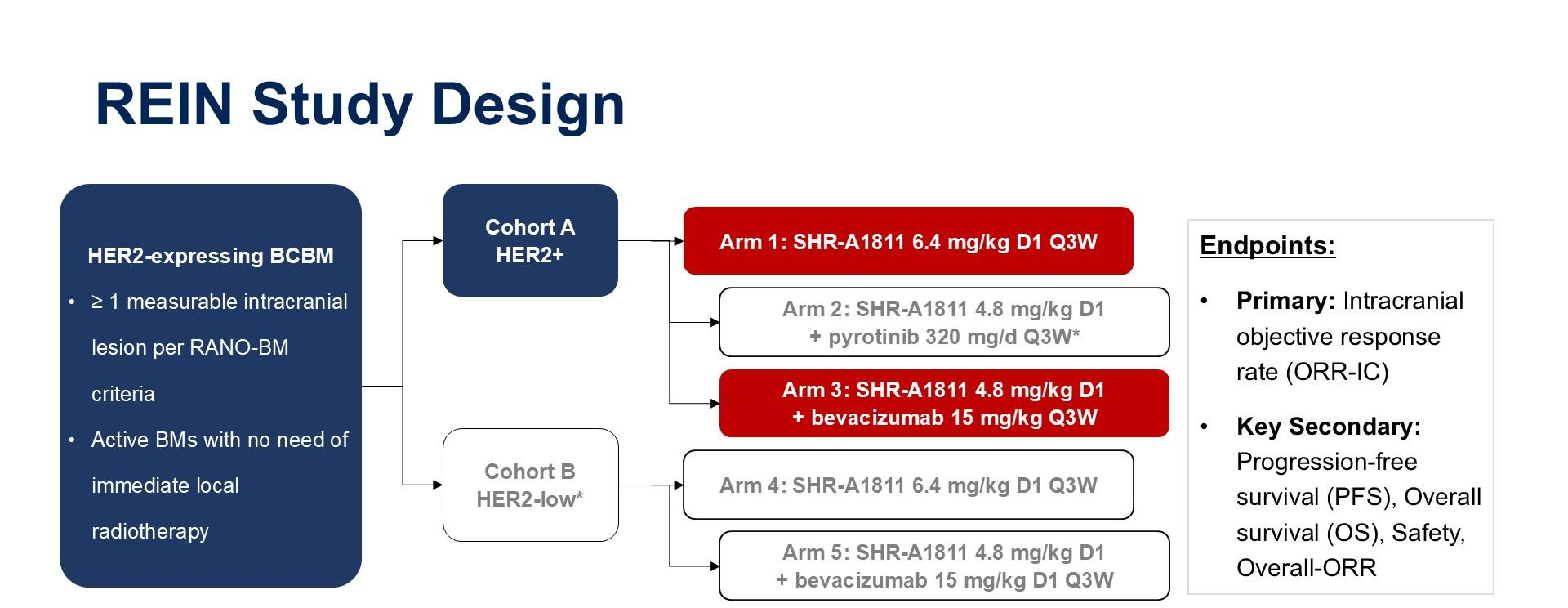
研究结果及结论
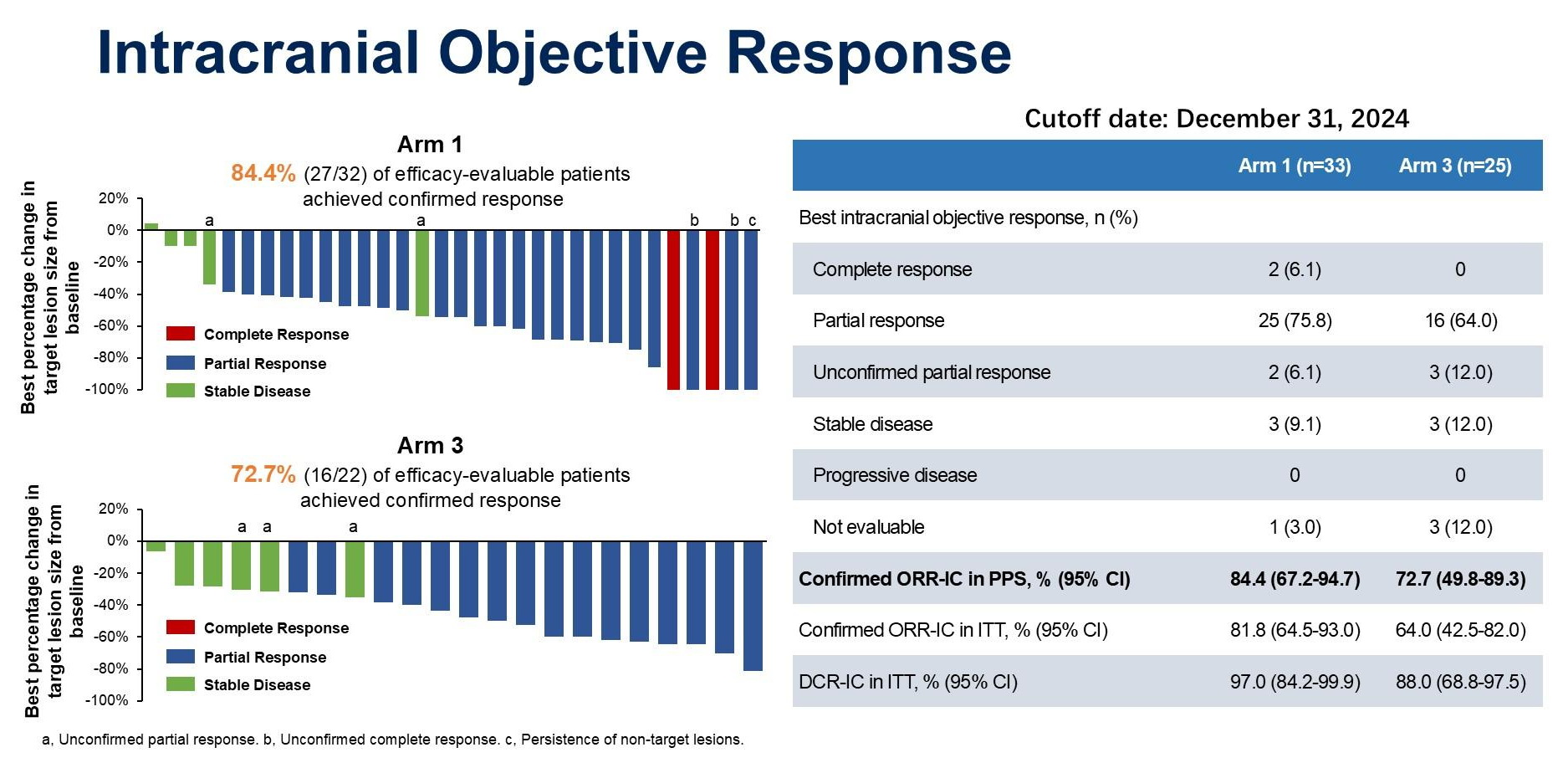
1.对于颅内疗效(ORR-IC):
臂1(SHR-A1811单药组)在32例可评估疗效的患者中,确认的ORR-IC高达84.4%(27/32),其中完全缓解(CR)2例(6.1%),部分缓解(PR)25例(75.8%);臂3(SHR-A1811联合贝伐珠单抗)在22例可评估疗效的患者中,确认的ORR-IC为72.7%(16/22),PR 16例(64.0%)。
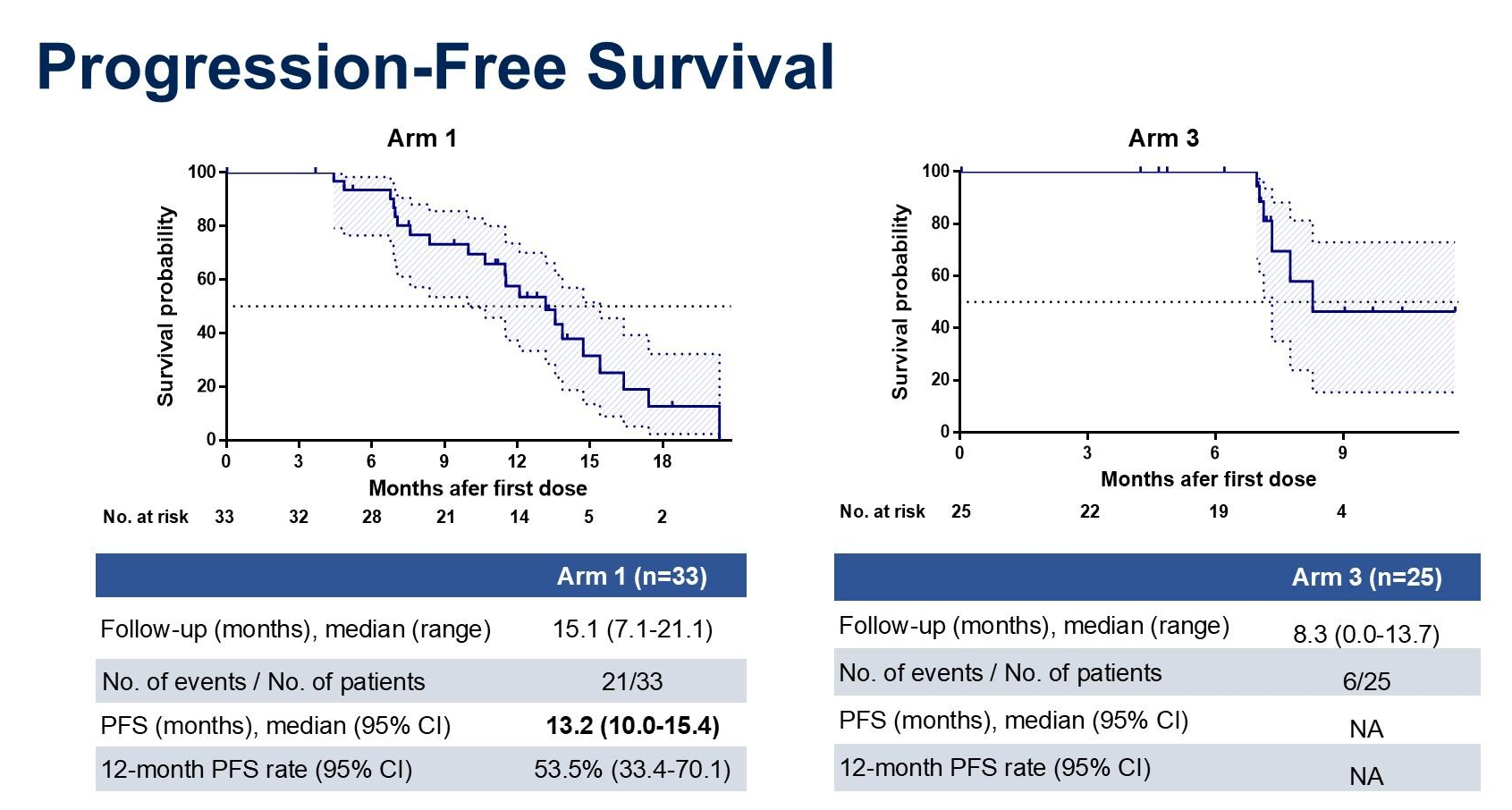
2. 对于生存数据(PFS):
臂1中位随访15.1个月,中位PFS为13.2个月(95% CI:10.0 - 15.4),12个月PFS率为53.5%(95% CI:33.4% - 70.1%);臂3中位随访8.3个月,PFS数据尚未成熟。
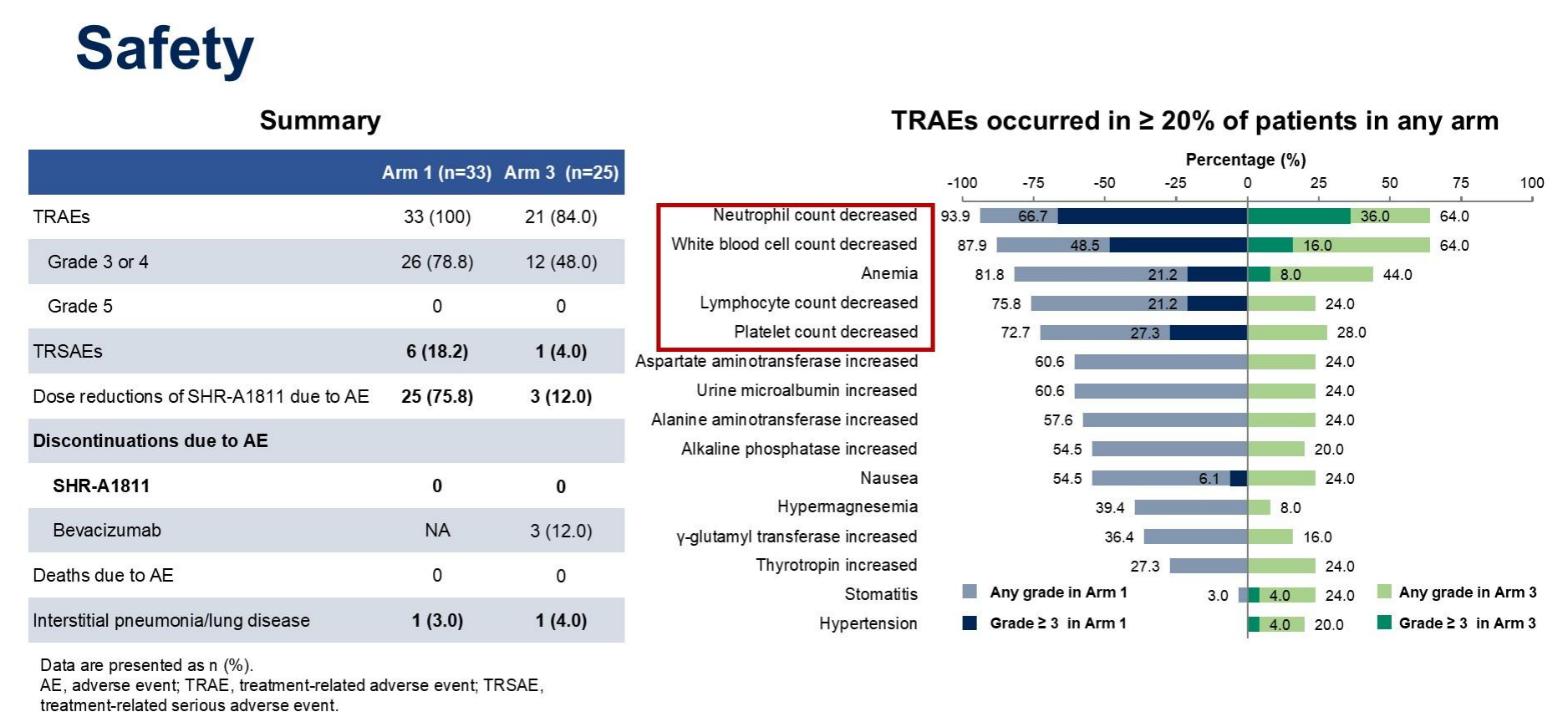
3. 对于安全性(Safety):
SHR-A1811治疗相关的不良事件(TRAEs)发生率较高,但大多可控。在臂1中,≥3级的TRAEs主要包括中性粒细胞减少(93.9%)、白细胞减少(78.8%)、贫血(81.8%)等。臂3中,≥3级的TRAEs发生率相对较低,如中性粒细胞减少(66.7%)、白细胞减少(87.9%)。
减量联合治疗方案(臂3)显示出更好的安全性,因不良事件(AE)导致的剂量调整和停药率较低。
解读
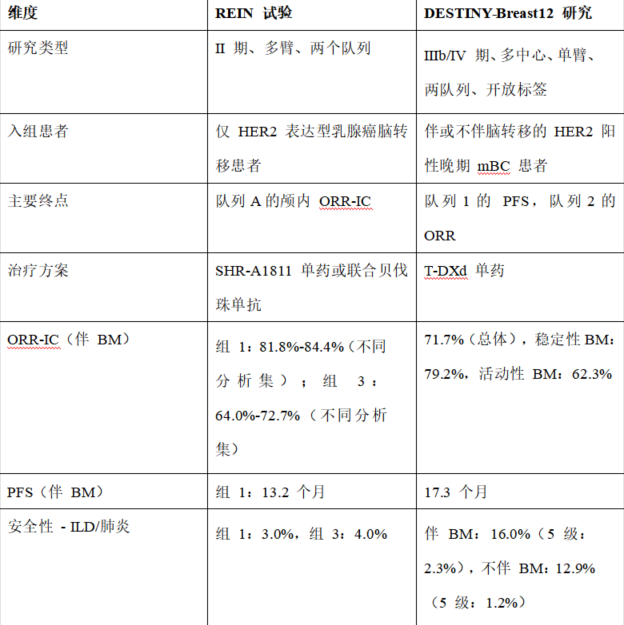
通过REIN试验与DB12试验的对比进行“五维”分析:
研究方法与设计维度:
2024年ASCO公布的DB12研究的入组设计,纳入了稳定和活跃的脑转移患者,同时也纳入基线无脑转移患者,入组人群广泛,更加贴近真实世界临床实践,其终点选择主要终点根据脑转移状态分层设定——对基线有脑转移患者,主要终点为12个月PFS率;对无脑转移患者,主要终点则为客观缓解率(ORR),这种分层设计充分考虑了疾病异质性的存在。而REIN研究则严格筛选HER2阳性或低表达乳腺癌患者,要求存在至少一个未经放疗的可测量颅内病灶(≥10 mm),这确保了入组人群的均质性和疗效评估的可靠性,其主要研究终点为颅内客观缓解率(ORR-IC),次要终点包括无进展生存期(PFS)、总生存期(OS)及安全性指标。选择ORR-IC作为主要终点,直接聚焦脑转移控制这一核心临床问题。
REIN研究的创新性设计亮点在于其联合治疗队列的设置。临床前研究表明,抗血管生成药物贝伐珠单抗可能通过血脑屏障调节增强ADC药物的颅内递送,这一设计探索了协同增效的科学假说,为未来联合策略提供了初步临床证据。然而,作为单臂Ⅱ期研究,其缺乏随机对照设计,证据级别受到一定限制;DESTINY-Breast12则凭借其大型前瞻性队列和严谨的终点设置,提供了更高级别的临床证据,但该研究未探索联合治疗方案,且在全球人群中的数据可能无法完全反映中国患者的特异性反应。

疗效数据解读维度:
REIN研究单药队列中84.4% 的颅内客观缓解率(ORR-IC)和97.0% 的疾病控制率(DCR-IC),意味着几乎所有患者都从治疗中获益,中位无进展生存期(mPFS)达13.2个月,这一数据在晚期多线治疗患者中尤为突出,而联合队列中尽管ORR-IC略低于单药组(72.7%),但其DCR-IC仍高达88.0%,特别值得关注的是,这些优异数据是在高度难治人群中取得的——入组患者中位既往治疗线数达3线,意味着大多数患者已用尽传统治疗手段,这进一步凸显了SHR-A1811的治疗潜力。而DB12研究在基线脑转移患者中,12个月PFS率达61.6%,中位PFS预计超过14个月,颅内特异性PFS(CNS-PFS)12个月率为58.9%,表明药物对脑部病灶的控制与全身控制相当,在脑转移活跃和稳定患者中,疗效一致(活跃组12个月PFS率为59.6%,稳定组为62.9%),解决了临床关于“活动性脑转移是否疗效差”的争议。
两项研究的生存曲线特征差异可能反映了药物作用机制的微妙区别:SHR-A1811凭借其优化的药物抗体比(DAR=6)和强效拓扑异构酶I抑制剂载荷,可能产生更迅猛的肿瘤杀伤;而T-DXd则通过可裂解连接子和强旁观者效应,展现出持久的疾病控制。这些差异对临床决策具有重要启示:对于急需缓解症状的患者,ORR高的药物可能更合适;而对于追求长期稳定的患者,PFS优势的药物更具吸引力。
安全性特征维度:
间质性肺炎(ILD) 是HER2-ADC类药物共同关注的不良反应,DB12研究延续了T-DXd已知的间质性肺炎风险,在历史数据中报告10.5%-13.6% 的发生率,其中1.6%-2.7%为致死性事件;而REIN研究未报告新的安全性信号,整体间质性肺炎发生率仅3.2%,且无≥3级事件,这与SHR-A1811的连接子稳定性和毒素改造有关,降低了肺泡上皮细胞的非特异性摄取。
除了间质性肺炎(ILD) 不了反应外,SHR-A1811在血液学毒性表现出更高的中性粒细胞减少发生率(约25% ≥G3),这可能与其强效拓扑异构酶I抑制剂载荷相关。而T-DXd的血液学毒性相对较轻,但恶心/呕吐发生率更高。REIN研究中,联合贝伐珠单抗组未报告预期外出血或高血压风险增加,但长期使用的安全性仍需观察。
作用机制与生物标志物探索维度:
从药物设计角度来讲,SHR-A1811采用可裂解连接子,但通过优化氨基酸序列增强了血浆稳定性,降低脱靶毒性。此外,SHR-A1811的药物抗体比(DAR=6)高于T-DXd(DAR≈4),提升了瘤内药物浓度,同时其毒素具有适度膜渗透性,可在异质性肿瘤中产生更强的“旁观者效应”。综上,SHR-A1811的高DAR值和增强的血脑屏障穿透能力,可能使其在颅内病灶中达到更高有效浓度,这也解释了REIN研究中获得了更好的颅内客观缓解率(ORR-IC)的原因。
有研究显示,对HR阴性肿瘤来说,SHR-A1811的疗效与CD8+T细胞浸润密度及肿瘤-免疫细胞空间邻近性密切相关,而对HR阳性肿瘤,其治疗效果则取决于HER2强阳性细胞的空间分布模式。这些特征揭示了肿瘤微环境的空间构象对ADC药物疗效的关键影响,提示其为新一代ADC药物特有的预测标志物。
研究的临床价值及未来展望维度:
基于当前研究数据作为依据,我们可以提出如下用药建议:首先,对于活动性脑转移患者,可优先考虑SHR-A1811单药治疗,因其高ORR-IC(84.4%)可快速缓解神经系统症状;其次,对于稳定脑转移患者,可优先选择T-DXd,其在长期疾病控制(12个月CNS-PFS率58.9%)方面数据较为成熟;再者,对于高瘤负荷伴脑水肿患者,可考虑SHR-A1811联合贝伐珠单抗,其潜在的抗血管效应可能减轻水肿并增强药物递送;最后,对于合并肺间质病变患者,可优先选择SHR-A1811 ,其ILD风险仅3.2%。
两项研究均存在局限,REIN研究的Ⅱ期单臂设计和较小样本量,需要Ⅲ期随机对照试验验证;DB12 的亚组分析未提供亚洲人群特异性数据。未来研究方向有应聚焦在最佳测序策略:ADC药物与放疗、TKIs的合理排序,尝试探索新型联合方案,如ADC+免疫检查点抑制剂在HER2阳性脑转移中的应用等。
王启堂教授—康复大学青岛中心医院
乳腺癌是女性最常见的恶性肿瘤之一,其中HER2阳性亚型约占15-20%,具有侵袭性强、易复发转移的特点。在所有复发转移性乳腺癌中,脑转移的发生尤为棘手—约占30-50%的HER2阳性转移性乳腺癌患者会发生脑转移,这不仅严重影响患者生活质量,也极大缩短了患者的生存期。长期以来,脑转移患者的系统性治疗选择极为有限,传统治疗主要依赖手术、放疗和血脑屏障穿透性有限的小分子酪氨酸激酶抑制剂(TKIs),治疗效果欠佳。
抗体偶联药物(ADC)的崛起正在改变这一困境。这类创新药物通过精准连接靶向抗体与高效细胞毒性药物,实现了对肿瘤细胞的精准打击。德曲妥珠单抗(T-DXd, DS-8201)作为先驱,已在HER2阳性乳腺癌脑转移治疗中展现出初步疗效。而我国自主研发的新一代抗HER2 ADC药物瑞康曲妥珠单抗(SHR-A1811),在2025年ASCO年会上公布的REIN研究数据引起了广泛关注。
数据截止至 2024年12月31日,组 1(n=33)中经确认的 ORR-IC 在 PPS(符合方案集)中为 84.4%(95% CI:67.2-94.7),在 ITT(意向性治疗)中为 81.8%(95% CI:64.5-93.0);组 3(n=25)中经确认的 ORR-IC 在 PPS 中为 72.7%(95% CI:49.8-89.3),在 ITT 中为 64.0%(95% CI:42.5-82.0)。组 1(n=33)中位随访时间 15.1 个月,中位 PFS 为 13.2 个月(95% CI:10.0-15.4),12 个月 PFS 率为 53.5%(95% CI:33.4-70.1);组 3(n=25)中位随访时间 8.3 个月,中位 PFS 尚未成熟,12 个月 PFS 率也未明确。
不良反应发生方面,SHR-A1811在非血液学毒性尤其是ILD方面具有优势,而T-DXd在血液学毒性管理上稍显轻松。临床选择需权衡患者个体情况——对于肺功能不佳者,SHR-A1811更安全;而对于骨髓储备低下者,T-DXd可能更合适。
两项研究均观察到部分患者的原发耐药现象,首先,DESTINY-Breast12中基线无脑转移组ORR为62.7%3,低于REIN研究的颅内缓解率,可能反映了全身病灶与脑转移灶间的异质性差异;其次,REIN研究中联合贝伐珠单抗未显著提升疗效,提示血管正常化策略可能需要优化给药时序;最后,临床前模型显示PI3K/mTOR通路的过度活化可能削弱ADC药物的杀伤效果,这一机制在脑转移环境中可能更为突出。在复旦大学团队开发的人工智能预测模型在训练集中AUC达0.95,验证集达0.86,为个体化治疗提供了实用工具,这一模型同样适用于T-DXd的疗效预测(AUC>0.8),表明不同ADC药物可能共享某些耐药机制。
作为见证乳腺癌治疗变革的临床医生,我深切感受到从“无药可用”到“百花齐放”的进步。REIN研究展现了中国创新药物的巨大潜力,其高颅内缓解率和可控安全性,为HER2阳性乳腺癌脑转移患者带来了新希望。而DESTINY-Breast12则巩固了ADC药物在脑转移治疗中的地位。两项研究共同推动乳腺癌脑转移治疗进入精准、高效的新时代,最终受益的将是全球每一位患者。
表1. REIN实验与DESTINY-Breast12 研究对比表
【温馨提示】:如果您觉得刘玉坤医生解读的好,请在下方为他点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!











 苏公网安备32059002004080号
苏公网安备32059002004080号


