胰腺癌素有“癌中之王”之称,其早期症状隐匿、侵袭性强,5年生存率不足10%,超过80%的患者确诊时已丧失手术机会。2025年美国临床肿瘤学会(ASCO)年会上,胰腺癌治疗领域佳音频传,围手术期治疗、一线治疗等多个研究方向均有重要成果公布,为全球胰腺癌临床实践提供了极具价值的参考与指引。
值此契机,本期特邀重庆大学附属人民医院王槐志教授与孙丕绛教授围绕围手术期治疗进展、一线治疗等热点话题进行深度专访,解析2025 ASCO前沿研究如何为临床实践注入新动力。
破局"癌王"!2025 ASCO 围手术期治疗三大突破性进展深度解析


在本次ASCO年会上,您认为胰腺癌围手术期治疗领域有哪些值得关注的研究?这些研究的亮点分别是什么?
王槐志 教授:在本次 ASCO 年会上,胰腺癌围手术期治疗领域的多项研究令人瞩目。
PAXG方案有望树立胰腺癌生存新标杆
在LBA口头报告环节,意大利的一项III期研究比较了术前mFOLFIRINOX(5-氟尿嘧啶+伊立替康+奥沙利铂)或PAXG(卡培他滨+顺铂+白蛋白紫杉醇+吉西他滨)化疗方案在I-III期可切除或临界可切除胰腺导管腺癌(PDAC)患者的应用[1]。主要终点为无事件生存期(EFS),PAXG组的mEFS为16.0个月,显著优于mFOLFIRINOX组的10.2个月;3年EFS率达31%,显著优于mFOLFIRINOX组的13%,HR为 0.64(p=0.003)。次要终点方面:PAXG组和mFOLFIRINOX组的中位总生存期(OS)分别为37.3个月、26.0个月(未成熟数据),PAXG组患者血清肿瘤标志物CA19-9降幅超过50%的比例显著更高(88% vs 64%,p<0.001),尽管两组在手术切除率上未观察到统计学显著差异(75% vs 67%,p=0.16),但这项研究首次在III期试验中证实了PAXG方案对可手术胰腺癌的生存优势,为个体化新辅助治疗提供了高级别证据。


化疗“前移”保障治疗完整性
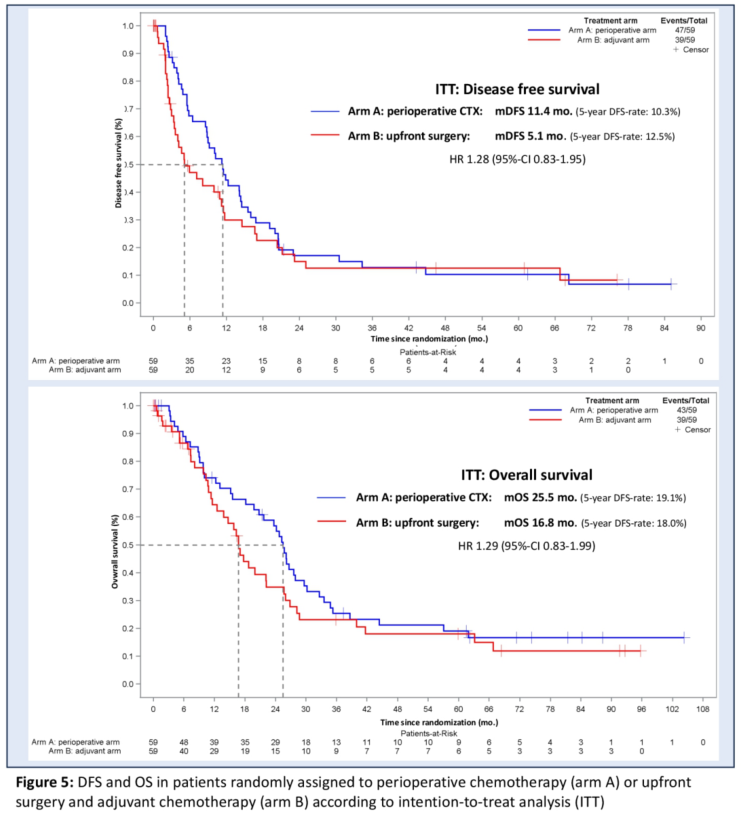
德国AIO胰腺癌研究组的II期随机试验——NEONAX研究5年随访揭示对于可切除胰腺癌,新辅助化疗可提高治疗完成率,避免术后因并发症无法化疗的风险[2]。在ITT人群中,接受吉西他滨联合白蛋白紫杉醇(AG)围手术期治疗(术前2周期+术后4周期)的患者中位OS达25.5个月,高于单纯辅助治疗组的16.8个月(术后6周期),延长近9个月;中位无病生存期(DFS)同样具有优势(11.4个月 vs 5.1个月)。产生生存差异的主要因素是治疗完成率,围手术期组91.5%患者凭借新辅助阶段84.7%的高完成率,使更多患者获得足量化疗,而辅助组因术后并发症等因素,只有42.4%患者启动术后辅助治疗,最终仅25%患者完成全部6周期化疗。值得注意的是,当分析实际接受化疗的mITT人群时,两组生存差异消失(围手术期组中位OS 27.9个月 vs 辅助组26.8个月),印证了治疗完整性对疗效的决定性作用。研究同时发现围手术期策略能提升手术根治性(R0切除率88% vs 67%),且其获益不受肿瘤大小、淋巴结状态或CA19-9水平影响。该研究结果为治疗模式转型提供了强有力依据,仍需更大规模数据验证。当近半数患者因术后衰弱无法接受辅助化疗时,将化疗前移不仅是策略优化,更是对"手术优先"传统范式的优化。
肝脏寡转移手术可行性验证
德国的一项HOLIPANC试验在胰腺癌肝脏寡转移患者的治疗领域也取得了突破性进展[3]。该II期研究探索了NALIRIFOX方案新辅助化疗后联合根治性手术在胰腺癌肝脏寡转移患者中的安全性和疗效。77%患者接受≥4个周期和29%患者接受8个周期的NALIRIFOX方案新辅助治疗。56例患者中,有36%(20/56)的患者成功实现了原发灶及转移灶的切除。术后并发症发生率为35%,其中仅有10%属于≥3级并发症。在安全性方面,≥3级治疗相关不良事件(TRAEs)发生率为54%,常见的不良事件包括腹泻(8.9%)和呕吐(7.1%)。
该研究的亮点在于证实了针对胰腺癌肝脏寡转移患者采用“新辅助化疗+手术”的多模式治疗策略的可行性,且其不良反应的毒性谱与NAPOLI 3研究中公布的数据相比并未升高,同时并未因联合手术治疗而显著增加额外的风险,这为胰腺癌肝脏寡转移患者的临床治疗提供了新的思路和选择。


重庆大学附属人民医院肝胆胰腺外科作为国家临床重点专科,团队年胰腺癌根治术完成量位列全世界前十,能否分享您团队在胰腺癌诊疗中的特色经验?
王槐志 教授:重庆大学附属人民医院肝胆胰外科团队在围手术期治疗方面积累了丰富经验,通过全程标准化管理、手术质控管理和长期随访机制三大策略的有机整合,为患者提供与国际水平同步的高质量医疗服务。首先,在全程标准化管理方面,团队始终秉持全程同质化管理理念,精心设计一系列同质化方案,涵盖手术方案、化疗用药及并发症处理,通过全科讨论决策以确保治疗的一致性。在具体实施中,团队也注重方案的标准化与灵活性相结合,标准化方案为医生提供明确指导,保障治疗过程的规范性和一致性;同时,团队鼓励医生不断学习国内外新进展,及时更新方案,以保持与国际一流水平同步。其次,团队特别重视手术质量的把控,每位医生都必须接受严格标准化培训,术中设有严格的质控标准,对手术过程进行监控,术后通过复盘与优化,以确保团队手术质量达到最优。此外,团队还建立了完善的随访制度,由专职科研助理全程跟踪治疗节点,及时提醒患者进行各项检查和治疗,长期随访机制保障了患者可获得全方位的照顾和长期的生存获益。


作为重庆大学附属人民医院大外科主任、肝胆胰研究所所长,您认为胰腺癌诊疗未来需重点关注哪些方向?
王槐志 教授:胰腺癌作为一种恶性程度极高的肿瘤,单纯依靠手术或药物治疗都难以实现患者的长期生存。因此,多学科团队的合作至关重要。未来,团队将继续加强与其他学科领域的专家合作,包括内科、放疗科、免疫治疗科等,共同探索更加有效的综合治疗方案。团队将致力于将手术与内科治疗相结合,充分发挥各自的优势,以期达到更好的治疗效果。外科医生需掌握内科进展比如靶向治疗或免疫治疗等,践行"优秀外科医生是优秀内科医生加灵巧双手"理念。同时,团队也将关注胰腺癌的早期诊断和精准治疗。通过深入研究早期诊断标志物和生物标志物检测等技术,实现对胰腺癌的早期发现和精准分层治疗。这将有助于提高患者的生存率和生活质量,为胰腺癌患者带来新的希望。
一线治疗新纪元
NALIRIFOX方案引领胰腺癌精准分层


在本次ASCO年会上,您认为胰腺癌围手术期治疗领域有哪些值得关注的研究?这些研究的亮点分别是什么?
孙丕绛 教授:在本次 ASCO 年会上,胰腺癌围手术期治疗领域确实有不少值得关注的研究。
NALIRIFOX方案中国数据亮眼
我们团队牵头的一项NALIRIFOX 方案治疗临界可切除胰腺癌(BRPC)及局部进展期胰腺癌(LAPC)的真实世界研究展现出良好的应用前景[4]。胰腺癌是一种侵袭性强、预后极差的恶性肿瘤,仅约10-15%的初诊患者具备直接手术条件,尽管新辅助治疗被证实可提升BRPC及LAPC患者的根治切除机会,但目前仍缺乏标准化疗方案。为此,我们探索了四药联合方案——NALIRIFOX方案(伊立替康脂质体+奥沙利铂+亚叶酸钙+5-氟尿嘧啶)在胰腺癌围手术期的应用价值。
研究共纳入了15例确诊为胰头癌的患者,包括12例BRPC与3例LAPC,并采用围手术期 NALIRIFOX方案进行治疗,即新辅助治疗和辅助治疗各4个周期。初步结果令人鼓舞,NALIRIFOX方案在提高患者手术成功率及改善手术切除效果方面表现卓越:有86.7%(13/15)的患者成功接受根治手术,其中R0切除率高达92.3%(12/13),显著高于传统方案。在治疗效果方面,新辅助治疗后的客观缓解率(ORR)达到了86.7%,疾病控制率(DCR)更是达到了100%。此外,术后9个月的DFS率为92.3%,1年DFS率为84.6%。在安全性方面,主要出现的≥3级不良事件为腹泻(13.3%)和中性粒细胞减少(6.7%),未出现治疗相关死亡。
这项真实世界研究有力地证实:在中国BRPC与LAPC患者中,围手术期应用NALIRIFOX方案展现出了令人鼓舞的手术转化潜力,且耐受性良好。尽管无进展生存期(PFS)与OS数据未成熟,但当前92.3%的R0切除率与84.6%的1年DFS率,为BRPC与LAPC患者患者提供了新的治疗希望。当然,最终的手术转化率以及关键的生存数据和缓解率仍在持续随访评估中,我们将密切随访并及时分享后续的结果。
同时,中国另一家中心正在开展一项 NALIRIFOX 方案治疗局部进展期胰腺癌(LAPC)的 II 期研究[5]。目前入组了20例符合条件的LAPC患者。初步结果令人欣喜:研究主要终点为手术转化率,有9例患者(占45%)成功接受了根治性手术切除。更重要的是,所有手术患者都实现了R0切除,R0切除率达到100%,ORR为35.0%,DCR达到75.0%。PFS和OS尚未达到。在安全性方面,≥3级TEAEs发生率为60%(12例),有15%的患者(3例)需要减量治疗,没有出现因TRAEs导致的死亡。最常见的≥3级不良事件包括淋巴细胞减少(15%)、腹痛(10%)、中性粒细胞减少(10%)和关节痛(10%)。整体耐受性良好。这项II期研究的初步结果表明,NALIRIFOX方案在局部进展期胰腺癌患者中展现出有前景的疗效和和良好的耐受性,为部分原本无法手术的患者带来了新的曙光,使他们有机会获得根治性手术。


本次ASCO年会上,胰腺癌一线治疗领域,有哪些研究引起了您的关注或令您印象深刻?
孙丕绛 教授:随着分子生物学技术的不断进步,靶向药物以及免疫检查点抑制剂(ICI)等新型抗肿瘤药物的出现,为部分胰腺癌患者带来新的曙光,胰腺癌治疗领域正经历着令人振奋的变革,一线治疗方案日益丰富。本次ASCO年会上,有多项研究给我留下了深刻印象。
NAPOLI 3研究推动精准分层
经典的NAPOLI 3研究证实了NALIRIFOX方案在转移性胰腺导管腺癌(mPDAC)中实现了生存获益的突破,与吉西他滨联合白蛋白紫杉醇(AG)方案相比,显著延长了患者的中位总生存期(11.1个月 vs 9.2个月,HR=0.83)和无进展生存期(7.4个月 vs 5.6个月,HR=0.69)[6]。这一结果确立了其作为体能状态良好(ECOG PS 0-1)患者一线标准治疗的地位,并成为其被纳入2024版中国临床肿瘤学会(CSCO)胰腺癌诊疗指南作为II级专家推荐(1A类证据)的核心依据。
本次ASCO公布的长期生存者特征进一步丰富了我们对NALIRIFOX方案疗效的理解[7]。看到这些长期生存者(≥18个月)的数据(基于北美人群,n=15),尤其是中位总生存期达到19.5个月,远超整体人群,证明部分患者可实现明显获益,这在胰腺癌治疗中是相当鼓舞人心的结果;尽管其中66.7%存在肝脏转移、53.3%有≥3个转移灶(提示高肿瘤负荷),但多数患者具备年龄较轻(中位61岁)、CA19-9水平较低(中位166.8 U/mL)以及ECOG PS 0分占比高(53.3%)等良好临床特征。在用药剂量方面,很大比例的长期生存者经历了伊立替康脂质体和奥沙利铂的剂量降低或治疗延迟,但对两种药物均有较长的暴露时间和较高的累积剂量,提示个体化剂量调整对维持治疗至关重要,并为患者筛选提供了线索:即年轻、低CA19-9水平和良好体能状态的患者更可能从治疗中获益。
因此,NAPOLI 3研究最终数据进一步验证了NALIRIFOX方案的生存优势,其对长期生存者特征的分析,为个体化治疗提供新的视角与方向,助力我们向"延长生存"与"精准分层"的双重目标迈进。
肿瘤电场治疗破局晚期患者
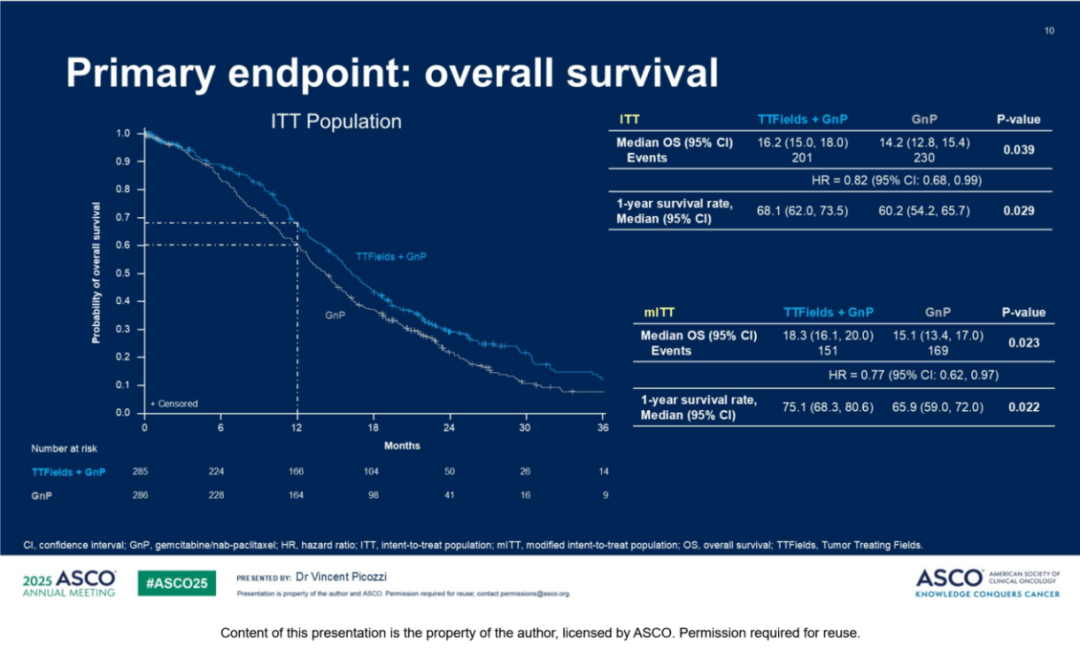
本次ASCO年会中,III期临床试验PANOVA-3首次在局部晚期胰腺导管腺癌(LAPC)领域实现了历史性突破——通过肿瘤电场治疗(TTFields)联合标准化疗(吉西他滨+白蛋白紫杉醇,AG),显著延长了患者OS[8]。中位OS从单纯化疗组的14.2个月提升至16.2个月(HR=0.82, p=0.039),虽然绝对值提升2个月,但在胰腺癌这种治疗难度极高的癌种中,任何具有统计学意义的生存改善都具有里程碑意义。值得一提的是,这种生存获益并未伴随全身毒性的显著增加,主要不良反应为设备相关的轻中度的皮肤不良事件。肿瘤电场治疗通过150kHz交变电场物理性干扰癌细胞有丝分裂,其独特的作用机制与传统化疗形成互补。这种协同效应在远处转移控制上表现尤为突出(中位distant PFS 13.9 vs 11.5个月, HR=0.74, p=0.022),提示该疗法可能通过抑制微转移灶延缓全身扩散。而无疼痛生存期翻倍式提升(15.2 vs 9.1个月, p=0.027)对晚期患者生活质量具有重大意义,这很可能源于电场对局部肿瘤的持续抑制作用减轻了神经浸润和腹膜后侵犯。
亮点评价:PANOVA-3 是目前唯一的一项在不可切除局部晚期胰腺癌中显示显著OS获益的Ⅲ期临床试验,确立了肿瘤电场治疗联合AG方案作为LAPC新标准治疗的潜力。尤其对于体能状态良好但无法手术的患者,该方案提供了延长生存期同时维持生活质量的新选择。

靶向治疗初显潜力
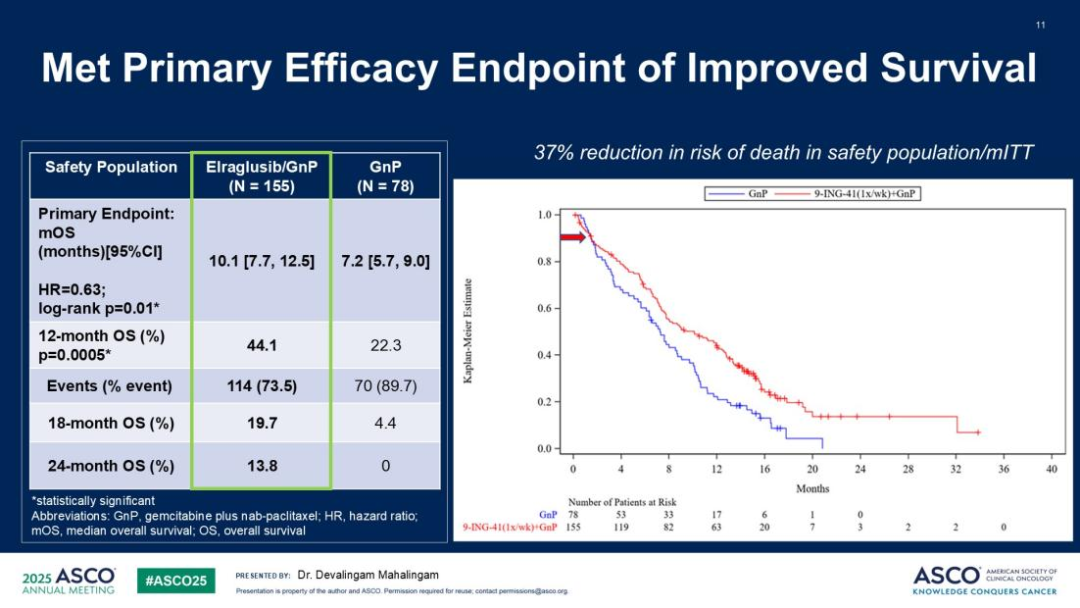
一项II期随机研究探索了新型GSK-3β抑制剂elraglusib联合AG方案在初治mPDAC中的疗效,初步结果令人鼓舞[9]。与单用AG相比,联合治疗组显著延长了患者生存期,中位OS从7.2个月提升至10.1个月(HR=0.63,p=0.01),1年OS率近乎翻倍(44.1% vs 22.3%)。值得注意的是,尽管无进展生存期未达统计学差异(5.6 vs 5.1个月,HR=0.91),但疾病控制率(61.3% vs 56.4%)和客观缓解率(29.0% vs 21.8%)具有改善趋势。安全性方面,elraglusib的加入主要增加了≥3级中性粒细胞减少(52.2% vs 30.8%)和一过性视觉障碍,整体耐受可控。
亮点评价: 这项研究初步证实了靶向GSK-3β通路在mPDAC治疗中的临床价值。elraglusib带来的生存获益虽属中等,但对五年生存率不足3%的mPDAC而言,任何生存突破都意义重大。
整体而言,这些研究不仅为胰腺癌患者带来了新的治疗选择,也让我们看到了胰腺癌治疗领域充满希望的未来。随着研究的深入和技术的不断进步,我们相信,胰腺癌的治疗将变得更加精准、高效,从而显著提升患者的生活质量。未来,我们需要继续加强多学科合作,推动更多高质量的临床研究,以探索出最适合胰腺癌患者的个体化治疗方案。目前,一线治疗仍以化疗(NALIRIFOX方案或AG方案)为主,而靶向治疗和免疫治疗正通过联合策略逐步融入一线治疗框架。未来应基于分子分型和生物标志物检测等,实现“精准分层”的定制化联合方案,以突破生存瓶颈。
结 语
2025 ASCO年会见证了胰腺癌诊疗的重大突破:从意大利III期研究探索PAXG方案生存新标准,德国NEONAX研究验证化疗"前移"价值,到HOLIPANC试验开创肝脏寡转移手术新路径;王槐志教授与孙丕绛教授牵头的NALIRIFOX真实世界研究更以86.7%手术转化率展现中国智慧,这些研究为胰腺癌的临床治疗提供了新的证据和思路。未来,胰腺癌治疗的发展方向将聚焦于精准医疗、新型药物研发、多学科合作以及新型治疗技术的融合,征服“癌中之王”需要我们持续深耕多学科协作,探索更高效的综合治疗策略,为胰腺癌患者带来更多的希望和更好的生活质量。
专家简介
重庆市医学科学院副院长
肝胆胰疾病智慧诊疗工程重庆市重点实验室主任
重庆大学附属人民医院(重庆市人民医院)大外科主任、肝胆胰外科研究所所长
国家重点研发计划首席科学家、享受国务院特殊津贴专家、重庆市外科学会(一级学会)会长
国际胰腺病协会(IAP)理事、国际胰腺病协会学术顾问委员会终身顾问
亚太地区胰腺病协会(AOPA)理事、2020亚太地区胰腺病协会年会主席
世界内镜协会消化外科联盟副理事长兼重庆地区理事长、中国抗癌协会理事
中华医学会胰腺外科学组委员、中国胰腺疾病大数据中心(CPDC)指导委员会专家
国家基金二审评委、国家肿瘤质控中心专家委员会委员、省部级干部及两院院士保健专家
国家远程医疗互联网医学中心肝胆胰外科专家委员会(重庆)联席主席
重庆市首批医学领军人才、重庆市学术技术带头人、重庆市英才.创新领军人才
重庆市首席专家工作室领衔专家(肝胆胰腺外科)、重庆市首席技能大师(肝胆胰腺外科)
重庆市委直接联系专家、重庆市医学会肝胆胰外科专业委员会第六届主任委员
重庆市医学会外科学分会副会长、重庆市医师协会肝胆外科分会副会长
重庆市抗癌协会副理事长、胰腺癌专业委员会主任委员、重庆名医∙卓越建树奖获得者
重庆市数字医学委员会常务理事、重庆市高级职称评审委员会一审、二审评委
美国/国际胰腺病协会2011-2015年年会胰腺癌专题主席
美国/国际胰腺病协会2010-2017、2019-2024年会“摘要遴选委员会”专家
Pancreas副编辑;Pancreatology编委;IJC审稿人
重庆大学附属人民医院(重庆市医学科学院)
副主任医师、硕士研究生导师、腹腔镜医疗组组长
中国研究型医院胰腺疾病疾病专委会微创学组青年委员
中国老年医学会公共健康服务分会委员
重庆市外科学会常务委员
第三届全国手术视频大赛山东及北方赛区第一名,全国总决赛二等奖
担任《中国普通外科杂志》中青年编委、《肝胆胰外科杂志》编委
《WORLD JOURNAL OF SURGICAL ONCOLOGY》杂志审稿人
[1] 2025 ASCO. Abstract LBA4004.
[2] 2025 ASCO. Abstract 4193.
[3] 2025 ASCO. Abstract 4172.
[4] 2025 ASCO. Abstract e16450.
[5] 2025 ASCO. Abstract e16382.
[6] Wainberg ZA, et al. Lancet. 2023 Oct 7; 402 (10409): 1272-1281.
[7] 2025 ASCO. Abstract LBA4175.
[8] 2025 ASCO. Abstract LBA4005.
[9] 2025 ASCO. Abstract 4006.
编辑 | 中国医学论坛报社 天之涯
本资料的内容仅作为科学信息参考,仅用于医疗卫生专业人士的学术交流,请勿用于任何其他用途。若您不是医疗卫生专业人士,请勿观看和/或传播此资料。
本资料可能会出现某些药品信息,但该药品/适应症可能尚未获得国家药品监督管理局的注册批准。医疗卫生专业人士做出的任何与治疗有关的决定应根据患者的具体情况并应参照国家药品监督管理局批准的药品说明书。对于本资料可能提到的相关诊断、治疗方法,请遵守国家卫生健康委员会以及相关部门批准使用的指南或规定。
本文转自:论坛报
排版编辑:肿瘤资讯-黄洋洋











 苏公网安备32059002004080号
苏公网安备32059002004080号


