肺癌治疗的关键在于精准识别驱动肿瘤生长的基因变异。本研究通过对1.3万例肺腺癌样本的大规模测序分析,创新性地利用"癌基因互斥性"原理,首次系统定义了HER2、KRAS和MET基因拷贝数扩增的临床相关阈值。这项近期发表于《Clinical Lung Cancer》的研究不仅揭示了高拷贝数扩增群体的独特基因特征,更为靶向治疗的精准筛选提供了重要依据。本文将从背景到结论完整解析这项具有临床转化价值的研究发现。
研究背景
基因拷贝数增益(CNG)作为连续变量,其临床相关阈值在非小细胞肺癌(NSCLC)中尚未明确。传统检测方法如FISH与新兴的NGS技术存在判定差异,而高阈值可能筛选出真正依赖扩增驱动的肿瘤。既往研究表明,原发性致癌驱动基因通常互斥存在,这为通过癌基因重叠分析确定CNG阈值提供了理论依据。MET扩增已被证实与EGFR靶向治疗耐药相关,但HER2和KRAS扩增的临床意义仍存争议。本研究旨在通过大规模组织测序,建立基于癌基因互斥性的CNG判定标准,并探索其对生存预后的影响。
研究方法
研究回顾性分析了Caris生命科学数据库中的13,072例肺腺癌样本(含原发灶和转移灶),使用592基因panel或全外显子测序检测CNG。通过计算测序深度与基线值的比值确定拷贝数,将致病性融合/突变定义为驱动基因阳性。采用癌基因共现频率下降拐点结合样本量可行性设定CNG阈值,统计分析涵盖基因共突变模式、人口学特征及保险索赔来源的真实世界生存数据。
结果
1、HER2、KRAS和MET基因拷贝数增加与驱动基因共突变的频率降低相关
在13,072例肺腺癌中,10,681例来自原发灶,2,214例来自转移灶(177例注释不明确)。总体队列中65%存在致癌驱动突变。无法获得关于分期和治疗线/既往治疗的信息。针对HER2、KRAS和MET的基因拷贝数,分析了致癌驱动基因突变的发生率,纳入或排除扩增基因相关突变(图1A-C)。HER2、KRAS和MET的基因拷贝数范围从2到>7个拷贝(图1A-C),所有3个基因的高拷贝数均导致致癌驱动基因突变频率降低。
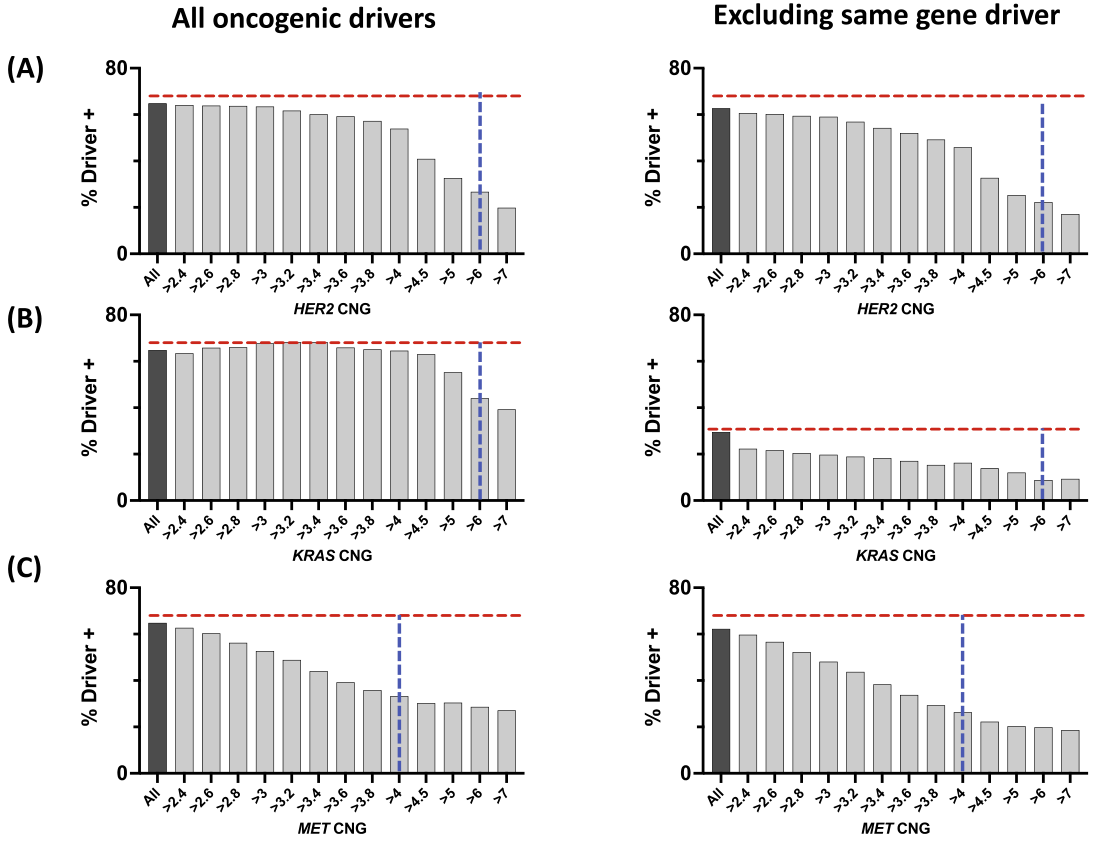
HER2 CNG肿瘤在拷贝数>4时显示癌基因突变重叠显著减少,无论是否包含同基因突变。在CNG≥6的阈值下,26.7%的HER2 CNG肿瘤为致癌驱动阳性,而CNG<6的肿瘤中平均65.2%为驱动阳性(图1A)。当排除HER2突变时,CNG≥6的HER2 CNG肿瘤中22.2%为驱动阳性(图1A)。
对于KRAS CNG肿瘤,绝大多数共突变是KRAS突变。在CNG≥6的肿瘤中,包含KRAS突变时44.0%病例为致癌驱动阳性,而CNG<6的肿瘤中65.0%为驱动阳性(图1B)。排除KRAS突变后,共发生的癌基因突变频率显著改变,与癌基因突变频率的关系变得更线性;排除KRAS突变后,8.8%的肿瘤为驱动阳性(图1B)。总体而言,排除同基因(KRAS)突变后,KRAS的驱动重叠频率随CNG增加而下降的幅度最低(与HER2或MET相比)(图1B)。
在MET CNG肿瘤中,CNG与致癌驱动因子共发生之间的关系在CNG>2.4以上呈半线性下降,然后在CNG>4左右趋于平稳(图1C)。与HER2类似,同基因突变排除对癌基因重叠曲线的形状影响最小。对于MET CNG≥4的肿瘤,33.2%为致癌驱动阳性,排除MET突变后26.3%为驱动阳性。相比之下,65.4%的MET CNG<4肿瘤为驱动阳性(图1C)。
2、扩增(Amp)与非Amp肿瘤的人口统计学和癌基因关联
研究者基于两个标准定义“扩增”(Amp)肿瘤的CNG阈值:(1)共发生致癌驱动突变频率达到最低点的基因拷贝数,例如MET在CNG≥4时最明显(图1C)。如果未检测到最低点,如HER2 CNG(图1A),(2)“Amp”组选择最高CNG,该CNG包含足够数量以允许分析特定致癌突变和临床结局。这些阈值在图1A-C中用垂直虚线表示。使用这些CNG阈值定义的扩增肿瘤非常罕见(MET为0.7%,HER2和KRAS为1%)。
根据Amp与非Amp状态以及是否存在已识别的驱动基因突变,将总体人群分为四组(表1)。对于所有3个基因,Amp和驱动基因阳性的情况显著少于偶然预期(P<.001)。表1还报告了每组的年龄、性别、自我报告的吸烟史和种族数据,以及测序的活检来源(原发 vs. 转移部位)。总体而言,驱动基因阳性组更可能为女性(P<.001),尽管KRAS Amp和驱动基因阳性肿瘤在两性中分布均匀(表1)。所有3个基因中,Amp和驱动基因阴性组的吸烟率最高(表1)。
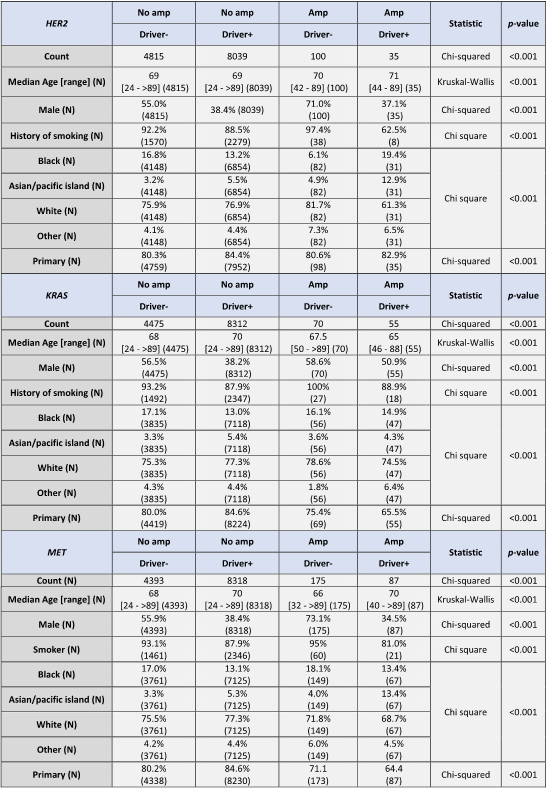
正如预期,Amp组中大多数驱动突变的频率在数值上低于非Amp组(表2)。HER2 Amp肿瘤中KRAS突变(36.87%非Amp vs. 6.35%Amp,P<.001)和MET突变(2.81% vs. 0.79%,P<.001)显著减少,而EGFR突变无显著改变(17.87%非Amp vs. 10.19%Amp,P=.051)。MET Amp肿瘤中KRAS突变(37.13%非Amp vs. 8.08% Amp,P<.001)频率较低。KRAS Amp组中EGFR(17.92%非Amp vs. 6.40%Amp,P=.010)和ALK融合(1.28%vs.0%,P<.001)驱动突变显著减少(P<.001)。罕见融合(ROS、RET、NTRK)通常仅在每个基因的非Amp组中检测到(表2)。
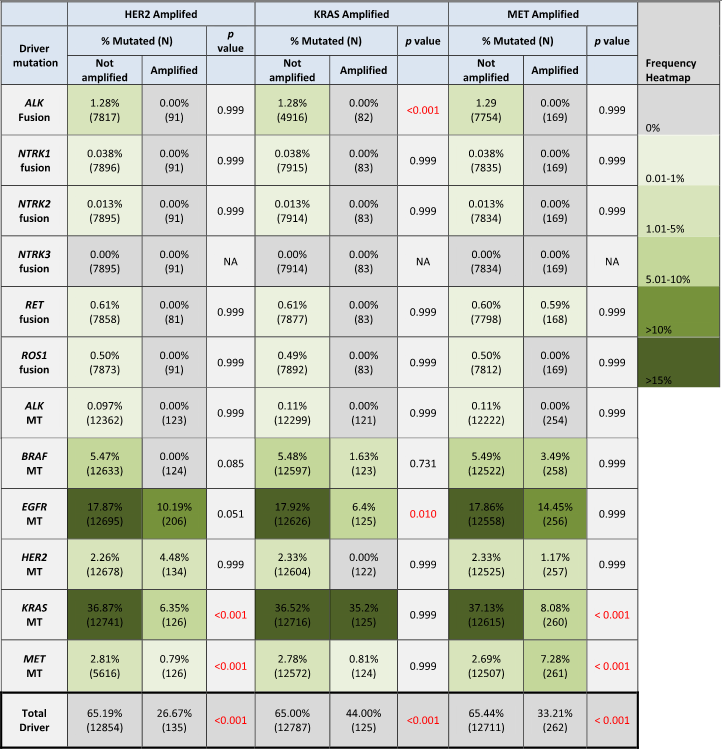
某些突变在Amp组(与非Amp组相比)中富集。MET突变在MET Amp中比非Amp肿瘤更常见(7.28%Amp vs. 2.69%非Amp,P<.001)。同样,HER2突变在HER2 Amp肿瘤中数值上更常见(4.48%Amp vs. 2.26%非Amp,NS)。KRAS突变在KRAS Amp和非Amp肿瘤之间相似(35.20%Amp vs. 36.52%非Amp,NS),而在其他两个(HER2或MET)Amp组中则显著较少(表2)。
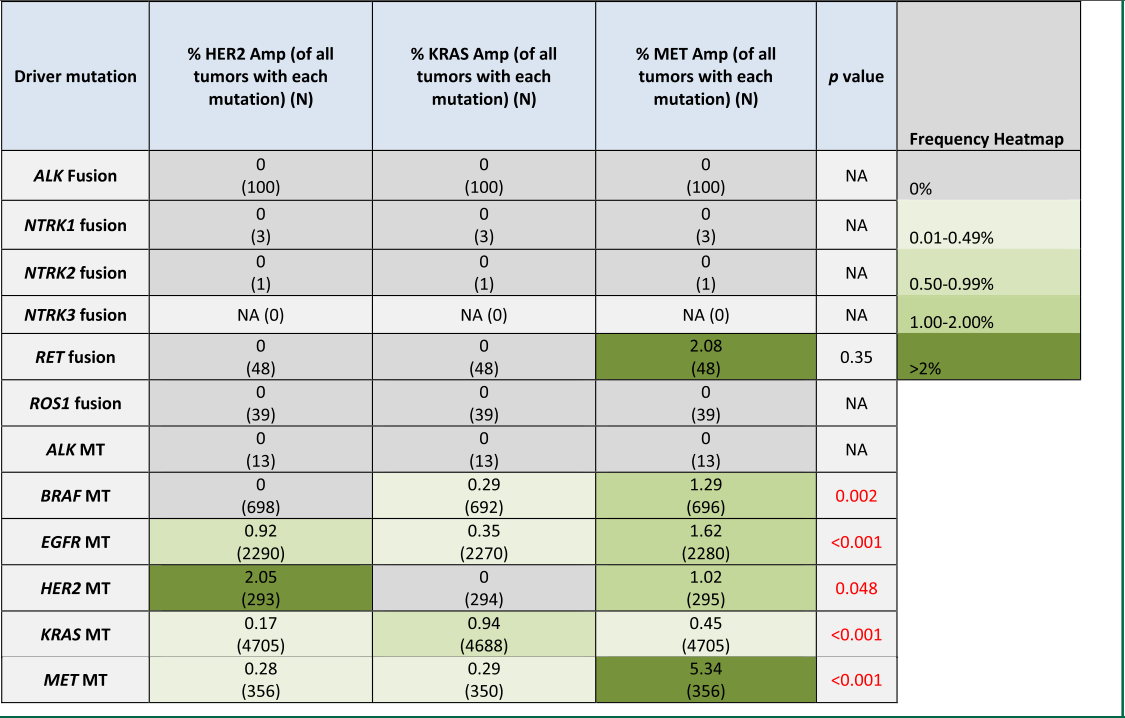
研究者还分析了携带特定驱动突变的肿瘤中HER2、KRAS或MET的“Amp”水平CNG的共发频率,同样观察到特定CNG与某些驱动突变的富集(表3)。同基因Amp在各自的驱动突变组中最常见。具体而言,2.05%的HER2突变肿瘤携带HER2 Amp,而携带MET Amp的为1.02%,无KRAS Amp(P=.048)。0.94%的KRAS突变肿瘤同时携带KRAS Amp,而携带MET Amp或HER2 Amp的比例分别为0.45%和0.17%(P<.001)。5.24%的MET突变肿瘤携带共发MET Amp,而KRAS Amp或HER2 Amp仅为0.29%和0.28%(P<.001)。EGFR和BRAF突变也与共发MET Amp的较高频率相关(表3)。
3、HER2、KRAS或MET高拷贝数与更差的总生存期相关
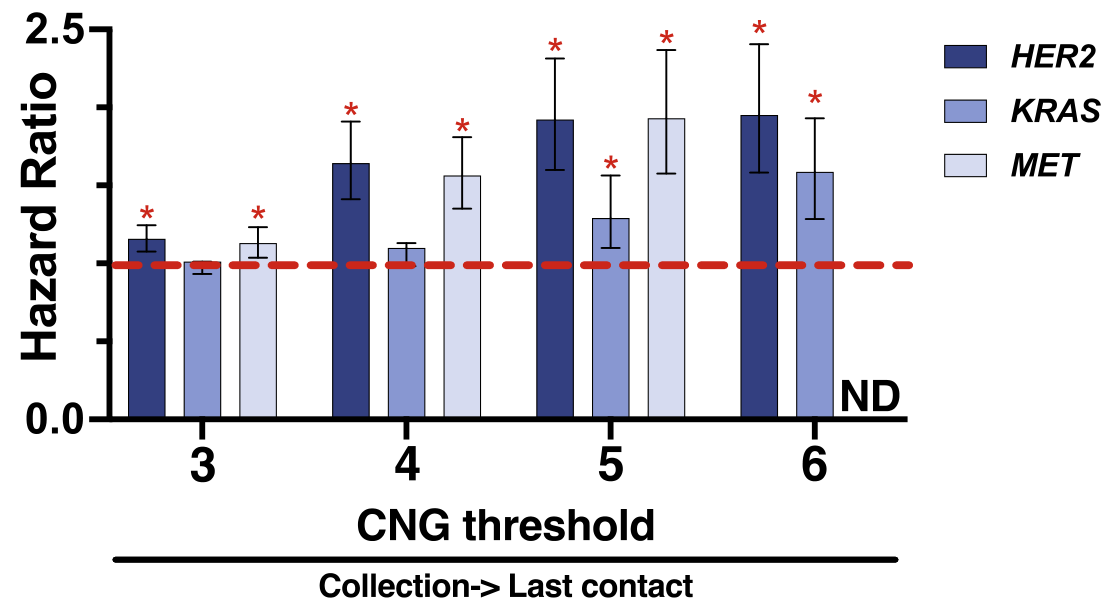
为评估CNG状态与生存的关联,计算从组织采集日期到最终保险索赔的总生存期(OS);无法获得组织采集时的分期和治疗状态。为首先评估OS与CNG的关系,计算了每个基因从≥3拷贝到≥6拷贝的CNG阈值肿瘤的OS(MET扩增肿瘤在CNG>6时生存数据太少,无法进行有意义的分析),并与没有该变异的所有肿瘤进行比较。按增加的HER2、KRAS和MET CNG阈值分层与死亡风险比(HR)逐渐增加相关性(图2)。
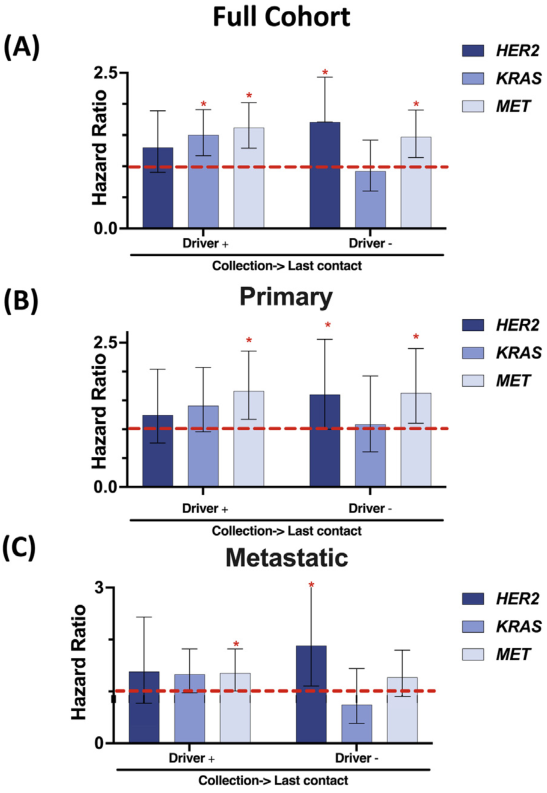
鉴于这一发现,应用上述癌基因重叠衍生的CNG阈值(Amp vs. 非Amp),探索共发驱动突变与Amp状态的影响,以及排除同基因变异后对生存的影响(图3)。无论癌基因驱动共突变状态如何,MET(驱动基因阳性HR 1.62,CI 1.29-2.02,P<.001;驱动基因阴性HR 1.47,CI 1.14-1.90,P=.0003)和HER2(驱动基因阳性HR 1.3,CI 0.90-1.89,P=.16;驱动基因阴性HR 1.71,CI 1.05-2.43,P<.001)的Amp状态与死亡HR增加相关,尽管HER2驱动基因阳性人群较小,HR未达显著。在KRAS驱动基因阳性的患者中,观察到KRAS Amp肿瘤相对于非Amp肿瘤的死亡HR增加,但在驱动基因阴性肿瘤中未观察到(驱动基因阳性HR 1.5,CI 1.17-1.91,P=.001;驱动基因阴性HR 0.92,0.60-1.42,P=.669;图3A)。在排除驱动基因阳性组中的同基因Amp和驱动突变肿瘤后重复此分析,KRAS或MET的扩增与更差的结果相关。活检位置(原发肿瘤 vs. 转移部位)不影响生存结局(图3B, C)。
结论
本研究通过大规模组织测序证实,基于致癌驱动基因互斥性设定的CNG阈值能有效区分具有临床意义的扩增亚群。这些高拷贝数组不仅表现出独特的共突变模式,还与不良预后显著相关,提示其可能代表特定的生物学亚型。值得注意的是,KRAS扩增的预后影响呈现驱动基因依赖性,而MET/HER2扩增的负面影响具有普适性。研究局限性包括缺乏治疗线数信息、无法区分扩增等位基因状态、以及基于保险数据的生存分析存在混杂因素。这些发现为设计靶向治疗临床试验提供了重要参考,未来需在前瞻性研究中验证阈值与治疗反应的关系。
Watson AS, Krause HB, Elliott A, et al. Use of Oncogene Overlap by Tissue-Based Next-Generation Sequencing to Explore the Mutational Landscape and Survival Impact of HER2, KRAS and MET Copy-Number Gain in Nonsmall Cell Lung Cancer. Clin Lung Cancer. 2024;25(8):712-722.e1. doi:10.1016/j.cllc.2024.09.001。
审批编号:CN-158903 有效期至:2025-07-24
声明:本材料由阿斯利康提供,仅供医疗卫生专业人士参考
排版编辑:肿瘤资讯-Sally











 苏公网安备32059002004080号
苏公网安备32059002004080号


