日前,2025中国临床肿瘤学会(CSCO)指南会盛大召开,各大瘤种指南迎来了重磅更新。在中国发病率、死亡率居首的肺癌领域,我国创新药物替雷利珠单抗的RATIONALE-304研究、RATIONALE-307研究等一系列循证医学证据不断披露,在晚期非小细胞肺癌(NSCLC)中替雷利珠单抗单抗引领长生存,无论鳞癌或非鳞癌,均让1/3的患者生存超过4年,再接受替雷利珠单抗长治疗患者人群中4年OS率更是高达90%及以上;在小细胞肺癌(SCLC)领域3年OS率也达到25%,四分之一的患者活过三年,为患者带来了显著的生存获益。在循证证据的支持下,替雷利珠单抗在肺癌应用的适应证已经纳入医保,可及性、可支付性获得极大提升。因此,2025版CSCO指南在将替雷利珠单抗肺癌领域适应证全部予以Ⅰ类推荐,为临床实践带来了实事求是、循证可靠、广泛可及的治疗策略。
作为RATIONALE系列研究的主要研究者之一,【肿瘤资讯】特别邀请北京大学肿瘤医院方健教授进行专访,以飨读者。

本期特邀专家——方 健 教授
胸部肿瘤内二科 科主任
主任医师 、硕士研究生导师
北京肿瘤防治研究会副会长
北京肿瘤防治研究会肺癌分委会主任委员
中国老年学学会老年肿瘤专业委员会分子靶向委员会副主任委员
中国老年学学会老年肿瘤专业委员会肺癌委员会委员
CSCO血管靶向治疗专家委员会委员
中国抗癌协会化疗专业委员会委员
中国抗癌协会老年专业委员会执行委员
国家药监局药品审评专家
CSCO指南更新,全人群Ⅰ级推荐
肺癌是我国恶性肿瘤发病与死亡之首,年新发106.1万例,死亡73.3万例,为人民健康带来了严重负担[1]。其中,约75%的患者就诊时已是晚期,5年生存率低于19.7%[2]。近年来,免疫治疗在肺癌领域陆续取得重大突破,使肺癌患者取得长期生存获益成为了可能。在NSCLC领域,免疫治疗从后线到前线、乃至围术期应用贯穿了疾病诊疗全周期;在SCLC领域,免疫治疗在广泛期的应用也日臻成熟。
随着我国自主研发的免疫治疗创新药物在肺癌应用的循证医学证据、可及性、可支付性的日益完善,为患者提供了更适合中国人的临床选择。其中,替雷利珠单抗立足于RATIONALE-304研究、RATIONALE-307研究、RATIONALE-312研究、RATIONALE-315研究等一系列肺癌领域坚实的循证医学证据所带来的临床获益,成为全球唯一*在晚期NSCLC全线治疗、可手术II-III期NSCLC以及广泛期小细胞肺癌(ES-SCLC)一线治疗均获适应证的国产PD-1单抗,也是唯一*获CSCO指南对肺癌全人群、全线均给予Ⅰ级推荐的治疗策略,并实现了晚期肺癌适应证医保全面覆盖。
在最新发布的《CSCO NSCLC诊疗指南》更新要点[3]、《CSCO 免疫检查点抑制剂临床应用指南2025》(征求意见稿)》[4]中:
对于晚期NSCLC:
· Ⅱ~Ⅲ期NSCLC,适宜手术者:含铂化疗联合替雷利珠单抗新辅助+辅助治疗,Ⅰ级推荐
· 无驱动基因非鳞状NSCLC一线治疗:替雷利珠单抗+培美曲塞/铂类,Ⅰ级推荐
· 无驱动基因鳞状NSCLC一线治疗:替雷利珠单抗+紫杉醇/白蛋白紫杉醇+铂类,Ⅰ级推荐
· NSCLC二线及后线治疗:替雷利珠单抗,Ⅰ级推荐
对于SCLC:
广泛期小细胞肺癌(ES-SCLC)一线治疗:替雷利珠单抗+依托泊苷+铂类,Ⅰ级推荐,1A类证据。
立足循证,肺癌长生存金标准
CSCO指南的制定与更新,不仅立足于坚实的循证医学证据,还综合考量了治疗方案在中国适应证的获批状况、医保覆盖状况、可及性及可支付性。2025年CSCO最新发布的指南将替雷利珠单抗作为Ⅰ级推荐代表了中国专家对其广泛的认可,这与其过去一年更新的数据及其为肺癌患者带来的长期生存获益密切相关。
在非鳞状NSCLC方面,2024年欧洲肿瘤内科学会亚洲年会(ESMO Asia)更新发布了RATIONALE-304研究的长期随访数据结果[5]。该研究是一项III期、多中心、随机对照研究,旨在评估替雷利珠单抗联合铂类+培美曲塞对比铂类+培美曲塞一线治疗晚期非鳞NSCLC的疗效和安全性。截至2023年4月26日,该研究中位随访49.6个月,结果显示:替雷利珠单抗联合化疗组的4年总生存率(OS)达到32.8%,超过1/3的患者生存超过4年,化疗组及通过敏感性分析校正后的化疗组4年OS率分别为29.7%和22.9%;替雷利珠单抗联合化疗组vs化疗组的3年无进展生存(PFS)率分别为19.4% vs 2.5%(HR: 0.61, 0.46-0.82),显示出了持久的获益。
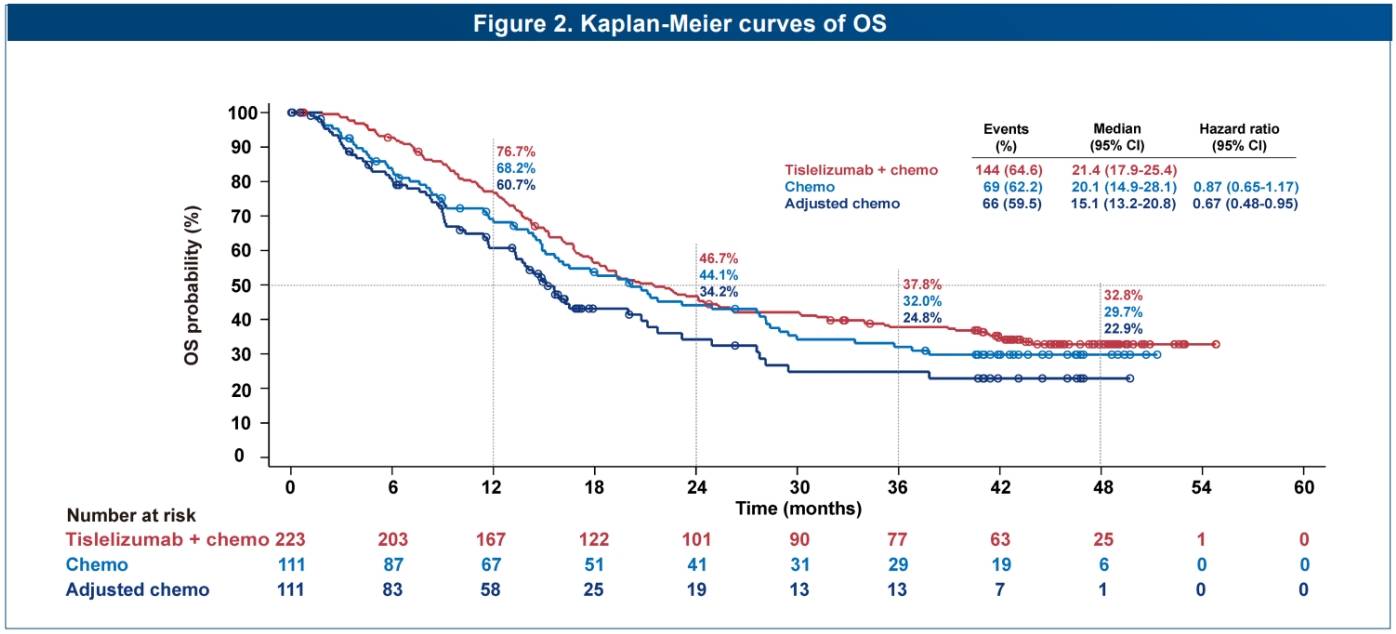
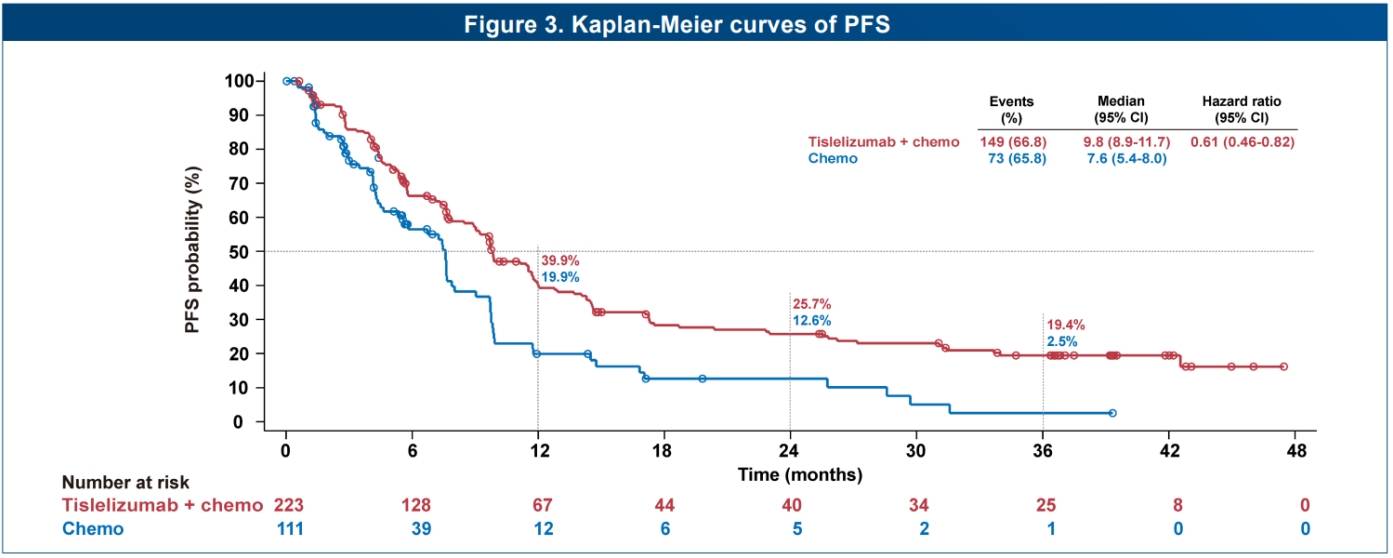 RATIONALE-304研究的OS与PFS
RATIONALE-304研究的OS与PFS
在该研究中,共有38例(17.0%)患者接受了≥35周期的替雷利珠单抗长治疗(LTE),且基线与ITT人群相似,中位治疗周期为52.5(范围: 36-77),结果显示:替雷利珠单抗LTE患者的4年OS率为89.3%;客观缓解率(ORR)为100%(完全缓解CR, n=10; 部分缓解PR, n=28),疾病缓解持续时间(DoR)未达到,且安全性与既往表现类似,提示替雷利珠单抗让更多患者长生存成为可能。
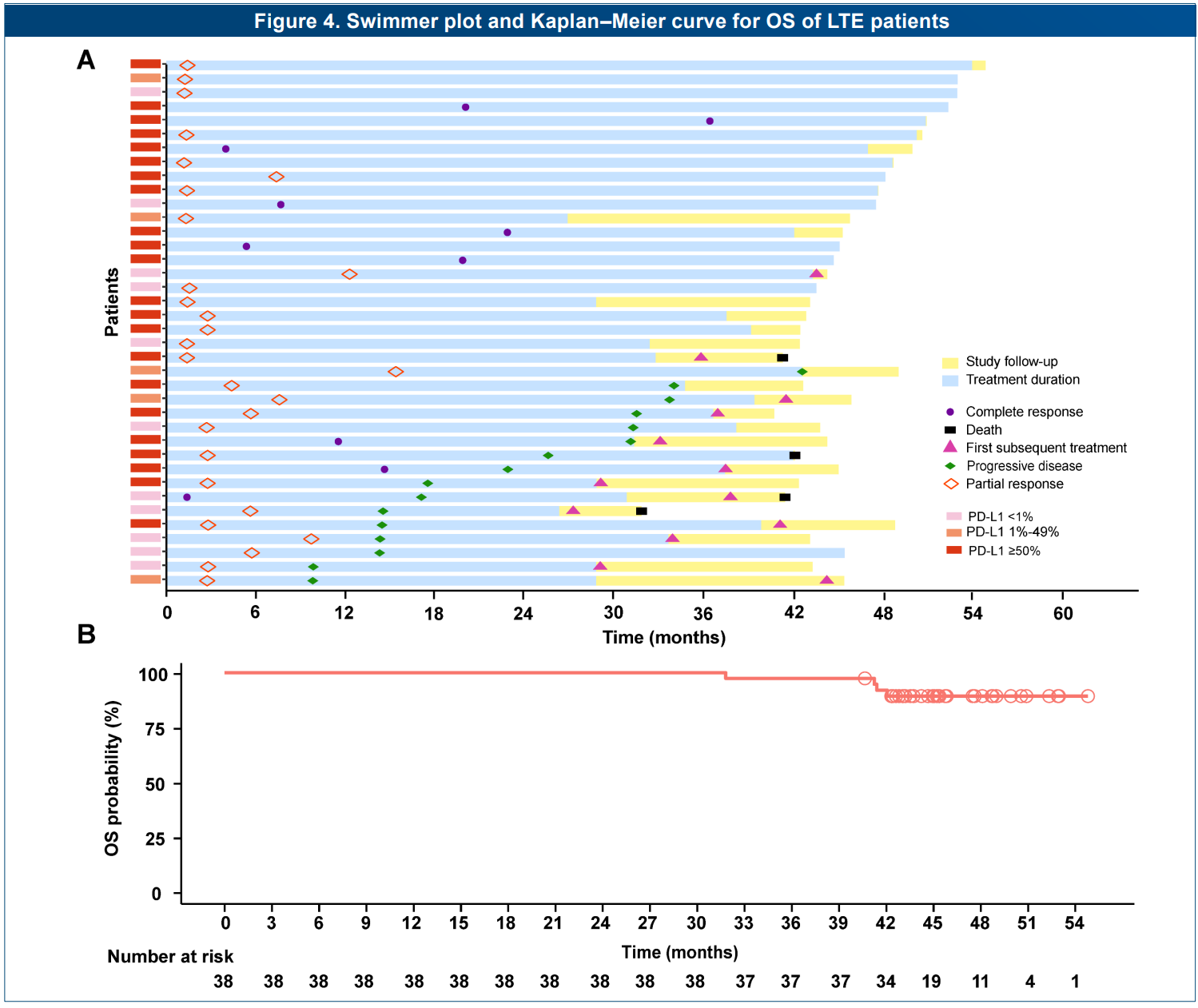 RATIONALE-304研究替雷利珠单抗长治疗(LTE)人群的游泳图和OS
RATIONALE-304研究替雷利珠单抗长治疗(LTE)人群的游泳图和OS
在鳞状NSCLC方面,2024年ESMO年会更新发布了RATIONALE-307的长期随访结果及长治疗人群分析[6]。该研究为一项III期、多中心、随机对照研究,旨在评估替雷利珠单抗联合紫杉醇/白蛋白紫杉醇及卡铂对比紫杉醇及卡铂一线治疗晚期鳞状NSCLC的疗效和安全性。截至2023年4月28日,该研究中位随访50.3个月,结果显示:替雷利珠单抗联合紫杉醇及卡铂组(Tisle+PC组)、替雷利珠单抗联合白蛋白紫杉醇及卡铂组(Tisle+nPC)及化疗组患者的mOS分别为26.1个月、23.3个月和19.4个月;4年OS率分别为32.2%、26.0%和19.2%;4年PFS率分别为23.1%、17.8%和3.9%。
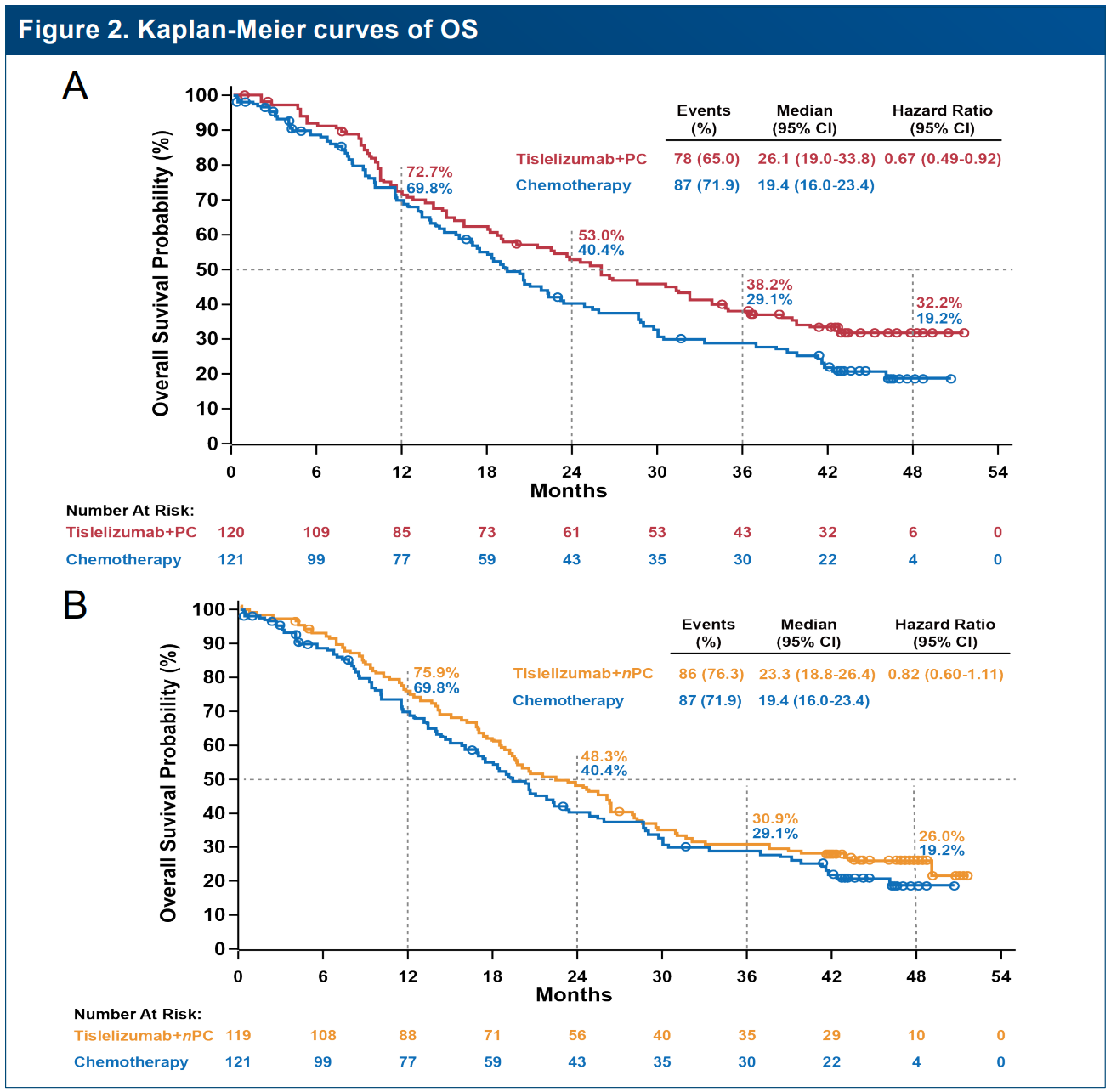 RATIONALE-307研究的OS
RATIONALE-307研究的OS
在该研究中,替雷利珠单抗联合化疗组(Tisle+PC组和Tisle+nPC组)中,共有42例(17.6%)患者为≥35周期的替雷利珠单抗LTE患者,基线与ITT人群相似,中位治疗周期为58(范围:37-71),结果显示:替雷利珠单抗LTE患者4年OS率为97.5%,ORR为100%(CR, n=11; PR, n=31),DoR未达到,安全性与既往表现类似,显示了替雷利珠单抗在鳞状NSCLC的长生存获益。
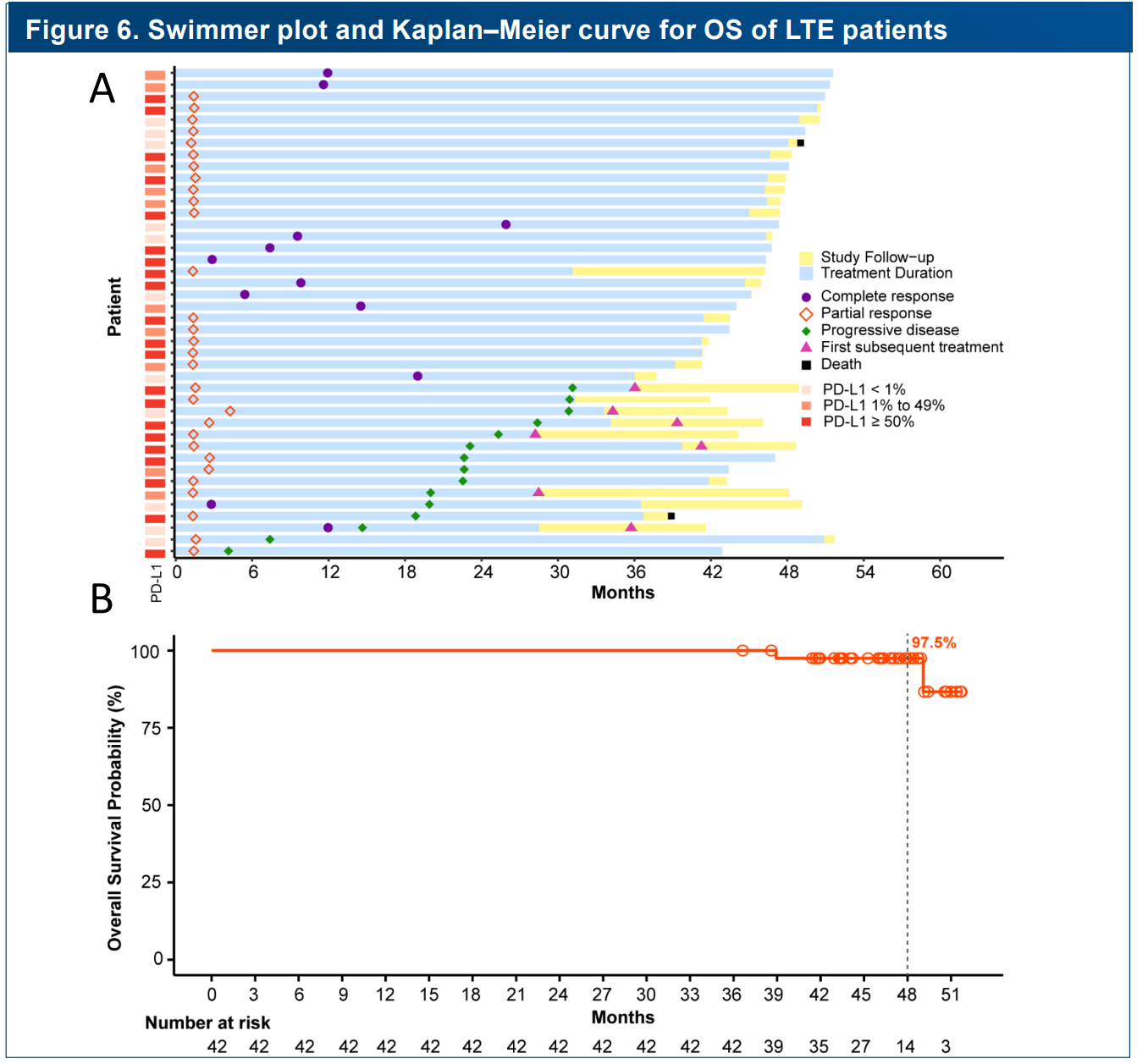 RATIONALE-307研究替雷利珠单抗长治疗(LTE)人群的游泳图和OS
RATIONALE-307研究替雷利珠单抗长治疗(LTE)人群的游泳图和OS
此外,在NSCLC围术期治疗方面,RATIONALE-315研究显示,替雷利珠单抗联合化疗组与化疗组的完全病理缓解率pCR为41% VS 6% , 2年EFS率达68.3% VS 51.8%,替雷利珠单抗较对照组降低了38%的疾病死亡风险(HR:0.62, P=0.0193)[7]。在ES-SCLC方面,RATIONALE-312研究中,替雷利珠单抗联合化疗组与安慰剂联合化疗组的mOS为15.5个月 vs 13.5个月(HR: 0.75, P=0.0040),3年OS率达到25%,较对照组显著延长了生存期并有部分患者获得了长生存[8]。
国家卫生健康委办公厅发布的《原发性肺癌诊疗指南(2022年版)》指出,肺癌的治疗的目的是最大程度地延长患者的生存时间、提供生存率、控制肿瘤进展和改善患者的生活质量[9]。美国食品药品监督管理局(FDA)《抗肿瘤药或生物制剂的临床研究终点审批行业指导指南》指出,OS是迄今为止最可靠的试验终点,且是优选的终点[10]。2023年,FDA专家在《JCO》发文再次强调,OS是肿瘤药物获批的金标准[11]。可见国内外的政府部门、医务工作者均强调抗肿瘤治疗中OS获益的重要性。
如今,随着替雷利珠单抗在肺癌领域循证证据的不断丰富,其在NSCLC、SCLC应用的生存获益、乃至长期治疗生存获益不断展现,使肺癌患者步入长期生存成为了可能。基于一系列的循证积累及可及性、可支付性的提升,替雷利珠单抗在2025年CSCO指南的更新中,用于围术期和SCLC两项推荐均上调为了I级推荐,至此替雷利珠单抗肺癌全部5项适应证均获得CSCO指南I级推荐,成为唯一斩获CSCO指南全线序、全人群I级推荐的免疫治疗药物,为肺癌患者生存获益带来了坚实、可靠的临床实践方案!
1.郑荣寿, 陈茹, 韩冰峰, 等. 2022年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2024, 46(3):221-231. DOI: 10.3760/cma.j.cn112152-20240119-00035
2.Zeng H , Chen W , Zheng R ,et al. Changing cancer survival in China during 2003-15: a pooled analysis of 17 population-based cancer registries[J]. Lancet Glob Health, 2018,6(5):e555-e567. DOI: 10.1016/S2214-109X(18)30127-X .
3.中国临床肿瘤学会指南工作委员会组织编写. 中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南2025. 北京: 人民卫生出版社, 2025.4.
4.中国临床肿瘤学会指南工作委员会组织编写. 中国临床肿瘤学会(CSCO)免疫检查点抑制剂临床应用指南2025(征求意见稿). 2025 CSCO 指南会.
5.S. Lu, Y. Yu, X. Yu, et al. 2024 ESMO Asia 632P - RATIONALE-304 long-term outcomes: First-line tislelizumab (TIS) + chemotherapy (chemo) vs chemo for locally advanced or metastatic non-squamous (NSQ) NSCLC. Annals of Oncology (2024) 35 (suppl_4): S1632-S1678. 10.1016/annonc/annonc1698.
6.Z. Wang, X. Yu, J. Zhao, et al. 2024 ESMO 1323P RATIONALE-307 long-term outcomes: First-line tislelizumab (TIS) plus chemotherapy (chemo) vs chemo alone for advanced squamous (sq) NSCLC. Annals of Oncology, Volume 35, S841 - S842.
7.Yue D, Wang W, Liu H, et al. Perioperative tislelizumab plus neoadjuvant chemotherapy for patients with resectable non-small-cell lung cancer (RATIONALE-315): an interim analysis of a randomised clinical trial. Lancet Respir Med. 2025;13(2):119-129. doi:10.1016/S2213-2600(24)00269-8
8.Cheng Y, Fan Y, Zhao Y, et al. Tislelizumab Plus Platinum and Etoposide Versus Placebo Plus Platinum and Etoposide as First-Line Treatment for Extensive-Stage SCLC (RATIONALE-312): A Multicenter, Double-Blind, Placebo-Controlled, Randomized, Phase 3 Clinical Trial. J Thorac Oncol. 2024;19(7):1073-1085. doi:10.1016/j.jtho.2024.03.008
9.国家卫生健康委办公厅. 原发性肺癌诊疗指南(2022年版)[J]. 协和医学杂志, 2022, 13(4): 549-570. DOI: 10.12290/xhyxzz.2022-0352
10.US FDA. Guidance for Industry : Clinical Trial Endpoints for the Approval of Cancer Drugs and Biologics. 2018.12. Available at: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/clinical-trial-endpoints-approval-cancer-drugs-and-biologics
11.Merino M, Kasamon Y, Theoret M, Pazdur R, Kluetz P, Gormley N. Irreconcilable Differences: The Divorce Between Response Rates, Progression-Free Survival, and Overall Survival [published correction appears in J Clin Oncol. 2023 Sep 20;41(27):4449. doi: 10.1200/JCO.23.01583]. J Clin Oncol. 2023;41(15):2706-2712. doi:10.1200/JCO.23.00225
排版编辑:肿瘤资讯-高惠











 苏公网安备32059002004080号
苏公网安备32059002004080号


