如今,晚期肾癌已经正式进入靶免联合治疗时代,而靶向治疗去其中的关键基础。多个免疫检查点抑制剂联合阿昔替尼的临床试验均提示可带来无进展生存期(PFS)和总生存期(OS)获益,且安全可控,目前这类联合治疗方案已被权威指南推荐用于晚期肾癌的一线治疗。另一方面,阿昔替尼适用于肾癌的适应症已经进入了医保,可及性得到保障,是靶免联合治疗的TKI优选。本期邀请多位专家分享靶免治疗晚期肾癌病例,以期为专家学者提供新的治疗思路。
肾癌患者病例分享
病例分享专家
武汉大学中南医院泌尿外科副教授
武汉市泌尿男生殖系肿瘤临床医学研究中心副主任
中国研究型医院学会泌尿外科青年委员会委员兼秘书
中国医师协会泌尿外科医师分会微创与机器人学组委员
中国医师协会泌尿外科青年委员会委员
武汉市中青年医学骨干人才
武汉大学中南医院优秀中青年人才
主要从事泌尿系统肿瘤及前列腺增生的基础与临床研究,主持各类科研项目4项,其中国家自然科学基金项目2项,武汉市重点项目1项,武汉市人才项目1项;以第一作者/通讯作者在Cancer cell,Cell research等杂志发表论文12篇
病例一
基本信息:患者男,47岁。主诉因“发现左肾占位1周”入院,患者1周前因左锁骨上淋巴结肿大于外院检查,影像学及左锁骨上淋巴结活检提示:左肾占位,伴左锁骨上淋巴结+肝脏转移,现患者为求进一步诊治,遂于我院就诊,我院以“左肾肿瘤伴淋巴结,肝脏转移”,收入我科。既往体健无特殊。
现病史:
会诊外院病理切片:
送检淋巴结内见腺癌图像,结合患者肾脏占位病史及原会诊单位免疫组化结果,考虑肾细胞癌(WHO/ISUP:3级),具体组织学类型建议待手术标本进一步明确。
原会诊单位免疫组化示肿瘤细胞呈GATA3(+)、PAX8(+)、CK7(-)、RCC(弱+)、TFE3(-)、CAIX(-)。
辅助检查:
左肾中部-下极见一混杂T1/T2信号肿块,大小约64×38×88mm,肿块内可见多发囊状影及不规则形低信号区(T2WI-FS),肿块部分与左侧肾前筋膜分界不清。左肾肿块伴多发囊变及出血,考虑恶性肿瘤,囊性透明细胞癌?建议进一步检查(CTU检查);腹膜后见多发肿大淋巴结,较大者约34×22mm。腹膜后多发肿大淋巴结,考虑转移;所及肝右叶见多发类圆形稍长T1稍长T2信号结节及肿块,较大者位于右前叶下段,大小约43×30mm。所及肝右叶多发结节及肿块,考虑转移。

肾小球滤过率:
GFR总=90.82ml/min(校正后为88.64ml/min/1.73m2)
GFR左=45.32ml/min,GFR右=45.49ml/min
PET-CT:左肾中下部巨大混杂密度肿块,侵及肾周筋膜,代谢异常增高;左颈部、双侧锁骨上区、纵隔内及右肺门、右膈上脊柱旁、双侧膈肌脚后、肝门区、胰腺后方、腹膜后区、门腔静脉间隙、双侧腰大肌内侧、双侧髂总血管旁、左髂内/外血管旁多发淋巴结,部分肿大融合,与邻近大血管分界不清,代谢异常增高;肝内多发结节、肿块,代谢异常增高;多处骨骼骨质破坏,代谢异常增高。以上符合左肾癌伴多发转移。其余探测部位未见明显恶性肿瘤病变及转移征象。
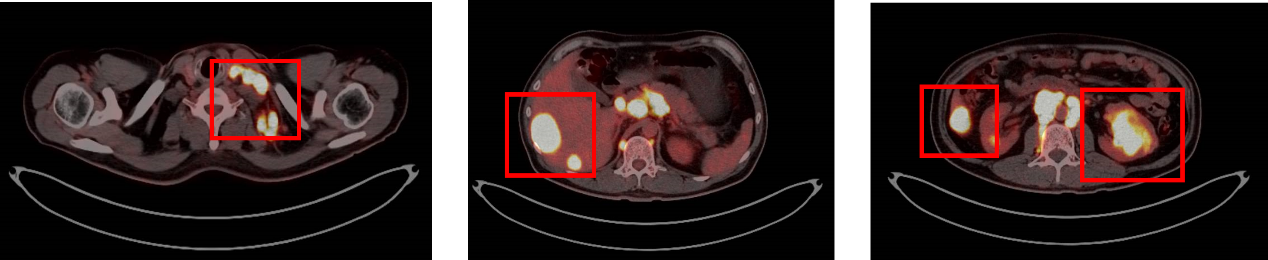
病理诊断:
MDT讨论后建议手术切取左锁骨上淋巴结,进一步明确诊断,组织来源,及进行基因检测以帮助指导后续治疗。排除手术禁忌,于 2023-04-25单纯淋巴结切除术(左锁骨)。
病理:转移性癌,结合免疫组化结果,支持转移性肾细胞癌(乳头状肾细胞癌,2型,WHO/ISUP分级:3级)。
免疫组化检测肿瘤细细胞呈:CD10(-),CD117(-),CK(+),CK7(-),FH(+),P504S(+),PAX8(+),SDHB(+),TFE3(-),TG(-),ALK(-),Brg1(+),INI-1(+),BAP1(-),NapsinA(-),HMB45(-),Melan-A(-),TTF-1(-),Ki-67(Li:20%),PD-1(炎症细胞+),PD-L1(CPS 约8)。
治疗经过:
科室讨论后决定暂不行手术治疗,给予替雷利珠单抗+舒尼替尼靶免治疗,治疗过程顺利,无明显不良反应。
2023-05-23行替雷利珠单抗治疗,更换口服药物为:阿昔替尼5mg,患者未诉特殊不适。嘱患者出院后继续按照说明书口服阿昔替尼,每3周返院行下一周期靶免治疗。
2023-06-11、07-02、07-23、08-13规律返院治疗。
2023-08-16 复查下腹部MRI:左肾肿块伴多发囊变及出血,结合病史,考虑恶性肿瘤(乳头状肾细胞Ca),较前缩小,请结合临床;腹膜后多发肿大淋巴结,较前缩小、减少,考虑转移;所及肝右叶多发结节及肿块,较前缩小、减少,考虑转移;肝周少许积液。
2023-09-02复查,CTU:左肾肿块,结合病史考虑恶性肿瘤(乳头状肾细胞Ca),左侧肾前筋膜受累可能;腹腔腹膜后、左侧髂总动脉旁及左侧盆腔内多发肿大淋巴结,考虑转移;所及肝右叶多发结节及肿块,考虑转移;腰骶椎骨质异常密度灶伴L4椎体压缩,不排除转移。以上转移病灶较前缩小。
ECT肾动态现象:肾小球滤过率:
GFR总=105.87ml/min(校正后为104.58ml/min/1.73m2)
GFR左=53.34ml/min,GFR右=52.53ml/min
排除相关手术禁忌,于2023-08-20全麻下行腹腔镜下单侧肾切除术
术后病理:
大小:3×2.2×2.2cm 单灶肾细胞癌,考虑为乳头状肾细胞癌,2型
组织学分级( WHO/ISUP分级):G3
治疗效果:肾癌免疫治疗和靶向治疗后,呈中度治疗反应,残余多灶肿瘤病灶,肿瘤细胞坏死占:30%,其余60%面积为纤维化和含铁血黄素沉积
病理分期:ypT1aNxM1(结合病检号23-13069结果)
免疫组化检测肿瘤细胞呈:CAIX(-),CD10(-),CD117(-),CK(+),CK7(-),FH(+),Ki-67(Li:40%),P504S(+),PAX2(-),PAX8(+),RCC(-),SDHB(+),TFE3(+),VIMENTIN(+),PD-L1(CPS 2),ALK(-)
嘱患者术后四周开始服用阿昔替尼靶向治疗,后患者每三周返院监测血液相关指标,行替雷利珠单抗200mg免疫治疗,并每日口服阿昔替尼。
2024-10-27 复查CT:
(全腹部)左肾肿瘤切除术后改变,术区及腹膜后渗出较前相仿;腹膜后多发淋巴结,部分较前稍缩小;肝脏多发稍低密度结节,较前相仿,建议DWI检查;肝囊肿;L4椎体变形内凹并骨质增生,较前相仿,请结合临床外伤史。
CT:肺部(平扫+MPR):左肺少许实性结节,考虑增殖灶,较前相仿,建议年度复查;右下胸膜稍增厚。
MRI:腰椎平扫:L4椎体骨转移瘤治疗后:L4上部许莫氏结节,L3-L4椎体终板炎及椎角炎,较前相仿;腰椎轻度退行性改变;L1/2、L2/3、L3/4椎间盘突出,右侧L4神经根受压。
现患者一般状态良好,未诉特殊不适,规律行免疫及靶向治疗。继续在免疫治疗2年后停药,靶向治疗长期用药。
病例二
基本信息:患者女,44岁。主诉因“发现右肾肿瘤3天”入院,患者3天前单位体检B超发现右肾肿物,无尿频尿急尿痛,无肉眼血尿。
现病史:
2021-09-11患者于外院行腹部增强CT提示右肾肿瘤性病变;
行MRI检查提示右肾多血供含脂质脂肪肿块,考虑肿瘤性病变,透明细胞癌可能。未行特殊处理,遂来我院就诊,门诊以“右肾肿瘤”收入我科。
辅助检查:
肾脏肿瘤超声造影:右肾切面大小约10.6×4.9cm,实质厚约1.6cm,中部可见一个大小约6.1×5.4cm的稍低回声稍向外突出,轮廓尚清晰,内部回声不均匀,可见高回声区,右肾实质性占位(Ca?)
外院MRI会诊:右肾混杂信号占位,多考虑肾脏恶性肿瘤可能,病灶内T2WI低信号灶需鉴别为右肾占位囊变或右肾实质性积水。
CTU:右肾占位,55×44×63mm,多考虑恶性肿瘤性病变(肾CA可能性大)右侧肾上腺小结节,多考虑腺瘤,建议随访观察;
肾动脉/静脉CT成像未见明显异常;腹膜后小淋巴结。
肾动态显像:
肾小球滤过率:GFR总=127.67ml/min(校正后147.09ml/min/1.73m2)
GFR左=66.72ml/min,GFR右=60.95ml/min
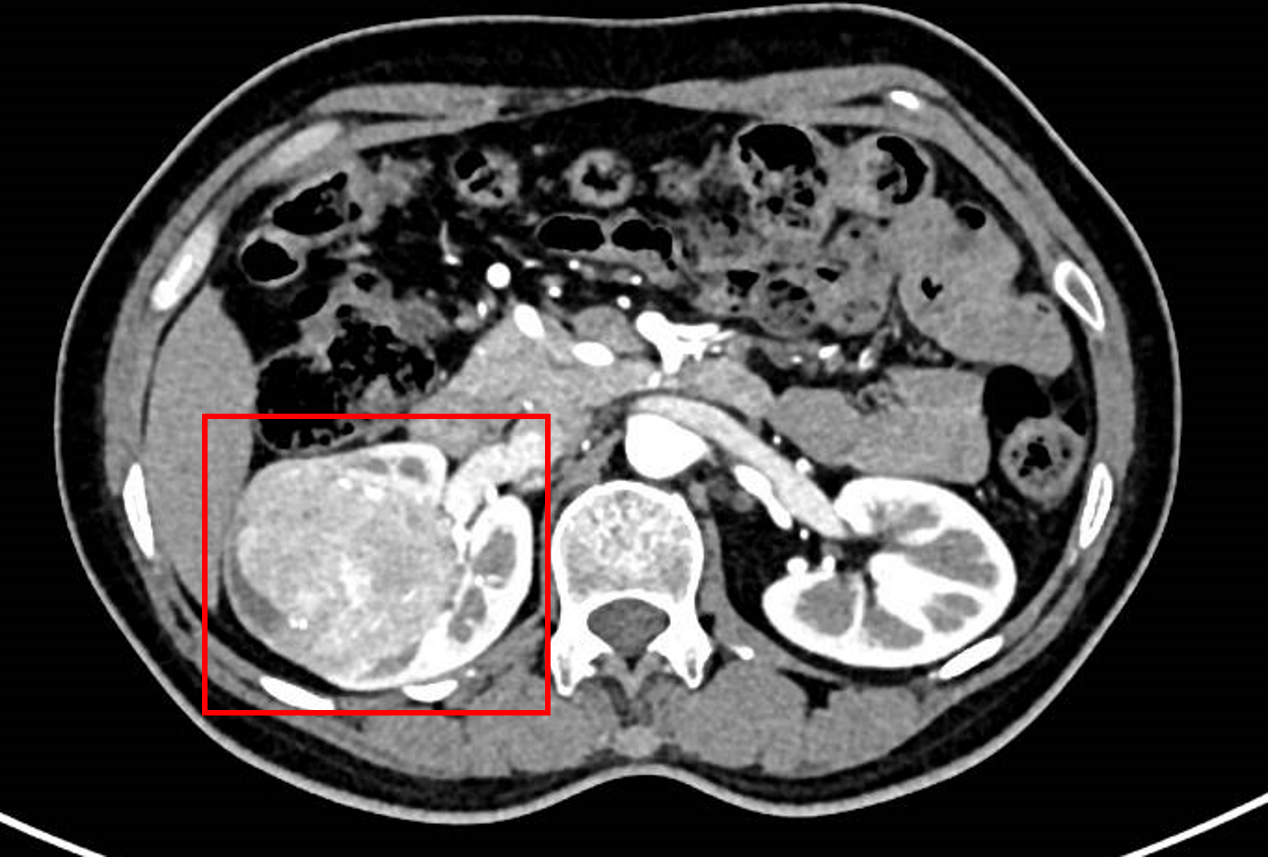
治疗经过:
排除相关手术禁忌后,于2021-09-16在全麻下行腹腔镜下单侧肾切除术(右侧)
肿瘤位置:上极 大小:4.5×3.2×2.2cm 单灶
组织学类型:肾细胞癌,考虑Xp/11.2易位性肾细胞癌;待FISH检测TFE3基因断裂进一步确诊。
病理分期:pT1bNxMx
免疫组化显示癌细胞:PAX8(+),TFE3(弥漫而强的核+),CD10(+),HMB45(-),Melan-A(-),MiTF(-),CAIX(-),CD117(-),CK(-),CK7(-),FH(+),VIMENTIN(-),Ki-67(Li:2%)。
FISH:视野内存在TFE3异常信号(一红一绿一融合)的细胞比例约为32%。
以上结果提示:该样本TFE3基因发生平衡易位。
嘱患者每3-6个月定期复查胸部CT及腹部CT。
2024-03-21 复查CT泌尿系平扫:
右肾术后改变;右侧术区腹膜后软组织肿块,23×44×70mm,密度不均,下腔及肾静脉受压移位较前新增,考虑转移瘤;右侧肾上腺腺瘤?右肾上腺钙化灶;肝内小囊肿或胆管错构瘤可能。
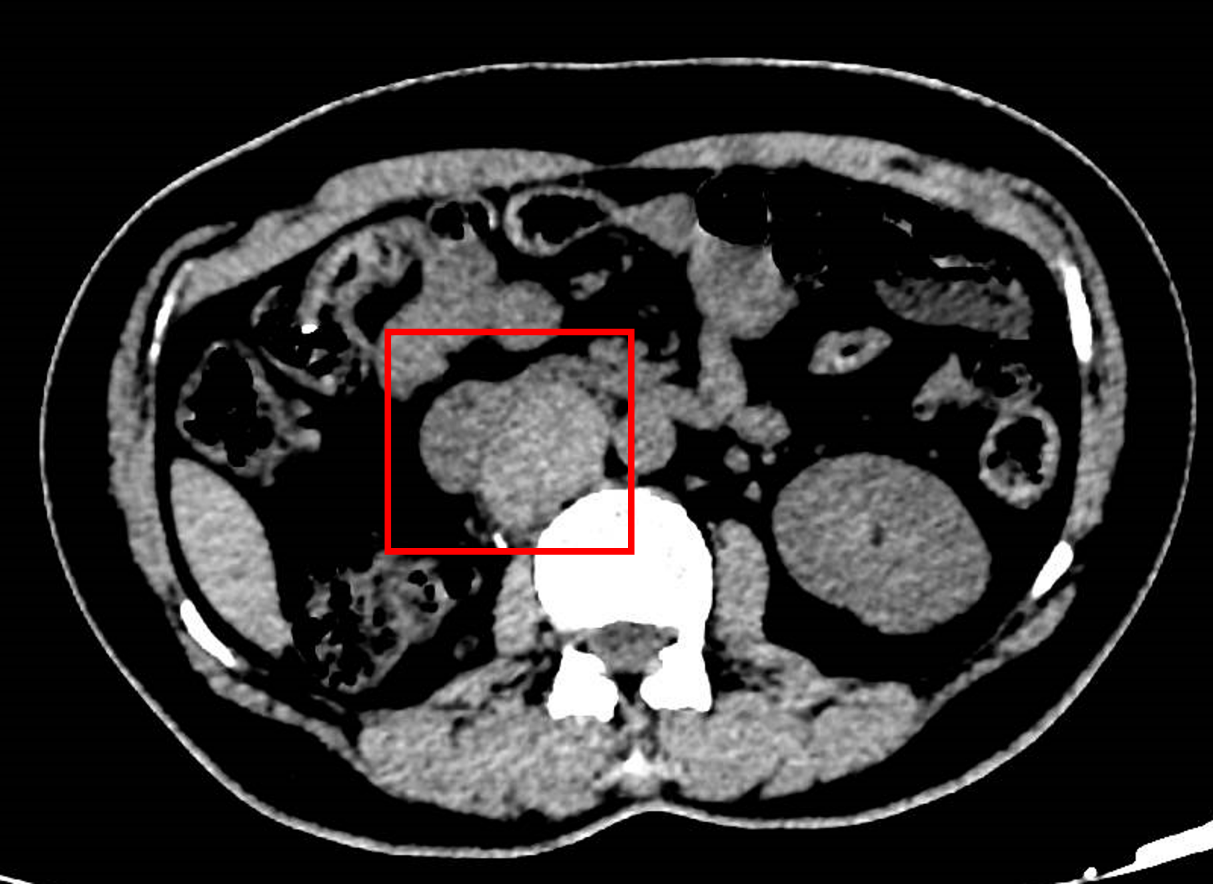
2024-04-28 患者无明显诱因出现右侧腰背部持续性疼痛,休息后不可缓解,感恶心、呕吐,呕吐物为胃内容物,收入院行进一步检查。
泌尿系CT平扫:右肾未见显示,邻近腹膜增厚,周围见低密度影,术区腹膜后见一38×44×79mm软组织肿块(增强呈中度不均匀强化),密度不均,下腔及肾静脉受压移位,较前范围增大,考虑转移瘤。

ECT全身骨显像未见明显骨转移瘤征象。
肺部CT:
双肺微小结节,建议随诊复查;双肺纤维灶,较前增多;双肺下叶少许坠积性改变。
肾肿瘤MRI:
右肾术后改变;右侧术区腹膜后软组织肿块,45×51×79mm,较前范围增大,考虑转移瘤;右侧肾上腺结节,考虑转移瘤可能;肝囊肿;腹腔少量积液,胸腔积液。

经MDT,综合评估患者病情,患者目前手术风险较大,评估术后获益有限;建议先行靶向+免疫治疗,后期根据综合治疗后肿瘤缩小情况再评估是否手术。
2024-05-07,排除禁忌症,行第一周期特瑞普利单抗(240mg)治疗,未见明显副反应。嘱患者出院后规律口服阿昔替尼,3周后返院行下一周期治疗。
2024-05-27、06-18、07-08、08-10、09-04返院靶免治疗。
2024-08-11 CTU:
右肾术后改变;右侧术区腹膜后软组织肿块,25×43×53mm,较前范围缩小,考虑转移瘤;右侧肾上腺结节,较前增大,腺瘤?右肾上腺钙化灶;
肝内小囊肿或胆管错构瘤可能;盆腔少量积液;宫腔少量积液;左肾动静脉未见明显异常。

2024-10-08 复查CTU:右肾术后改变;右侧术区腹膜后软组织肿块,26×31×54mm,较前稍缩小,考虑转移瘤;右侧肾上腺结节,较前相仿,腺瘤?右肾上腺小钙化灶;肝内小囊肿或胆管错构瘤可能;盆腔少量积液;左肾动静脉未见明显异常。
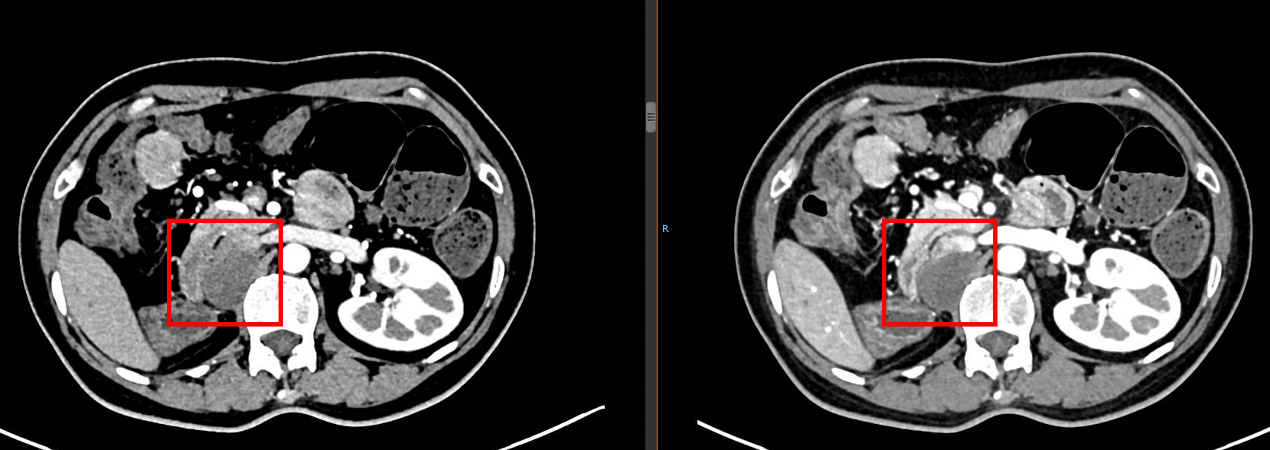
经科室讨论,拟行手术切除治疗
排除相关手术禁忌,于2024-10-14全麻下行机器人辅助腹腔镜下右侧腹膜后肿瘤切除术+右侧肾上腺切除术。
术后病理提示:
(右侧腹膜后肿瘤切除标本)送检组织经广泛充分取材,最大径6.2cm结节镜下见大片变性坏死组织,周围纤维组织增生伴明显慢性炎性细胞浸润。检及淋巴结(18枚)呈反应性增生;送检组织内另可见肾上腺组织,肾上腺皮质结节状增生(最大径0.9cm)。
2024-10-21顺利出院。后续计划:术后免疫治疗停药,靶向治疗满1年后停药。
专家点评
张志敏教授:该晚期肾癌患者通过靶免联合治疗获得手术机会的治疗路径具有示范意义。对于郭教授制定的术后免疫两年维持方案,我认为在稳定有效的前提下,结合肺癌领域经验,两年免疫疗程是合理的。后续采用阿昔替尼单药维持治疗符合肾癌治疗规范,这类TKI在肾癌治疗中的核心地位毋庸置疑。外科医生在免疫/靶向治疗不良反应管理方面存在专业局限。我中心曾处理过大量复杂免疫不良反应病例,包括致命性的免疫性肺炎、心肌炎及复合性免疫毒性。这些案例警示我们,不规范处理会显著增加患者死亡率,需要重点区分靶向治疗与免疫治疗的叠加毒性,特别是肝炎、皮疹、腹泻等共有症状,可考虑建立"阶梯式干预"模式。
晚期肾癌治疗病例分享
病例分享专家
湖北省肿瘤医院 泌尿外科 主治医师
湖北省泌尿外科腔镜技术联盟委员
湖北省性学会生育力保护专业委员会委员
湖北省免疫学会泌尿系统免疫专业委员会委员
湖北省临床肿瘤学会泌尿生殖肿瘤专家委员会委员
武汉医学会机器人与腔镜外科分会泌尿外科学组委员
主持或参加科研项目3项
代表性研究成果和学术奖励5项
擅长泌尿系统疾病的诊断与治疗,具有丰富的临床经验
病例一
基本信息:患者男,47岁。2020-12,主诉因“因头晕2周,左侧肢体肌力下降1周”入院。
现病史:外院行颅脑MRI检查:右侧额叶占位,腹盆腔CT检查:肝内多发低密度影,右肾区占位。
辅助检查:
2020-12-07行胸部+锁骨上区CT示:右中上肺、左肺散在微小结节,慢性炎性病变可能;纵隔、两锁骨上区、两腋窝多发淋巴结肿。
2020-12-07行上下腹CT示:右肾肿块并右肾周多发结节,考虑恶性肿瘤性病变,右肾动脉参与肿块供血,病灶旁多发迂曲增粗血管影(右肾静脉可能),不排除右肾上腺受累可能;肝脏、胰头、下腔静脉受压;肝多发囊肿;肝S7钙化灶或肝内胆管结石;腹膜后多发淋巴结肿。
2020-12-09行腹部彩超示:右肾肿瘤性病变;肝内多发性囊肿。
病理检查:
2020-12-10 右肾占位穿刺活检:可见异型细胞,考虑为癌细胞。
治疗经过:
2020-12-17行颅内肿瘤切除术,术后患者恢复良好。
术后病理示(右额叶)转移性癌,结合影像学检查及免疫组化,考虑肾癌转移。
2021-01-18至2021-01-28行术后放疗,开始使用舒尼替尼+PD-1单抗治疗。
2021-04-13,靶免治疗3个月后复查腹部CT,示右肾癌靶向治疗后,右肾及肾周肿瘤较前稍增大。腹膜后多发淋巴结肿,较前无明显变化。
颅脑MRI示右侧额叶转移瘤术后改变,术区少许积血较前稍减少,周围胶质增生水肿较前无明显变化。
2021-04-21 行腹腔镜下根治性右肾切除术+肾静脉瘤栓取出术。
术后病理示(右肾)乳头状肾细胞癌(II型,WHO/ISUP分级:3级),伴梗死、坏死、出血及纤维化,负荷治疗后改变;脉管癌栓(+),未见明确神经侵犯。肾周脂肪及肾窦脂肪未见侵犯;输尿管断端及肾上腺未见特殊。肾周淋巴结(5/9枚)可见癌细胞,其中6枚淋巴结内见纤维化及泡沫细胞聚集,符合治疗后改变。
(右肾静脉癌栓)镜下纤维结缔组织中见癌组织浸润。
术后行阿昔替尼(5mg bid po)+PD-1单抗治疗。复查无异常超过2年。
病例二
基本信息:患者女,50岁。2020-11,主诉因“左肾根治性切除术后1年余”入院。
现病史:
2019-12-12外院CT提示左肾占位性病变,于2019-12-20行左肾根治性切除,术后病理报告示透明细胞肾透明癌。后续定期外院复查及检测血压,血压正常。
2020-10-27外院CT示两肺多发结节影考虑多发转移瘤。
辅助检查:
检验结果:血常规、血生化未见异常、心电图未见异常
病理会诊:
左肾透明细胞性肾细胞癌,ISUP2级
无高血压、糖尿病及心脏病
2020-11 胸部CT示两肺多发转移瘤;纵隔2R组淋巴结肿大,转移可能。

治疗经过:入组“特瑞普利单抗联合阿昔替尼对比舒尼替尼单药一线治疗不可切除或转移性肾癌的随机、开放、阳性对照、多中心Ⅲ期临床试验”,成功入组临床试验试验组,口服阿昔替尼(5mg bid po),每3周给予特瑞普利单抗(240mg iv)。
治疗1月后复查,两肺多发转移瘤较前缩小。后多次复查,疾病稳定。
治疗29个月后复查,两肺多发转移瘤较前稍增多,部分较前增大,与患者沟通后继续原方案治疗。
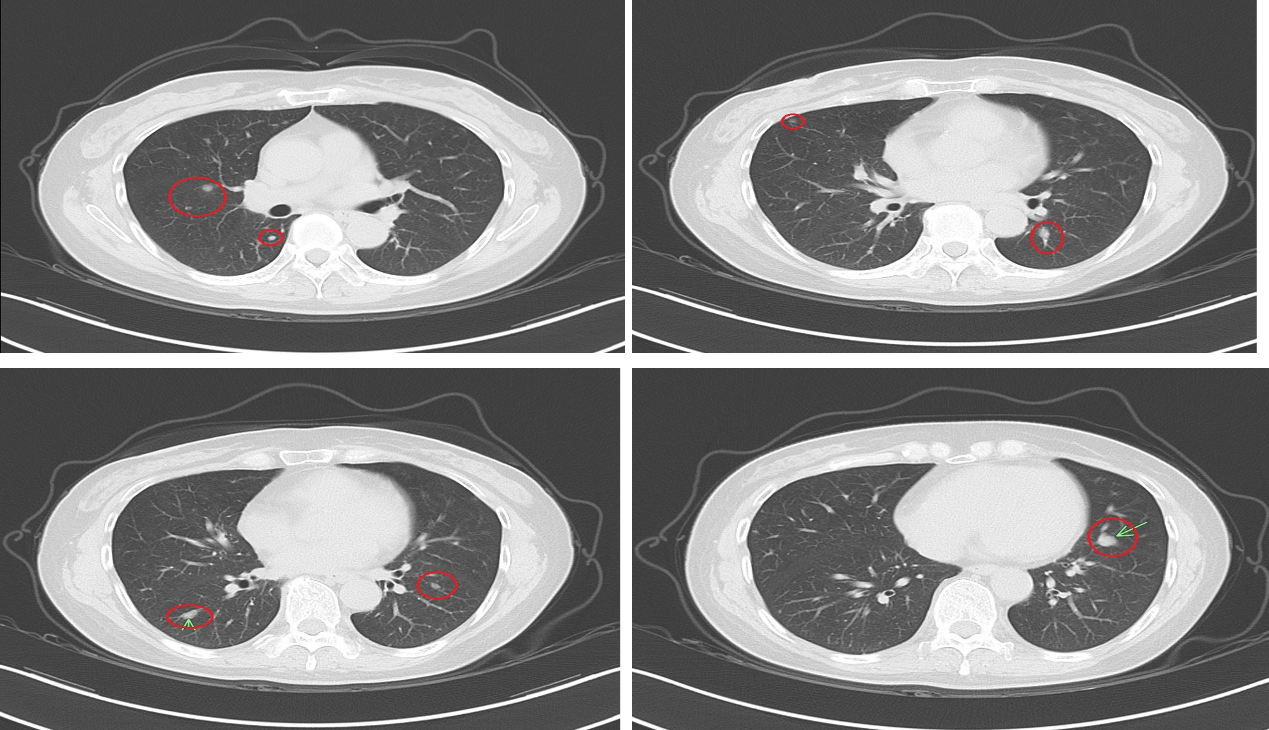
治疗31个月后复查,疾病SD。后复查至治疗后41个月,转移瘤较前稍缩小。
专家点评
安能教授:我们通过神经外科手术联合立体定向放疗控制脑部病灶后,对原发灶行根治性切除,持续使用阿昔替尼+特瑞普利单抗维持治疗已逾4年。目前正在探索延长免疫治疗间隔(调整为6-8周/次)的可行性,这可能是长期应答患者的优化管理方向。目前,CSCO分层治疗体系在临床应用中展现出良好适应性,特别是中高危患者一线靶免联合策略的普及。但后线治疗面临选择困境,HIF2α抑制剂的最新研究可能重塑治疗格局。医保政策对临床决策影响显著。
排版编辑:肿瘤资讯-Iris












 苏公网安备32059002004080号
苏公网安备32059002004080号


