间变性淋巴瘤激酶(ALK)融合是非小细胞肺癌(NSCLC)的一种重要分子亚型,占NSCLC的5-7%[1]。基于靶向药物的疗效和安全性,国内外指南均推荐ALK抑制剂(ALK-TKI)作为ALK阳性晚期NSCLC的一线治疗选择[2-3]。目前国内已有八种ALK-TKI获批,同时根据作用机制和疗效又分为三代,包括一代克唑替尼;二代塞瑞替尼、阿来替尼、布格替尼、恩沙替尼、伊鲁阿克、依奉阿克;三代洛拉替尼。如何为ALK阳性晚期NSCLC患者选择更优的治疗方案实现长生存的目标,已是临床医生关注的核心议题。对此,【肿瘤资讯】特邀江苏省肿瘤医院内科主任沈波教授“从患者获益角度探讨优化ALK阳性晚期NSCLC一线治疗选择”,以期待为临床医者带来专业思考。
江苏省肿瘤医院/南京医科大学附属肿瘤医院肿瘤内科主任
江苏省有突出贡献中青年专家
江苏省政协委员、农工党江苏省省委委员
江苏省医学会肿瘤化疗与生物治疗分会候任主委
江苏省医师协会肿瘤多学科诊疗专委会主委
中国抗癌协会 理事 中国临床肿瘤学会(CSCO)理事
国家卫健委能力建设和继续教育肿瘤学专委会委员
国家肿瘤质控中心肺癌质控专家委员会委员
中国抗癌协会小细胞肺癌专业委员会副主委
中国抗癌协会肿瘤临床化疗专委会常委兼秘书长
中国医师协会肿瘤多学科诊疗(MDT)专委会常委
中国医药教育协会肿瘤转移专委会副主委
中国初级卫生保健基金会基层肿瘤防治专委会副主委
CSCO非小细胞肺癌/血管靶向治疗专家委员会委员
江苏省免疫学会 副理事长/转化医学分会主委
江苏省整合医学研究会肺癌专委会主委
江苏省研究型医院学会罕见突变肿瘤专委会主委
“好药先用”:基于临床数据和患者获益,洛拉替尼是ALK阳性晚期NSCLC一线治疗首选之一
沈波教授:洛拉替尼作为唯一的三代ALK-TKI,采用独特大环结构,从而获得更强的抗肿瘤活性、更高的血脑屏障穿透性和更广的抗ALK突变谱,显示出前所未有的全身疗效和颅内疗效。CROWN研究中,经过5年的随访,洛拉替尼组的mPFS仍未达到,远高于对照组克唑替尼的mPFS(9.1个月),且HR仅为0.19,显著降低疾病进展或死亡风险。同时,洛拉替尼一线治疗ALK阳性NSCLC的5年PFS率高达60%,是迄今为止报道的小分子靶向药物单药治疗晚期NSCLC乃至转移性实体瘤最长的PFS[4]。
在颅内疗效方面,基线无脑转移患者5年无颅内进展率96%,114例基线无脑转移患者中仅4例发生脑转移, 5年脑转移累积发生率5%,显示出洛拉替尼可以阻遏新的脑转移发生。而基线有可测量颅内病灶患者,颅内病灶ORR为92%,颅内病灶CR率高达58%,显示出洛拉替尼可以有效控制脑转移病灶[4]。
近期CROWN研究的亚洲亚组数据全文公布,在亚洲人群中,洛拉替尼的5年PFS率为63%,克唑替尼为7%,HR为0.22(95% CI: 0.13-0.37)。在中国亚组中,经5年随访,洛拉替尼组mPFS仍未达到,5年PFS率为70%[5-6]。
安全性方面,经过5年的随访,长期使用洛拉替尼未出现新的安全性信号,洛拉替尼组治疗相关AE导致的永久停药率仅5%[7]。
总之,洛拉替尼一线治疗ALK阳性NSCLC显示出超长的PFS,其疗效优势完全符合患者“长生存”和“慢病化管理”的目标,是ALK阳性晚期NSCLC一线治疗首选之一。
“优化获新生”:存在不良预后因素或不可耐受AE的ALK阳性NSCLC患者,应优化一线治疗选择
沈波教授:ALK融合突变患者对ALK-TKI具有较高的敏感性和良好的预后,被称为“钻石突变”。然而,如果ALK融合患者存在不良预后因素,例如脑转移、ALK v3变体或合并TP53突变等,将显著降低患者的生存时间,应优化一线治疗选择,以获得更长的生存获益。
脑转移:
ALK阳性NSCLC患者初诊时脑转移的发生率高达20-40%[8-9],且患者发生脑转移后其生活质量明显降低,且预后较差。而一/二代ALK-TKI颅内病灶控制不足,患者生存期有待延长[10],因此对于正在接受一/二代ALK-TKI治疗的脑转移患者,应优化一线治疗选择。CROWN研究中,经过5年的随访,基线存在脑转移的患者,洛拉替尼组的mPFS仍未达到,远高于对照组克唑替尼的mPFS(6.0个月),且HR仅为0.08[4],见图1。
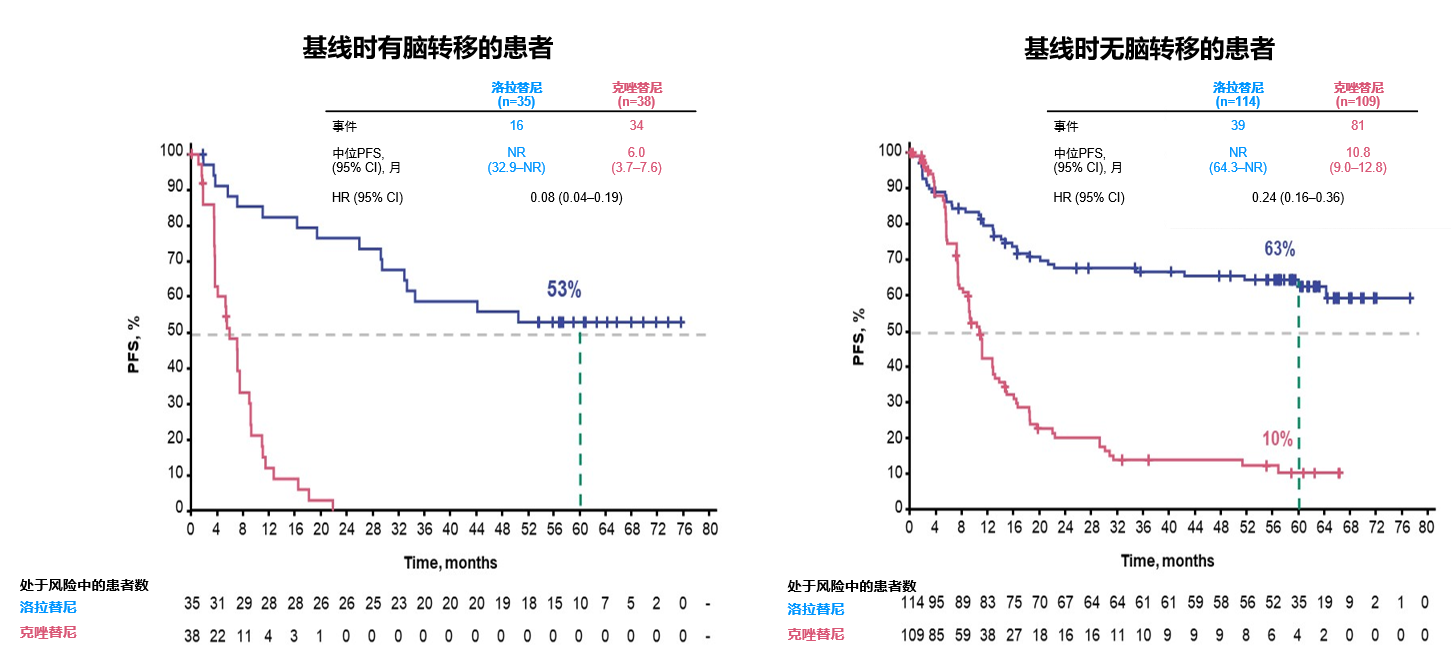
ALK v3变体:
EML4-ALK v1变体(E13;A20)和v3a/b变体(E6;A20)是最常见的EML4-ALK融合变体[11]。相对于v1变体,v3a/b变体对于ALK-TKI的敏感性更低,半数抑制浓度IC50更高,患者预后更差。一/二代ALK-TKI治疗v3变体患者的mPFS不足20个月[12-13]。而三代洛拉替尼一线治疗ALK v3变体的mPFS高达60个月,在数值高于一/二代ALK-TKI,因此对于ALK v3变体应进一步优化一线治疗选择。
合并TP53突变:
与ALK v3变体相似,ALK阳性NSCLC合并TP53突变也是不良预后因素之一。一/二代ALK-TKI治疗合并TP53突变患者的mPFS不足20个月[13-14]。而三代洛拉替尼一线治疗合并TP53突变的mPFS高达51.6个月,在数值高于一/二代ALK-TKI,因此对于合并TP53突变的患者也应进一步优化一线治疗选择。
不可耐受AE:
一般来说,相较于传统的细胞毒性药物,ALK-TKI的总体耐受性良好,但在既往的研究中也发现ALK-TKI存在胃肠道不良反应、药物性肝损伤、心血管不良反应、间质性肺炎(interstitial pneumonia,ILD)或贫血等不良反应[15]。大多数ALK‑TKI的AE是可控的,暂停ALK‑TKI和多学科综合治疗后AE级别可降低[16]。然而,对于减量、多学科综合治疗后仍无法耐受AE的患者,应进一步优化一线治疗选择,以确保患者在生存期延长的同时也收获高质量的生活。
临床实践:洛拉替尼力克二代ALK-TKI不可耐受AE
该患者为ALK阳性肺腺癌,一线接受二代ALK-TKI阿来替尼治疗后出现不可耐受AE,且洛拉替尼已纳入医保报销,患者主动要求调整为三代洛拉替尼后,不仅AE得到改善,且病灶控制稳定,实现了治疗效果与用药安全的双重获益。
一、基本情况
基本信息:女,29岁。
初诊主诉:无明显诱因下出现咳嗽咳痰,无发热、胸闷气促不适1月余。
现病史:2021年01月无明显诱因下出现咳嗽咳痰,无发热、胸闷气促不适。2021年02月外院胸腹部CT显示:右上肺结节,符合肺癌表现。双肺多发转移。右侧锁骨上、纵隔及右肺门多发肿大淋巴结。左侧肾上腺稍显增粗,左肾小囊肿,全身骨扫描未见异常,遂至我院就诊。
相关检查:
2021年2月25日胸部CT:右上肺结节,形态不规则,可见分叶及棘状突起,内见空腔,大小1.19*1.53cm。余双肺散在多发大小不等小结节影。右侧锁骨上、纵隔及右肺门见多发肿大淋巴结,较大者约1.88*2.25cm。考虑右上肺癌伴双肺多发转移。
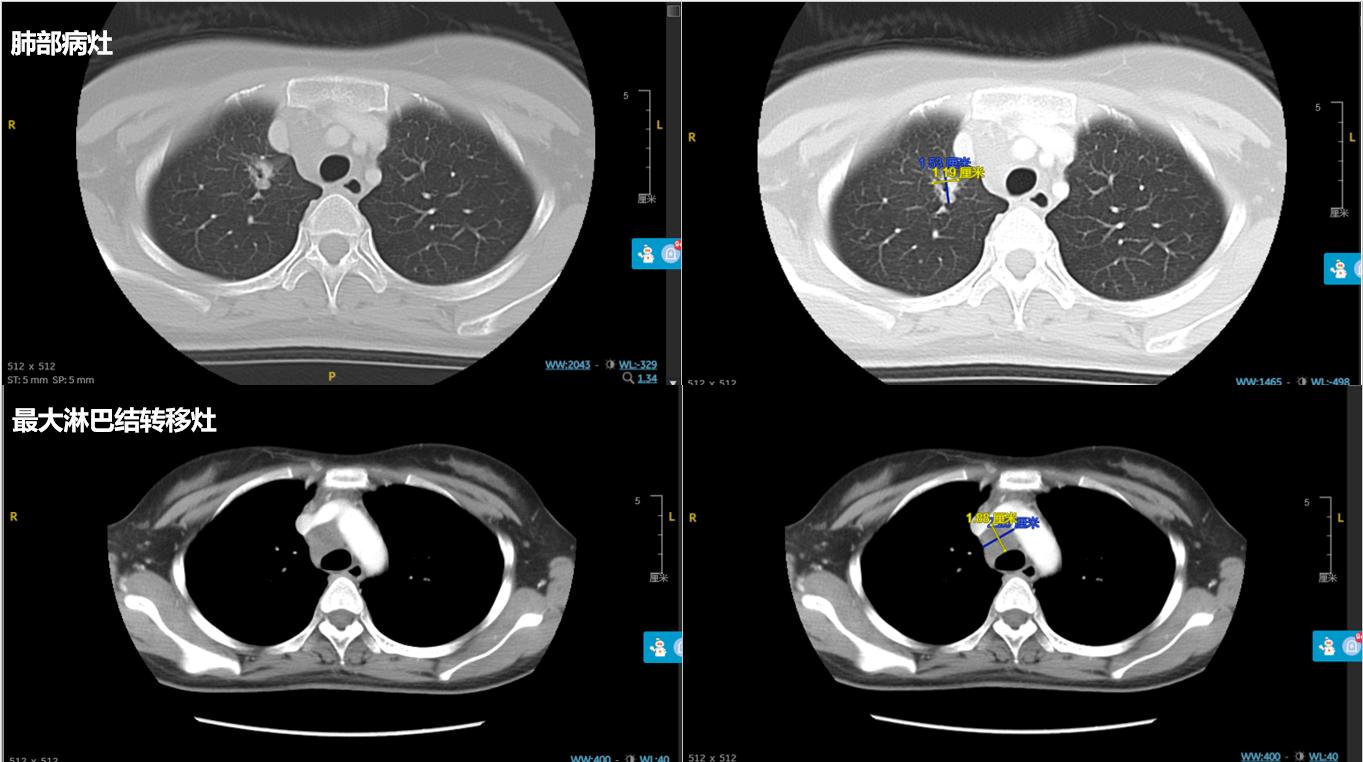
肿瘤标志物:2021年2月25日癌胚抗原(CEA)23 ng/ml,神经特异性烯醇化酶(NSE)17.4ng/ml。

病理结果:右肺结节穿刺,病理提示:中分化腺癌。
基因检测结果:EML4-ALK融合,TMB值为5.05Muts/Mb。MSS,PD-L1 TPS 1%。
临床诊断:肺恶性肿瘤,腺癌,IV期,cTNM: T1N2M1。
二、治疗经过
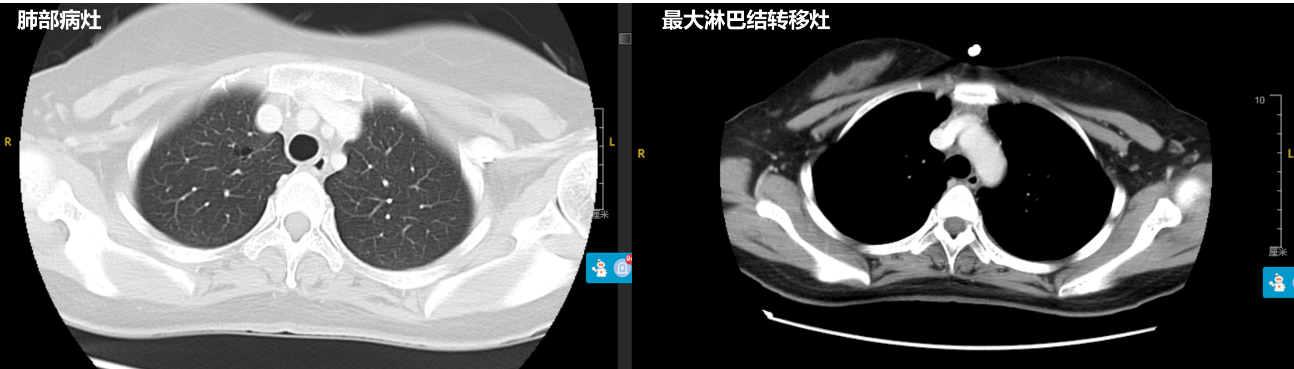
一线治疗:2021年2月患者开始行阿来替尼(600mg po bid)靶向治疗,2021年8月9日CT显示达到最佳疗效:右上肺结节仍呈空洞结节,实性成分基本不可见,大小约1.01×0.78cm。余双肺散在结节目前多已不明显,残留个别结节约3mm以内。右侧锁骨上、纵隔及右肺门原肿大淋巴结目前多退缩已不明显,局部仅见少许致密低密度影,不呈明显结节状。双侧胸腔未见积液。
后因不可耐受AE,2023年5月停用阿来替尼,调整为洛拉替尼治疗。本阶段阿来替尼的无进展生存期(PFS)为25个月左右。
2021年8月9日CT影像:
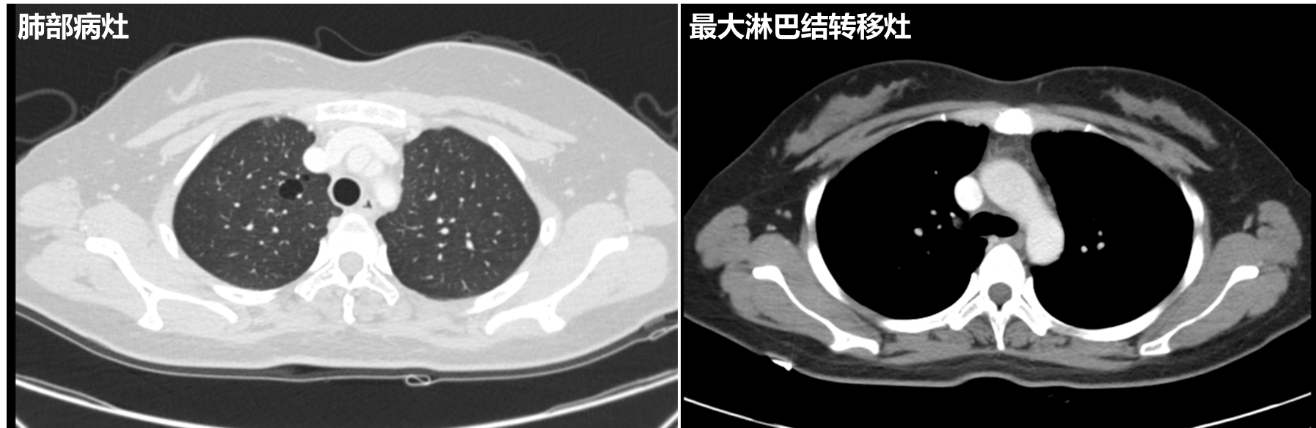
优化治疗:调整为洛拉替尼治疗至今,期间复查CT病情稳定,末次2025年1月14日复查 CT:右上肺结节实性成分仍基本不可见,目前呈空腔改变,相似层面测量截面约1.2*0.8cm,同前大致相似;余两肺散在多发微小空腔影同前相似;左上肺斑点较前相似。右侧锁骨上淋巴结较前变化不大,目前短径仍小于0.5cm;纵隔及右肺门淋巴结较前变化不大。
2025年1月14日CT影像:
三、病例总结
患者为29岁女性,诊断为晚期右上肺癌伴双肺多发转移,右侧锁骨上、纵隔及右肺门见多发肿大淋巴结,基因检测提示ALK阳性。患者一线接受阿来替尼治疗,后因不可耐受AE而调整为洛拉替尼。目前,患者接受洛拉替尼治疗后,肿瘤病灶控制稳定,未见肿瘤进展,PFS已超22个月。
综上所述,在精准治疗时代,将洛拉替尼作为ALK阳性晚期NSCLC一线治疗首选,不仅是“好药先用”理念的践行,更是基于中国人群特征的策略选择。同时,对于存在不良预后因素或不可耐受AE的ALK阳性NSCLC患者,应优化一线治疗选择,实现“更长生存”的目标。
[1] Tao H, Shi L, Zhou A et al. Distribution of EML4-ALK fusion variants and clinical outcomes in patients with resected non-small cell lung cancer. Lung Cancer. 2020 Nov;149:154-161.
[2] Riely GJ, Wood DE, Ettinger DS, et al. Non-small cell lung cancer, version10.2024, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw, 2024.
[3]中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南. 第1版. 北京: 人民卫生出版社, 2024: 7-9.
[4] Solomon BJ, Liu G, Felip E et al. Lorlatinib Versus Crizotinib in Patients With Advanced ALK-Positive Non-Small Cell Lung Cancer: 5-Year Outcomes From the Phase III CROWN Study. J Clin Oncol. 2024 Oct 10;42(29):3400-3409.
[5] Yi-Long Wu, et al. First-line lorlatinib vs crizotinib in Asian patients with ALK+ non-small cell lung cancer (NSCLC): 5-year outcomes from the CROWN study. 2024 ESMO. Poster 1279P.
[6] Wu YL, Kim HR, Soo RA et al. First-line lorlatinib versus crizotinib in Asian patients with advanced ALK-positive NSCLC: 5-year outcomes from the CROWN study. J Thorac Oncol. 2025 Feb 28:S1556-0864(25)00097-8.
[7] T. Bauer, et al. 2024 WCLC. Abstract MA06.08.
[8] Toyokawa G, Seto T, Takenoyama M, Ichinose Y. Insights into brain metastasis in patients with ALK+ lung cancer: is the brain truly a sanctuary? Cancer Metastasis Rev. 2015 Dec;34(4):797-805.
[9] Tan AC, Itchins M, Khasraw M. Brain Metastases in Lung Cancers with Emerging Targetable Fusion Drivers. Int J Mol Sci. 2020 Feb 19;21(4):1416.
[10] 中国医药教育协会肺癌医学教育专业委员会. 中国驱动基因阳性非小细胞肺癌脑转移临床诊疗指南(2025 版). 中国肺癌杂志. 2 0 2 5年1月第2 8卷第1期1-19.
[11] Schneider JL, Lin JJ, Shaw AT. ALK-positive lung cancer: a moving target. Nat Cancer. 2023 Mar;4(3):330-343.
[12] Camidge DR, Dziadziuszko R, Peters S, Mok T et al. Updated Efficacy and Safety Data and Impact of the EML4-ALK Fusion Variant on the Efficacy of Alectinib in Untreated ALK-Positive Advanced Non-Small Cell Lung Cancer in the Global Phase III ALEX Study. J Thorac Oncol. 2019 Jul;14(7):1233-1243.
[13] Camidge DR, Kim HR, Ahn MJ et al. Brigatinib Versus Crizotinib in ALK Inhibitor-Naive Advanced ALK-Positive NSCLC: Final Results of Phase 3 ALTA-1L Trial. J Thorac Oncol. 2021 Dec;16(12):2091-2108.
[14] Tanimoto A, Matsumoto S, Takeuchi S et al. Proteasome Inhibition Overcomes ALK-TKI Resistance in ALK-Rearranged/TP53-Mutant NSCLC via Noxa Expression. Clin Cancer Res. 2021 Mar 1;27(5):1410-1420.
[15] Zhou F, Yang Y, Zhang L et al. Expert consensus of management of adverse drug reactions with anaplastic lymphoma kinase tyrosine kinase inhibitors. ESMO Open. 2023 Jun;8(3):101560.
[16] 中国医师协会肿瘤医师分会,中国医疗保健国际交流促进会肿瘤内科学分会. 间变性淋巴瘤激酶酪氨酸激酶抑制剂治疗晚期非小细胞肺癌中国专家建议(2024 版).中华医学杂志,2024,104(7):473-485.
排版编辑:肿瘤资讯-IR











 苏公网安备32059002004080号
苏公网安备32059002004080号


