急性髓系白血病(AML)是一种高度侵袭性且预后较差的血液肿瘤,其治疗一直是全球血液学研究的焦点。尽管面临多重挑战,随着新药的不断开发以及治疗方案的逐步优化,AML患者的治疗选择显著增多,其预后也得到明显的改善。在众多方案中,阿糖胞苷联合伊达比星(7+3方案)凭借其卓越的疗效成为AML治疗的基石。该方案不仅在年轻患者中展现出显著疗效,还在老年患者、具有中高危特征、预后不良以及伴随特殊基因突变的AML患者中显示出较好的治疗潜力,为这些患者群体提供了新的治疗希望。
在召开的第66届美国血液学年会(ASH 2024)上,7+3方案在AML治疗中的新进展将成为一个重要议题。特别是在诱导治疗、巩固治疗以及老年和中高危患者的个体化应用方面,相关研究将陆续亮相。【肿瘤资讯】特别遴选出其中5项具有代表性的研究成果,邀您先睹为快!
不朽经典:以7+3方案为代表的强化疗方案仍是AML治疗基石
➢诱导治疗
0971:IIb期研究最新结果——VEN-DEC vs 7+3 方案作为新诊断AML诱导治疗的疗效差异[1]
主要研究目的
本项II期研究旨在对比维奈克拉联合地西他滨(VEN-DEC)方案与标准 7+3 方案(阿糖胞苷联合伊达比星[IA-12])在适合接受强化疗治疗新诊断AML患者中的疗效和安全性。
主要研究方法
研究纳入188例18~59岁,适合接受强化疗的中国新诊断AML患者,中位年龄为45岁。入组患者将按1:1的比例随机分组,分别接受VEN-DEC方案或IA-12方案作为诱导治疗。
治疗方案:
● IA-12组:伊达比星(12 mg/m²,D1~D3)+阿糖胞苷(100 mg/m²,D1~D7)
● VEN-DEC组:VEN(400mg,D1~D28)+DEC(20mg/m2,D1~D5)
研究的主要终点为复合完全缓解 (CRc),次要终点为诱导治疗期间≥3级感染的发生率、严重骨髓抑制的持续时间、无事件生存期 (EFS)、总生存期 (OS) 和诱导治疗后MRD阴性率。而研究的探索性终点是两种治疗方案在细胞遗传学亚组中的疗效。
主要研究结果
● 中位随访12.1个月时,两组的中位生存期均未达到,而中位EFS或OS无显著差异(p=0.705)。
● 对于CEBPAbZIPAML患者,接受IA-12方案治疗的1年无复发生存率(RFS)明显更高(85.1%vs52.5%,p=0.017)。
● VEN-DEC组的CRc率为89%,IA-12组CRc率为79%(非劣效性检验,p=0.0021),VEN-DEC方案与IA-12方案相比具有非劣效性。
● 两组达CRc患者的MRD阴性率均为80%。亚组分析显示,IA-12方案可为RUNX1::RUNX1T1亚组患者带来更大的获益(88%vs44%)。
● VEN-DEC组和IA-12组分别有30%和63%的AML患者发生≥3级感染。而VEN-DEC组82%的患者和IA-12组93%的患者发生了3~4级血液学不良事件(AE)。IA-12组重度中性粒细胞减少症的中位持续时间相对更短(23天vs19天,p=0.001),而严重血小板减少症的中位持续时间(19天vs13天,p<0.001)相对更长。
主要研究结论
对于适合接受强化疗的60岁以下新诊断AML成人患者,IA-12方案与VEN+DEC方案的疗效相似,可诱导患者的深度缓解。而RUNX1::RUNX1T1和CEBPAbZIP AML患者接受IA-12方案获益更大。
既往研究证实,去甲基化药物(HMA)与BCL-2抑制剂维奈克拉(VEN-HMA)联合使用可改善ALL老年患者的OS率,但伴有严重并发症的AML患者可能无法从中获益。7+3方案作为AML诱导治疗中的经典方案,不仅在年轻患者中显示出卓越的疗效和良好的安全性,且在老年患者群体中同样表现出色。研究表明,虽然AML老年患者伴随年龄增长而面临较高的治疗风险,但该方案诱导治疗仍然能够提供为其良好的缓解率,并且通过优化剂量和支持性治疗,有效控制了AE的发生。另外,以7+3方案为代表的强化疗方案作为中高危AML患者的诱导治疗也同样疗效显著。
P1473:Ind-CTX方案vsVEN-HMA方案治疗65~75岁新诊断AML患者的疗效[2]
主要研究目的
研究旨在比较VEN-HMA和强化疗(Ind-CTX)在65~75岁新诊断AML患者中的疗效。
主要研究方法
本项回顾性队列研究共纳入730例65~75岁新诊断AML患者。研究中共有92例AML患者接受Ind-CTX治疗,61例患者接受VEN-HMA方案治疗。Ind-CTX 组患者中位年龄为69岁,VEN-HMA组患者中位年龄为70岁。
研究者比较了入组患者接受VEN-HMA方案或强化疗(Ind-CTX,阿糖胞苷100mg/m2,7天;蒽环类药物3天)+/- 米哚妥林或gemtuzumab ozogamicin方案的治疗效果。
主要研究结果
● Ind-CTX组的CRc率为63%,而VEN-HMA组为52%。在多变量逻辑回归中,Ind-CTX和VEN-HMA组的CRc率之间没有统计学差异(p=0.3)。
● Ind-CTX组的PS加权中位OS为16个月,VEN-HMA组则为13个月。在PS加权Cox比例风险模型(CPH)中,两组的中位OS之间没有显著差异(p=0.6)。
● Ind-CTX组的PS加权中位EFS为7.1个月,VEN-HMA组则为8.2个月。在PS加权CPH中,两组的中位EFS之间没有显著差异(p=0.4)。
● 研究OS和EFS的中位随访期均为34个月,分别有113例AML患者死亡和120例患者进展或死亡。
主要研究结论
本项倾向评分调整的研究显示,在疗效和生存获益方面,65~75岁新诊断AML患者接受Ind-CTX方案与VEN-HMA方案诱导治疗无显著差异。
P4234:在VEN时代,“Medically Fit”的老年AML患者是否应继续接受强化化疗?[3]
主要研究目的
本研究旨在探讨AML老年患者在接受以VEN为基础的治疗或IC方案作为一线治疗时的临床特征、治疗反应及生存结局。
主要研究方法
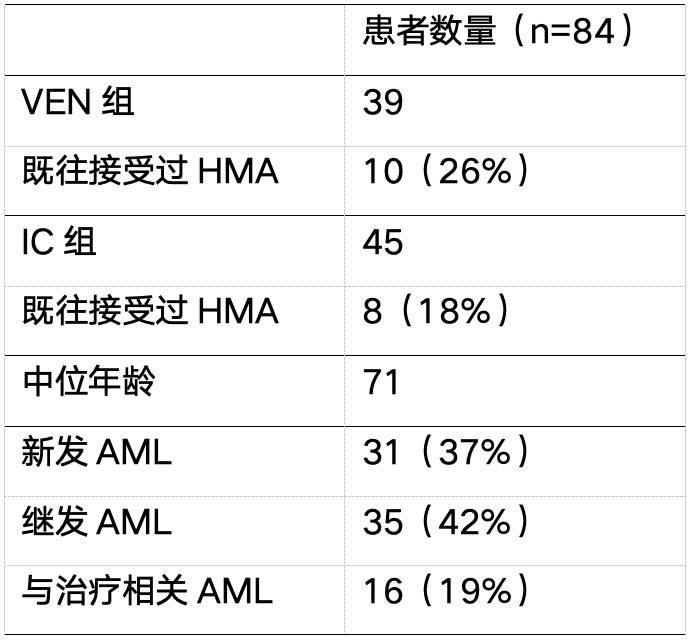
本项回顾性研究最终纳入的84例前期接受了VEN基础治疗(46.4%)或IC(53.6%)治疗的AML患者。IC组患者的基线骨髓原始细胞比例更高 (p= 0.028),且患者诊断时白细胞计数也有更高的趋势 (p=0.065)。另外,IC组中有利风险的AML患者比例更高。而VEN组患者的DNMT3A和IDH1/2突变率高于IC组。
主要研究结果
● 中位随访时间为12.7个月,尽管IC组患者的基线骨髓原始细胞比例更高,但其生存结果仍与VEN组患者相似。IC组与VEN组的中位OS分别为15.4和9.3个月(p=0.10)。而在有利/中等风险AML患者中,IC组与VEN组的中位OS分别为18个月和9.3个月(p=0.086);在不利风险患者中,IC组与VEN组的中位OS分别为11.9个月和10个月(p=0.81)。
● 研究的CR率为43%,CR伴部分血液学恢复(CRh)率为6%,CR伴血液学不完全恢复(CRi)率为2%,11%的AML患者达到形态学无白血病状态。
●IC组CR率更高(53.3%vs30.8%,p=0.037),但两组的CRc率没有差异。IC组和VEN组分别有9%和3.2%的AML患者在首次达CR(CR1)时接受了移植(p=0.64)。
● 通过分析发现,新发AML(p=0.0018)和有利/中等风险(p=0.02)是与AML患者的CRc相关的因素。另外,既往患有MDS/MPN(p=0.0004)和TP53突变(p=0.03)的AML患者CRc显著较差。
●新发AML(p<0.0001)、MR细胞遗传学(p=0.02)和TP53突变(p=0.03)为AML患者OS的重要协变量。而治疗相关AML(p<0.0001)和既往MDS/MPN(p=0.0023)患病史可能会导致AML患者死亡风险增加。
主要研究结论
与以VEN为基础的治疗相比,IC诱导方案在有利/中等风险AML老年患者中显示出更大的OS获益。对于不利风险AML患者,两种治疗方案的生存获益相似。
P2900:与HMA/VEN相比,7+3强化疗方案可为无法进行移植的中等/不利风险的AML患者带来更好的生存[4]
主要研究目的
研究探索了无法进行异基因造血干细胞移植(allo-SCT)的中等和不利风险AML患者接受IC方案与HMA/VEN的疗效差异。
主要研究方法
共有158例18~75岁、曾接受HMA/VEN治疗或IC治疗且为中等/不利风险的新诊断AML成人患者符合入组条件。HMA/VEN 组和IC组患者的中位年龄均为66岁。
治疗方案:
● HMA/VEN组:阿扎胞苷(75mg/m²,D1~D7)或DEC(20mg/m²,D1~D5)/VEN(400mg/D,每个周期的D21~D28)
● IC组:7+3方案(伊达比星:12mg/m²[≤65岁的AML患者]; 柔红霉素:45mg/m²[>65岁的AML患者])
● 米哚妥林:FLT3突变的AML患者
主要研究结果
● 相比于HMA/VEN治疗组,IC治疗组的中位OS显著延长(21个月 vs 6个月,p<0.001)。在无法接受allo-SCT的AML患者中,无论一线治疗是否缓解,IC组的中位OS均优于HMA/VEN组(所有无法移植患者:7.5个月 vs 4个月,p=0.006;未缓解患者:18个月vs11个月,p=0.05)。然而,对于接受移植的AML患者,两组间的中位OS差异无统计学意义。
● C1后,IC组的ORR(CR/CRi/MLFS)和最佳ORR均相对更高(ORR:67%vs45%[p<0.01];最佳ORR:71%vs61%[p<0.01])。另外,在CR率方面,IC组同样具有优势(61%vs40%[最佳反应][p<0.01])。
● 与HMA/VEN组(10%)相比,IC组(n=30,38%)进行了allo-SCT的患者比例更高(p=0.01)。
● HMA/VEN组和IC组的30天死亡率分别为14%和12%。
主要研究结论
在中等/不利风险AML患者中,与HMA/VEN方案诱导治疗相比,IC方案诱导治疗显示出更高的缓解率。对于无法进行allo-SCT的AML患者,采用IC方案治疗可显著提高患者后续接受移植的可能性,有望进一步改善患者的生存预后。在接受移植的AML患者中,无论前线治疗方案如何,两组患者的生存获益均相似。
➢巩固治疗
O972:III期研究—高剂量阿糖胞苷联合伊达比星vs高剂量阿糖胞苷作为达CR1 AML患者巩固治疗的疗效差异[5]
主要研究目的
研究探索了高剂量阿糖胞苷联合伊达比星作为CR1 AML巩固治疗的疗效和安全性。
主要研究方法
符合入组条件的407例处于CR1 AML患者按随机分配(1:1比例)接受高剂量阿糖胞苷联合伊达比星(IA3+3)方案或高剂量阿糖胞苷(HDAC)作为首次巩固治疗。
治疗方案:
● IA3+3组:伊达比星10mg/m2,D1~D3;阿糖胞苷2g/m2,D1~D3
● HDAC组:阿糖胞苷3g/m2,D1~D3
主要研究结果
● IA3+3组和HDAC组的MRD阴性率分别为65.2%和53.2%(p=0.01)。
● 中位随访时间37.3个月,IA3+3组和HDAC组的3年累积发生率(CIR)、无疾病进展(DFS)率、OS率和移植相关死亡率(TRM)分别为22.6%和34.0%(p=0.01),68.4%和52.9%(p=0.003),75.5%和69.6%(p=0.18),8.8%和13.0%(p=0.23)。
● IA3+3组和HDAC组分别有87例和114例(P=0.006)AML患者接受allo-HSCT。
● 在首次巩固治疗后28天内,最常见的3级或更高级别的不良事件(AE)包括血小板减少症(96% vs 97%)和中性粒细胞减少症(96% vs 91%)等。IA3+3组有1例AML患者死于感染。
主要研究结论
与HDAC方案相比,IA3+3方案作为首次巩固治疗能为AML患者带来更深层次的缓解,降低复发风险,并且耐受性良好。而这种更深层次的缓解进一步改善了AML患者的DFS,并转化为治疗优势,使得需要通过allo-HSCT延长生存的患者更少。因此,IA3+3方案可能是达CR1 AML患者更有效的巩固治疗选择。
总结
近期研究表明,在AML诱导治疗中,7+3方案在携带RUNX1::RUNX1T1或CEBPAbZIP突变的患者中表现出更加显著的疗效。此外,在65~75岁老年AML患者中,7+3方案强化疗方案同样展现出潜在价值。对于无法接受allo-SCT的中高危AML患者,7+3强化治疗显示出更大的生存获益。这一发现进一步支持了在无法进行allo-SCT的AML患者中采用7+3方案化疗可能是更优治疗选择。
在AML巩固治疗方面,高剂量阿糖胞苷联合伊达比星方案在实现更深缓解、降低复发风险方面展现了优异的效果,同时具备良好的耐受性。这一方案可能成为AML患者CR1后更有效的巩固治疗选择。
综上所述,以上研究结果为以阿糖胞苷联合伊达比星(7+3方案)为代表的强化疗方案在AML治疗中的核心地位提供了进一步证据,并凸显了其在不同患者群体中的显著优势。随着新药的引入和治疗方案的持续优化,AML患者的预后有望不断改善,未来将有更多患者从中受益。此类研究的持续推进,不仅拓宽了AML治疗的视野,也为个体化治疗策略的制定提供了重要依据。
1. 2024ASH #971 Venetoclax and Decitabine Compared with Standard Intensive Chemotherapy As Induction Therapy in Newly Diagnosed Acute Myeloid Leukemia: Updated Results of a Multicenter, Randomized, Phase 2b Trial.
2. 2024ASH #1473 Outcomes of Newly Diagnosed Acute Myeloid Leukemia Patients between 65-75 Years and Treated with Intensive Induction Chemotherapy Versus Hypomethylating Agents and Venetoclax: A Propensity Score Adjusted Cohort Study.
3. 2024ASH #4234 Should “Medically Fit” Older Patients with Acute Myeloid Leukemia (AML) Continue to Receive Intensive Chemotherapy in the Venetoclax (VEN) Era?
4. 2024ASH #2900 Superior Survival with Intensive Chemotherapy, Compared to Hypomethylating Agent + Venetoclax, in Patients with Intermediate/Adverse Risk Acute Myeloid Leukemia Unable to Proceed to Transplant.
5. 2024ASH #972 High-Dose Cytarabine with Idarubicin Versus High-Dose Cytarabine within First Consolidation for Acute Myeloid Leukemia in First Complete Remission: An Open-Label, Multicenter, Randomized, Phase 3 Trial.
排版编辑:肿瘤资讯-Julian











 苏公网安备32059002004080号
苏公网安备32059002004080号


