脑转移是肺癌患者常见的远处转移部位,约一半肺癌患者会发生脑转移。脑转移患者预后差,且治疗手段有限,临床存在较大未被满足的需求。近年来,以抗体偶联药物(ADC)为代表的新型疗法异军突起,为晚期肺癌和伴脑转移患者的治疗带来了新希望。【肿瘤资讯】特邀华中科技大学同济医学院附属协和医院董晓荣教授解读ADC药物在肺癌脑转移治疗领域的新进展与未来方向。
专家介绍
教授 主任医师 博士生导师
中国临床肿瘤学会理事
中国抗癌协会非小细胞肺癌专业委员会 常委
中国抗癌协会免疫治疗专业委员会 常委
中国临床肿瘤学会非小细胞肺癌专家委员会 常委
中国临床肿瘤学会免疫专业委员会 常委
中国临床肿瘤学会肿瘤生物标志物专家委员会 常委
中国临床肿瘤学会血管靶向专家委员会 常委
湖北省抗癌协会肿瘤免疫治疗专业委员会 主任委员
湖北省女医师协会精准医疗专业委员会 主任委员
湖北省医学生物免疫学会肿瘤专委会 主任委员
脑转移患者预后差,ADC在脑转移患者中展现重要临床价值
Q1:近期您的团队在肿瘤领域权威期刊发表了一篇关于抗体偶联药物在肺癌脑转移领域的综述,能否请您介绍下这篇综述的核心内容?
董晓荣教授:
现状:肺癌是全球发病率和死亡率最高的癌症,脑部是肺癌患者最常见的转移部位之一。临床上脑转移的治疗通常需要在全身治疗的基础上结合局部治疗。目前脑转移的治疗模式取决于患者的整体健康状况、脑病灶的数量和位置及颅外肿瘤的活动程度,需要多学科团队的管理。此外,尽管近20年来,靶向和免疫疗法的出现为肺癌脑转移患者带来了疗效提升,但也面临耐药后治疗选择有限的难题。
ADC在肺癌脑转移治疗中具有重要价值和前景:ADC是近年来发展极其迅速的新型疗法,由单克隆抗体、细胞毒药物和连接子组成,通过抗体的精准靶向作用,将细胞毒药物精准递送至肿瘤细胞,从而杀伤肿瘤。ADC凭借其优化的结构设计、合适的药物抗体比(DAR)、强效的细胞毒性等优势,有效杀伤肿瘤细胞。
在临床研究中,新一代ADC药物,如T-DXd(德曲妥珠单抗)、HER3-DXd、I-DXd等在肺癌脑转移患者中均展现出良好的颅内抗肿瘤活性。未来,ADC药物临床研究的推进将进一步助力优化治疗策略,为肺癌脑转移患者提供更加个体化和精准的治疗方案[1]。
T-DXd、HER3-DXd、I-DXd在晚期肺癌中均展现优异颅内疗效
Q2:ADC药物在NSCLC和SCLC的相关临床研究中,均显示出卓越的颅内疗效。请您解读下,T-DXd、HER3-DXd、I-DXd的相关颅内疗效数据?
董晓荣教授:
德曲妥珠单抗的全身疗效和颅内疗效:DESTINY-Lung01研究显示,德曲妥珠单抗在33例无症状、伴脑转移的HER2突变晚期NSCLC中的客观缓解率(ORR)达54.5%,与无脑转移患者的ORR(55.2%)相当;伴脑转移患者的中位无进展生存期(PFS)为7.1个月,与无脑转移患者的8.2个月的PFS相当。研究结果表明,德曲妥珠单抗可有效治疗HER2突变NSCLC患者的颅内肿瘤[2]。
DESTINY-Lung01/DESTINY-Lung02汇总分析显示[3]:5.4 mg/kg剂量组中,脑转移和无脑转移亚组患者确认的ORR分别为46.9%、50.0%。5.4mg/kg和6.4mg/kg剂量组中,脑转移患者的中位PFS均为7.1个月,基线无脑转移患者的中位PFS分别为18.0个月、11.9个月。结果表明,无论患者基线时是否有脑转移,两剂量均显示出优异的疗效和获益。在基线有可测量脑转移病灶的患者中,5.4mg/kg剂量组确认的颅内ORR为50%,其中21.4%的患者达到颅内完全缓解(CR)。6.4mg/kg剂量组确认的颅内ORR为30.0%。无论基线时脑转移的治疗状态如何,患者的颅内应答一致。需要指出的是,因样本量有限,存在数据偏移的可能,还需要更多临床研究的验证。
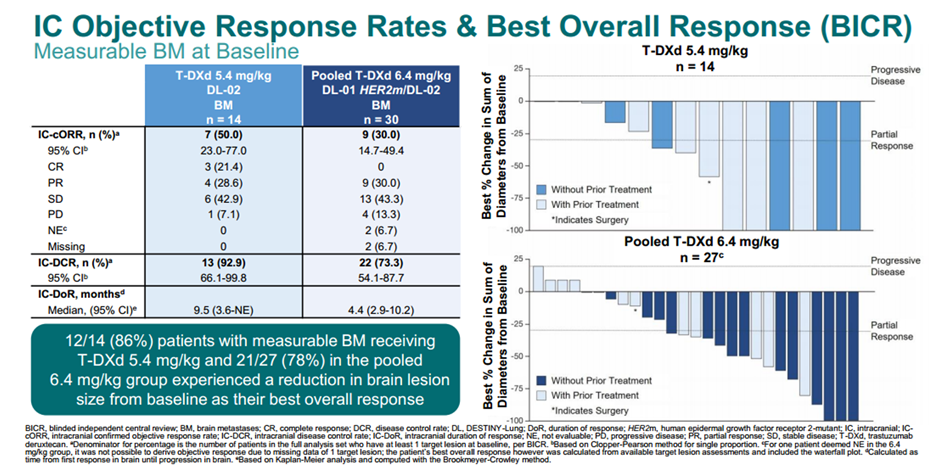
HER3-DXd的全身疗效和颅内疗效:HERTHENA-Lung01研究显示,HER3-DXd在225例既往接受过EGFR-TKI和含铂化疗的EGFR突变NSCLC患者中,展现出优异的全身疗效,确认的ORR为29.8%,疾病控制率(DCR)为73.8%,中位总生存期(OS)为11.9个月。在30例基线有脑转移且未接受放疗的患者亚组中,确认的颅内ORR为33.3%,有30%的患者达到CR,中枢神经系统(CNS)DCR为76.7%,中位CNS缓解持续时间(DoR)为8.4个月。上述研究数据表明,基线有无脑转移,均不影响HER3-DXd的优异疗效,且HER3-DXd显示出与全身治疗一致优异的颅内抗肿瘤活性[5]。
I-DXd的全身疗效和颅内疗效:IDeate-Lung01研究显示,2024 WCLC大会上公布的数据显示[6],I-DXd在广泛期小细胞肺癌(ES-SCLC)患者中显示出优异的全身疗效,12mg/kg I-DXd的ORR是54.8%。在基线伴有脑靶病灶的患者亚组中,12mg/kg I-DXd(n=10)的颅内ORR为50.0%,其中CR率、PR率分别为20%、30%。研究结果显示,I-DXd也具有优异的颅内疗效,期待未来更大样本量的研究结果[6]。
ADC药物的透脑性取决于肿瘤微环境、治疗手段的协同、优化的药物设计等多种因素
Q3:尽管德曲妥珠单抗(T-DXd)等药物在临床研究中已显示明确的颅内疗效结果,但临床医生可能还会顾虑大分子药物透过颅脑屏障的能力。请您解读ADC具有颅内疗效的潜在作用机制?
董晓荣教授:
血脑屏障被破坏:脑转移瘤的存在会显著破坏血脑屏障(BBB)的完整性,形成血肿瘤屏障(BTB)。这种破坏使得大分子药物(如ADC)更容易进入脑转移灶。例如,核素标记的抗HER2单克隆抗体(如曲妥珠单抗)在乳腺癌脑转移患者中的PET成像研究显示,药物在脑转移灶中的摄取显著增加。
放疗的协同作用:放疗是脑转移治疗的重要手段,能够有效破坏血脑屏障,增加药物的渗透性。放疗诱导的血管通透性增加和炎症反应可以进一步促进ADC药物进入脑部肿瘤微环境。
ADC药物的特性:新一代ADC药物如T-DXd,通过优化设计使得:①载药DXd能够高效抑制肿瘤细胞生长,且DXd是细胞外排蛋白的弱底物,能够有效聚集于肿瘤细胞内,从而能更好地发挥抗肿瘤作用;②旁观者效应杀伤临近肿瘤细胞;③T-DXd均一性好,有利于透过血肿瘤屏障。以上可能是ADC药物发挥更高颅内疗效的原因。
临床前研究显示,在乳腺癌脑转移的小鼠模型中,T-DXd显著抑制肿瘤体积并延长了生存时间。结果提示,T-DXd能够有效穿透血脑屏障,并对脑转移灶具有显著的抗肿瘤效果。整体而言,ADC药物具有较好的透脑性,不仅得益于肿瘤微环境和治疗手段对血脑屏障的破坏,还依赖于药物自身的结构设计和递送机制。这些因素共同作用,使得DXd-ADC药物在脑转移治疗中展现出良好的疗效。
深度探索ADC机制、联合策略,助力克服肺癌脑转移治疗难题
Q4:随着新药研发的快速推进,您认为ADC用于肺癌脑转移还有哪些值得探索的研究领域?
董晓荣教授:
①从基础研究、临床研究的角度,针对ADC药物作用于肺癌脑转移的机制展开探索,如核素标记的ADC用于示踪转移病灶的研究,以便从机制上明确ADC药物如何发挥疗效。②ADC与其他治疗手段的联合应用值得重点关注:例如,探索ADC与免疫检查点抑制剂的联合治疗策略,以进一步增强抗肿瘤活性或颅内活性;研究ADC联合放疗不同模式在脑转移患者中的疗效;探索ADC联合疗法在HER2突变NSCLC脑转移患者一线治疗的疗效。期待未来,有更多联合策略的研究结果为脑转移的临床治疗提供新思路。③优化ADC结构设计:如选择更优的靶点和载药,进一步提升ADC的疗效及其在颅内的疗效。
以上研究方向有助于克服当前脑转移治疗面临的问题和挑战,有希望为肺癌脑转移患者带来更多的治疗选择和更好的生存获益。
[1]Zhou H, Zeng Y, Hida T, et al. The current landscape and prospects of antibody-drug conjugates for lung cancer brain metastases: a narrative review. Transl Lung Cancer Res. 2024 Dec 31;13(12):3778-3794. doi: 10.21037/tlcr-24-964. Epub 2024 Dec 27. PMID: 39830739; PMCID: PMC11736593.
[2]Li BT, Smit EF, Goto Y, et al. Trastuzumab Deruxtecan in HER2-Mutant Non-Small-Cell Lung Cancer. N Engl J Med. 2022 Jan 20;386(3):241-251. doi: 10.1056/NEJMoa2112431. Epub 2021 Sep 18. PMID: 34534430; PMCID: PMC9066448.
[3]Trastuzumab Deruxtecan in Patients With HER2 (ERBB2)-Mutant Metastatic Non–Small Cell Lung Cancer With and Without Brain Metastases: Exploratory Pooled Analyses From DESTINY-Lung01 and DESTINY-Lung02.2023 ESMO, Abstract 1321MO.
[4]Jänne PA, Baik C, Su WC, et al. Efficacy and Safety of Patritumab Deruxtecan (HER3-DXd) in EGFR Inhibitor-Resistant, EGFR-Mutated Non-Small Cell Lung Cancer. Cancer Discov. 2022 Jan;12(1):74-89. doi: 10.1158/2159-8290.CD-21-0715. Epub 2021 Sep 21. Erratum in: Cancer Discov. 2022 Jun 2;12(6):1598. doi: 10.1158/2159-8290.CD-22-0365. PMID: 34548309; PMCID: PMC9401524.
[5]Yu HA, Goto Y, Hayashi H, et al. HERTHENA-Lung01, a Phase II Trial of Patritumab Deruxtecan (HER3-DXd) in Epidermal Growth Factor Receptor-Mutated Non-Small-Cell Lung Cancer After Epidermal Growth Factor Receptor Tyrosine Kinase Inhibitor Therapy and Platinum-Based Chemotherapy. J Clin Oncol. 2023 Dec 10;41(35):5363-5375. doi: 10.1200/JCO.23.01476. Epub 2023 Sep 10. PMID: 37689979; PMCID: PMC10713116.
[6]Ifinatamab Deruxtecan (I-DXd) in Extensive-Stage Small Cell Lung Cancer (ES-SCLC): Interim Analysis of Ideate-lung01,2024 WCLC, Abstract OA04.03
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


