抗体偶联药物(ADC)由单克隆抗体、细胞毒药物及连接子构成,通过靶向递送机制实现精准杀伤肿瘤细胞,兼具高选择性和高效力。近年来,ADC在肺癌治疗领域取得显著进展,2022年FDA批准德曲妥珠单抗治疗HER2突变非小细胞肺癌(NSCLC),标志肺癌ADC治疗元年的开启。目前,靶向HER2、TROP2等靶点的ADC在NSCLC中的应用价值已得到临床试验证据支持,联合治疗策略及生物标志物相关探索正持续推动领域发展。
第22届肺癌高峰论坛于2025年2月28日-3月1日在广州盛大召开,本届论坛聚焦于“肺癌新型治疗的机遇与挑战”这一议题,深入探讨新型疗法在领域内的应用和发展。其中,上海交通大学医学院附属胸科医院陆舜教授围绕ADC的发展历程、技术突破及临床挑战进行了系统阐述。【肿瘤资讯】特别整理核心内容,以飨读者。
ADC的百年演进:“魔法子弹”从构想到实现
“魔法子弹”的诞生和发展
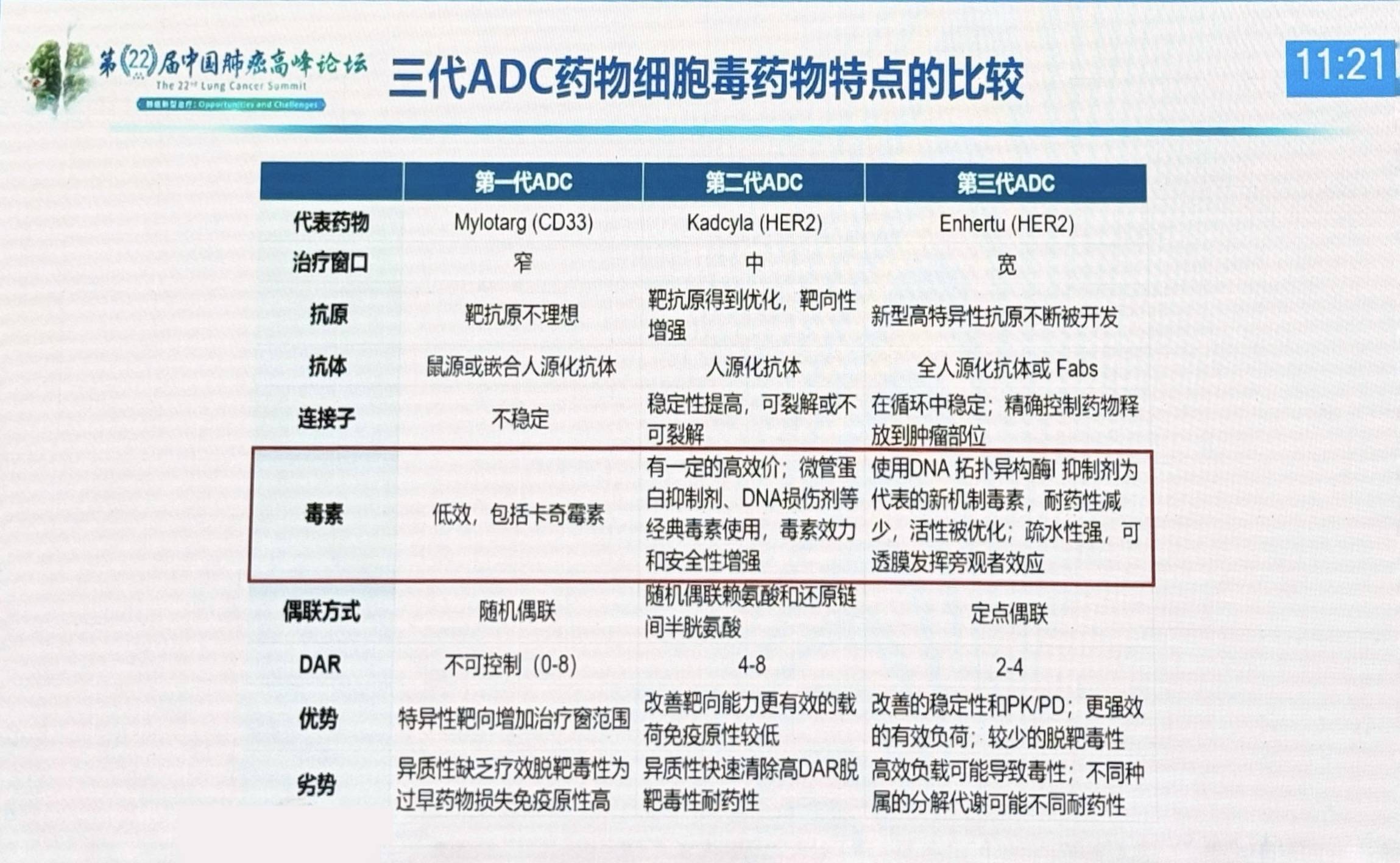
ADC的概念可追溯至120年前德国科学家Paul Ehrlich提出的“魔法子弹”设想,即通过靶向载体将毒性药物精准递送至病灶。2000年以来涌现的第一代ADC由于鼠源抗体免疫原性强、连接子稳定性差等问题,疗效受限;2010年后,第二代ADC采用人鼠嵌合抗体,部分解决了免疫原性问题;至2020年左右,第三代ADC通过全人源化抗体、可裂解连接子及高效载荷技术,显著提升了稳定性和治疗指数。截至2023年8月,共有16款ADC已获FDA批准上市,7款为血液肿瘤适应证,9款为实体瘤适应证。

靶点表达与ADC疗效相关性
在ADC靶点探索中,HER2和TROP2是乳腺癌、肺癌等领域的研究热点,目前已有多项研究取得突破性成果。在生物标志物的探索中,不同靶点表达对ADC疗效的预测效果表现不同。以乳腺癌为例,第二代HER2 ADC T-DM1仅在HER2高表达患者中有效,而第三代ADC德曲妥珠单抗(DS-8201,T-DXd)在HER2低表达人群仍展现显著疗效。
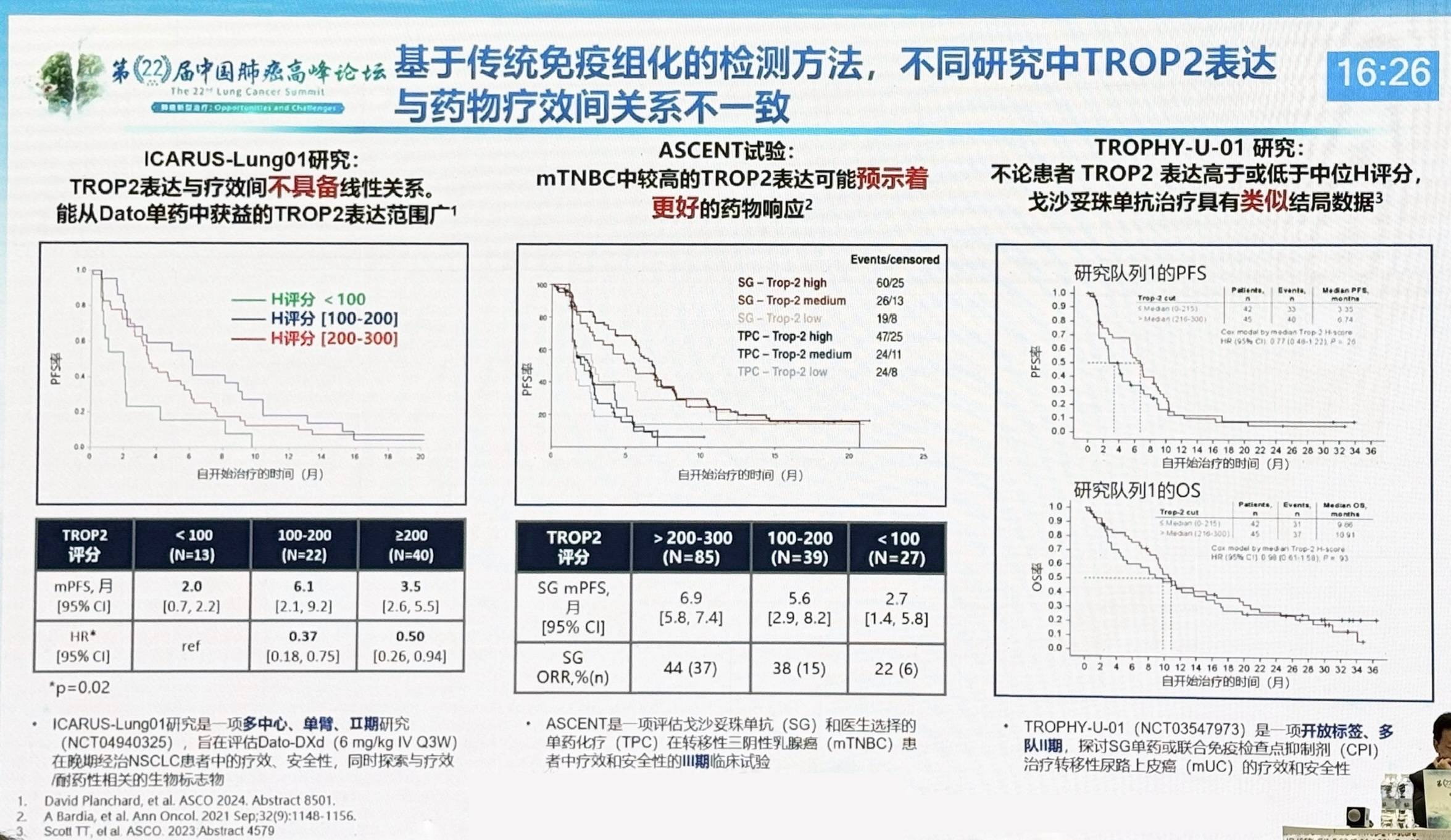
对于TROP2 ADC,TROPION-Lung01和EVOKE-01研究显示,TROP2 ADC Dato-Dxd在总人群中未显著优于化疗,而其中TROPION-Lung01研究数据表明Dato-Dxd在非鳞癌亚组中仍有获益趋势1。这提示需通过生物标志物进一步筛选患者。基于传统免疫组化检测方法,不同研究结果显示的TROP2表达水平与ADC疗效关系不一致,需进一步探索定量靶点表达与临床结局的关系。
精准识别的未来方向
值得注意的是,研究发现TROP2 ADC后线治疗的优势人群为EGFR突变人群。TROPION-Lung05研究结果显示,Dato-Dxd在EGFR突变且奥希替尼耐药患者中ORR为43.6%,总人群ORR为35.8%,显示其对EGFR突变亚组的突出有效性2。针对这一现象的探索将为生物标志物研究和精准治疗提供新思路。ADC生物标志物研究或将不仅局限于膜蛋白表达或是基因突变类型,未来应进一步探索更广泛的精准识别。在技术和方法上,通过定量连续评分(QCR)计算TROP2等靶点的标准化膜比例(NMR)可精确预测ADC的临床疗效。TROPION-Lung01研究结果显示,总体人群中,与TROP2 QCS-NMR阴性人群相比,TROP2 QCS-NMR阳性人群ORR(32.7% vs. 16.9%)及中位PFS(6.9 vs. 2.9)均更优3。

目前,一项全球多中心随机对照III期试验(AVANZAR)正在进行中,计划纳入1000例患者,探索Dato-DXd联合免疫对比免疫联合化疗分别在TROP2阳性和TROP2阴性人群中的疗效和安全性,其结果将为精准治疗的人群筛选带来新依据4。
技术革命:连接子与载荷的平衡艺术
ADC由抗体、连接子及细胞毒性载荷三部分构成,其中连接子稳定性与载荷释放效率直接影响疗效与安全性。在科学上已探明ADC靶点机制的当下,需要改进的主要为技术上的不足。陆舜教授指出,连接子和载荷相关进步是技术胜利而非科学突破,中国在ADC研发中由于技术上的优势,与美国差距已只有约1年。未来技术上的优化将持续引领ADC研发领域的进步。
目前,ADC连接子分为可裂解与不可裂解两类。前者依赖肿瘤微环境特性(如酸性pH或高蛋白酶活性)释放载荷,但可能因血浆中过早分解导致脱靶毒性;后者虽更稳定,却需依赖抗体内吞效率。此外,药物抗体比(DAR)需精准控制,DAR过高可能加剧血液系统毒性,过低则降低疗效。不同的ADC适配的DAR也不尽相同,需根据连接子特性而定。
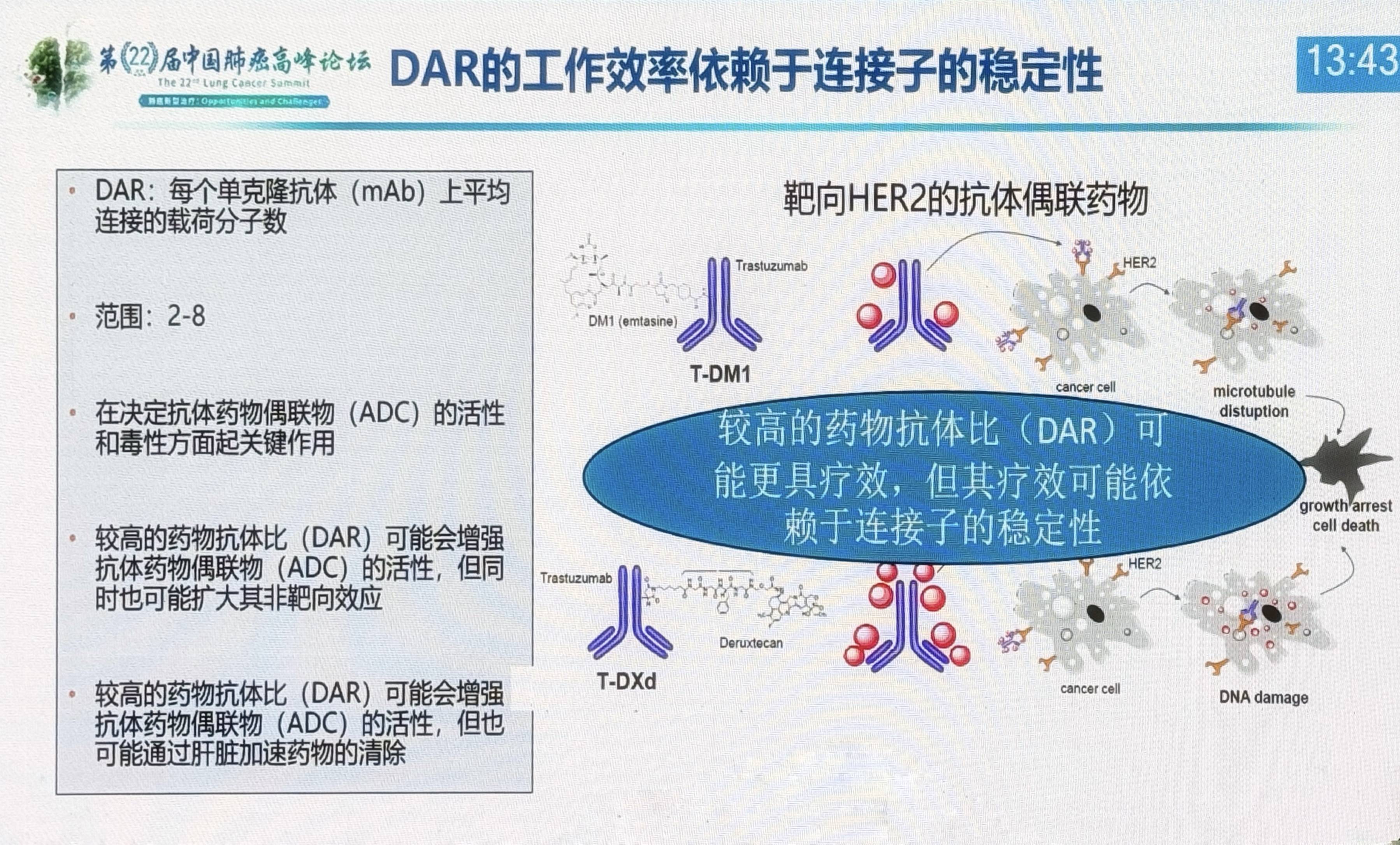
载荷方面,早期ADC多采用微管抑制剂MMAE,但在肺癌中疗效有限;新一代药物更多地采用拓扑异构酶I抑制剂(如喜树碱类),凭借强效细胞杀伤和旁观者效应,显著提升了疗效。
在探索HER2 ADC对NSCLC疗效的临床研究中,第二代ADC药物T-DM1的缓解率未达预期,而第三代药物德曲妥珠单抗在乳腺癌和NSCLC治疗中均显示出优势。HORIZON-Lung研究数据显示,SHR-A1811治疗HER2阳性NSCLC的客观缓解率(ORR)达73.4%,各亚组分析均呈现一致性获益,且对多种突变类型均有疗效提升;在安全性方面也具有优势,间质性肺炎发生率仅7%5。由此可见,虽然HER2在正常组织中低表达的特性赋予HER2 ADC良好的特异性,但不同HER2 ADC药物的疗效和毒性差异提示,除靶点表达水平外,药物载荷特性、连接子稳定性等药代动力学参数均是影响临床效果的关键因素。
治疗窗困境:疗效与毒性的博弈
理论上,由于其针对靶点的特异性,ADC应比传统化疗具有更宽的治疗窗,但临床实践显示其最大耐受剂量(MTD)并未显著提高。例如,DESTINY-Lung02研究结果显示,德曲妥珠单抗5.4 mg/kg组和6.4 mg/kg组在NSCLC中疗效差异不大,而5.4 mg/kg组的安全性更好6。另一种HER2 ADC SHR-A1811在NSCLC中体现了同样的趋势,大于4.8 mg/kg的剂量并未显示出疗效上的优势,且耐受性更差7。此外,尽管德曲妥珠单抗在乳腺癌中剂量最高可爬坡至8 mg/kg,但由于高剂量时更严重的毒性,常规依然推荐5.4 mg/kg作为平衡疗效与安全性的选择。
未来方向:技术与策略的优化
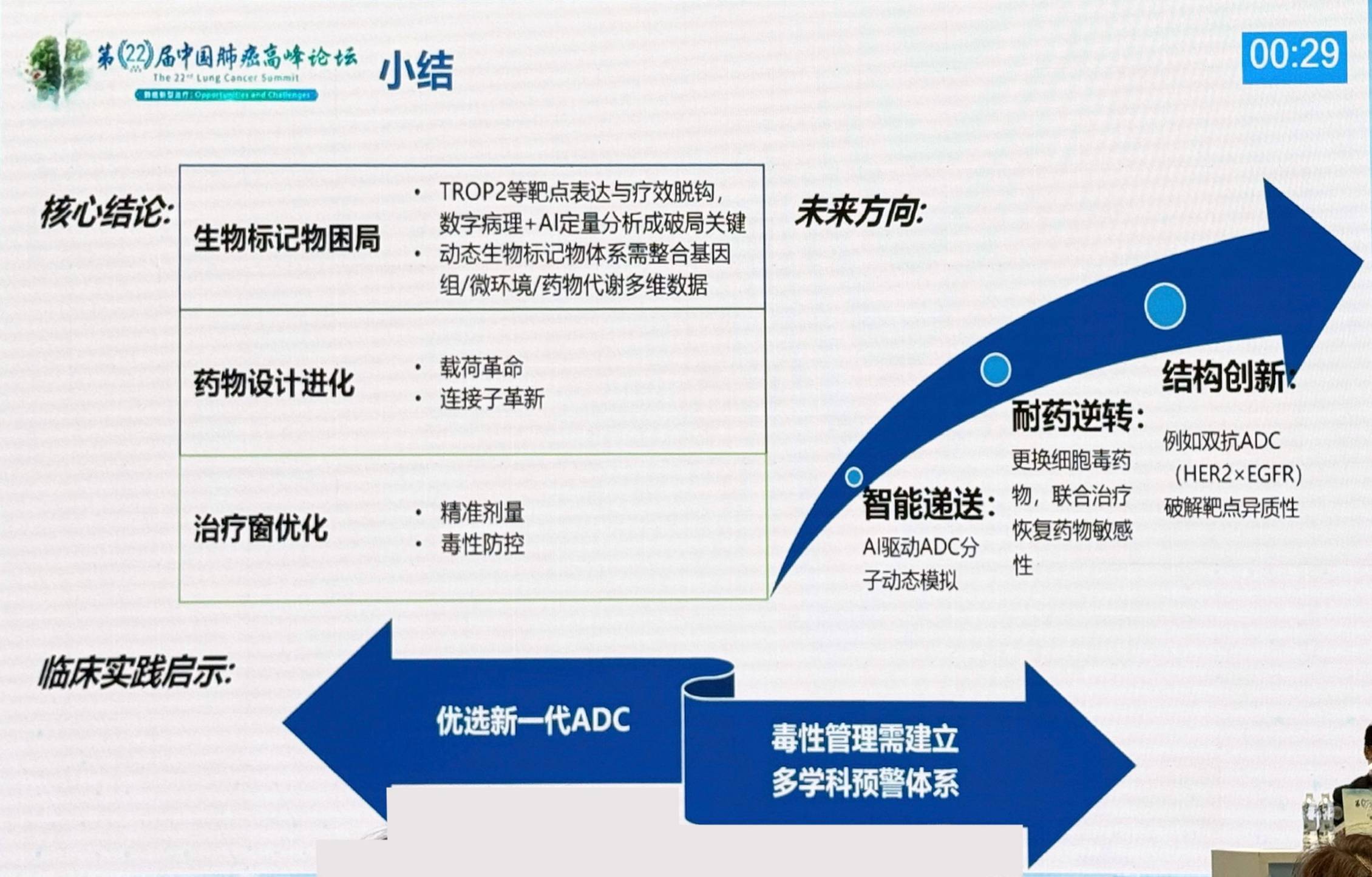
面对当前ADC研究面临的挑战,包括生物标志物困局、药物毒性和耐药问题等,陆舜教授提出未来发展方向:
生物标志物探索
数字病理和AI技术的发展将助力生物标志物研究,未来或可通过体外无创的方式进行整个肿瘤组织的靶点定量。
药物设计进化
需改善连接子技术,寻找更好的有效载荷,并优化抗体设计。新型药物方面,正在开发中的双特异性抗体ADC和具有更高pH选择性的前抗体偶联药物(PDC)将带来特异性更高的药物选择。免疫刺激抗体偶联药物(ISAC)可以结合细胞毒作用和免疫调配作用。蛋白降解剂-抗体偶联药物(DAC)与传统ADC具有相近结构与作用机制,但将细胞毒药物替换为了降解剂(PROTAC或分子胶),可起到靶向降解致病分子的作用。此外,双载荷ADC同样是一种有前景的设计方向。
序贯策略优化
ADC耐药机制主要包括抗原表达下调或丢失、胞内转运和溶酶体药物分解的改变、有效载荷容限或流出等。对于ADC耐药问题,需遵循个体化原则排兵布阵,根据耐药机制和药物特性确定序贯策略。
联合治疗布局
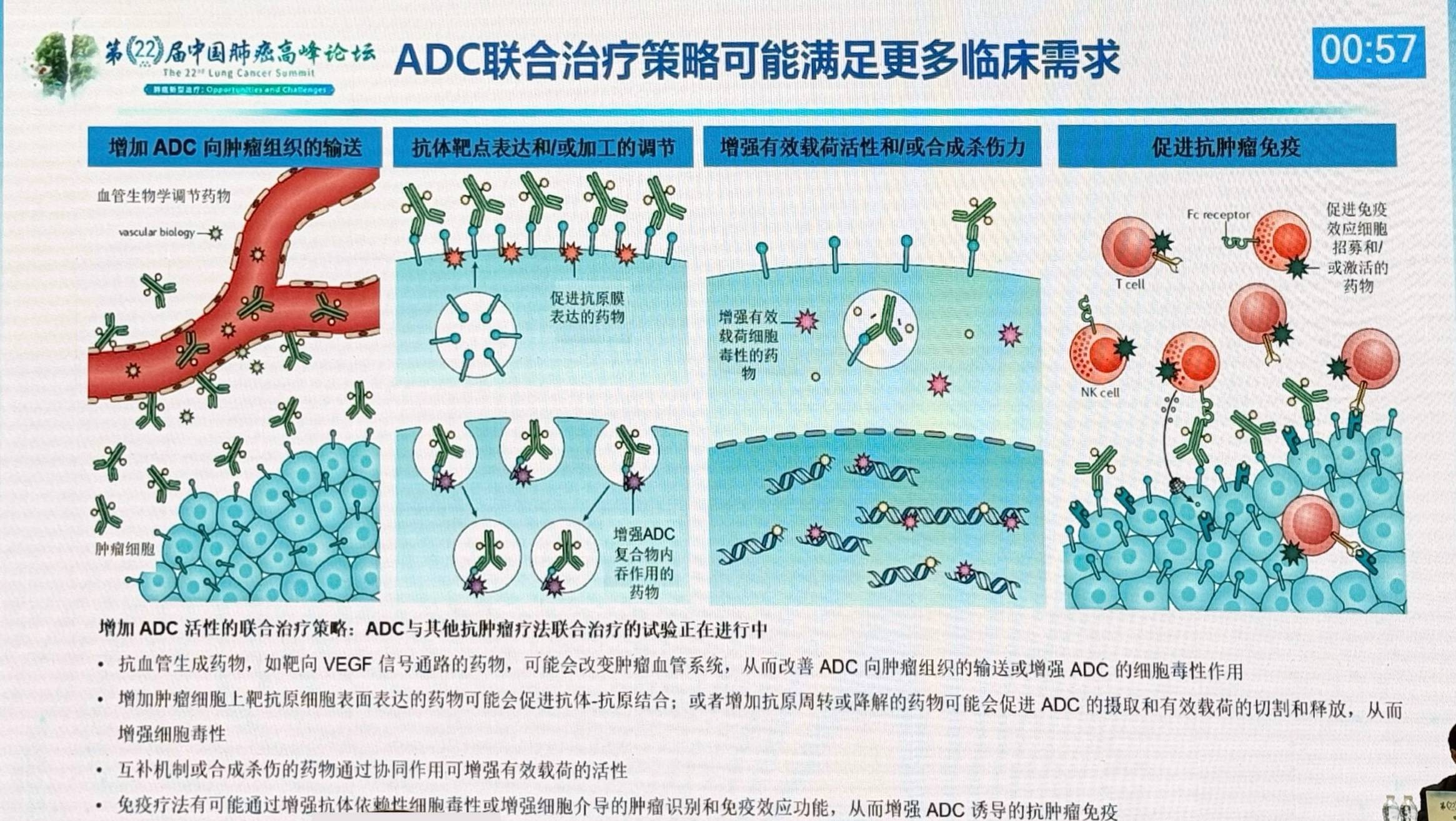
ADC可与免疫治疗、靶向治疗和抗血管治疗等联合,但需警惕叠加毒性。联合抗血管生成药物或可改变肿瘤血管系统,从而改善ADC向肿瘤组织的输送;免疫疗法或可增强ADC诱导的抗肿瘤免疫;此外,促进抗原膜表达的药物和增加有效载荷活性的药物也可通过协同作用增强ADC的疗效。
结语
ADC复杂性超越传统药物——每个ADC均由抗体、连接子及载荷三重变量定义,需通过独立临床数据验证其特性。未来,随着药物设计技术、生物标志物检测及AI辅助设计的突破,ADC有望真正实现“魔法子弹”的百年愿景,为广大肿瘤患者带来获益。
(除特殊标注外,文中图片均来源于现场照片)
1. Cipriano J, Sands JM. TROPION-Lung01 Update: Dato-DXd Shows Activity in Previously Treated Advanced Nonsquamous NSCLC.
2. Sands J, Ahn MJ, Lisberg A, et al. Datopotamab Deruxtecan in Advanced or Metastatic Non–Small Cell Lung Cancer With Actionable Genomic Alterations: Results From the Phase II TROPION-Lung05 Study. J Clin Oncol. 2025;0(0):JCO-24-01349. doi:10.1200/JCO-24-01349
3. Garassino M, Sands J, Paz-Ares L, et al. PL02. 11 Normalized Membrane Ratio of TROP2 by Quantitative Continuous Scoring is Predictive of Clinical Outcomes in TROPION-Lung 01. J Thorac Oncol. 2024;19(10):S2-S3.
4. Aggarwal C, Cheema P, Arrieta O, et al. P2. 04-02 AVANZAR: Phase III Study of Datopotamab Deruxtecan (Dato-DXd)+ Durvalumab+ Carboplatin as 1L Treatment of Advanced/mNSCLC. J Thorac Oncol. 2023;18(11):S305-S306.
5. Li Z, Wang Y, Sun Y, et al. Trastuzumab rezetecan, a HER2-directed antibody–drug conjugate, in patients with advanced HER2-mutant non-small-cell lung cancer (HORIZON-Lung): phase 2 results from a multicentre, single-arm study. Lancet Oncol. doi:10.1016/S1470-2045(25)00012-9
6. Goto K, Goto Y, Kubo T, et al. Trastuzumab deruxtecan in patients with HER2-mutant metastatic non–small-cell lung cancer: Primary results from the randomized, phase II DESTINY-Lung02 trial. J Clin Oncol. 2023;41(31):4852-4863.
7. Li Z, Song Z, Hong W, et al. SHR-A1811 (antibody-drug conjugate) in advanced HER2-mutant non-small cell lung cancer: a multicenter, open-label, phase 1/2 study. Signal Transduct Target Ther. 2024;9(1):182. doi:10.1038/s41392-024-01897-y
排版编辑:肿瘤资讯-丹忱











 苏公网安备32059002004080号
苏公网安备32059002004080号


