2025年1月5日,第五届中国血液学科发展大会揭晓了“2024年度中国血液学十大研究进展”。展示了在2023年12月5日至2024年12月5日期间公开发表且核心科学发现在中国完成的十大研究成果。从CAR-T细胞疗法、单克隆抗体治疗、保护造血干祖细胞基因组机制探究及巨核细胞/血小板机制解析等多个维度展现了中国血液学领域的发展,【肿瘤资讯】对以上内容进行整理,以饕读者。
1、CD7 CAR-T序贯异基因造血干细胞移植一体化体系
研究团队:黄河、胡永仙、王东睿:浙江大学医学院附属第一医院;张鸿声:复旦大学/上海雅科生物科技有限公司

研究解读:这项研究探索了一种创新的“一体化”治疗策略,将CD7 CAR-T细胞治疗与单倍型造血干细胞移植(haplo-HSCT)相结合,用于治疗复发或难治性CD7阳性血液系统恶性肿瘤。共纳入10例患者,包括7例急性髓系白血病、2例T细胞急性淋巴细胞白血病和1例T细胞淋巴母细胞淋巴瘤患者,中位年龄56.5岁。
治疗策略的独特之处在于,患者首先接受CD7 CAR-T细胞治疗,在获得完全缓解后直接进行haplo-HSCT,且不使用常规的预处理方案和GVHD预防药物,避免了传统移植可能带来的并发症,同时保持CAR-T细胞的持续存在和抗肿瘤作用。
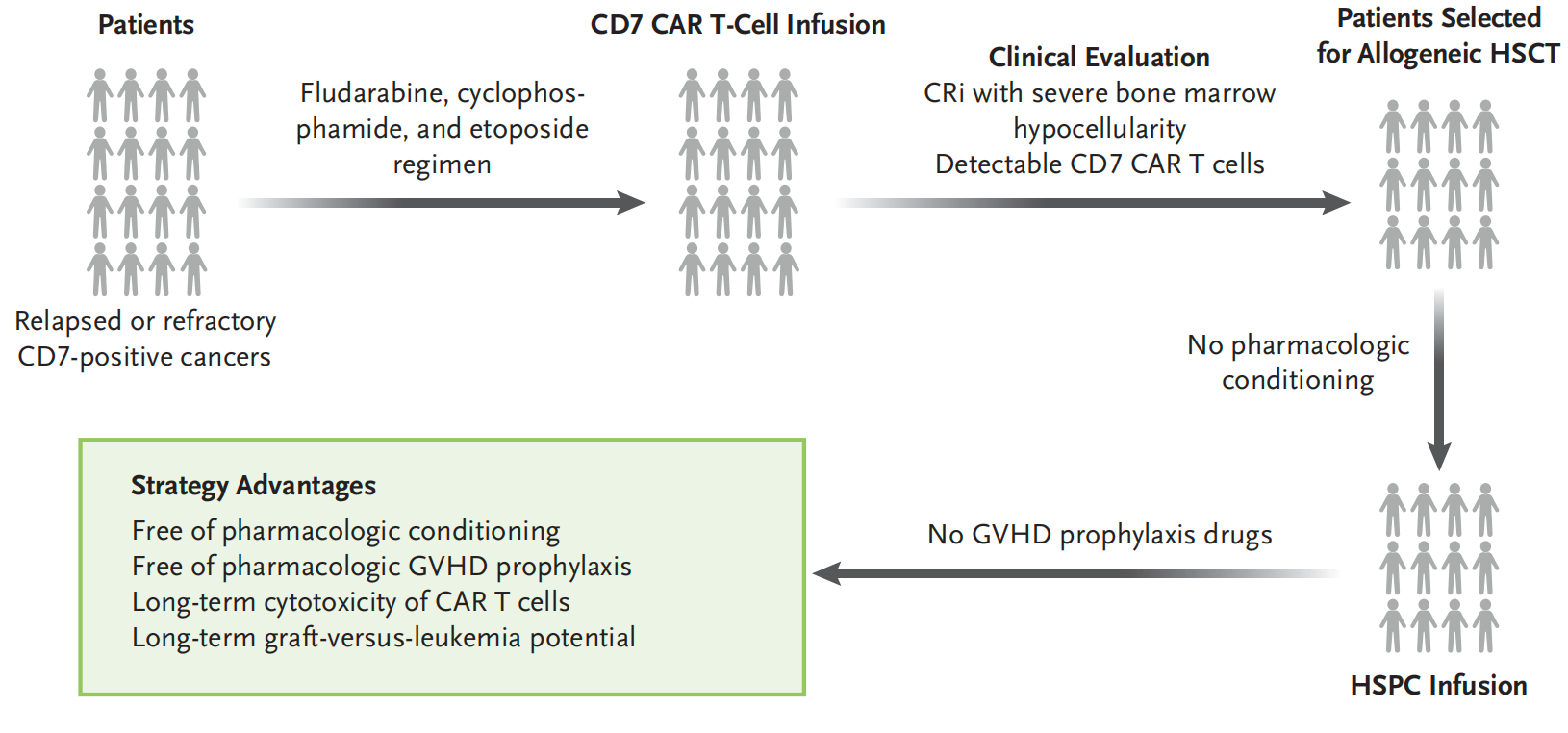
结果显示,所有患者在CAR-T治疗后都获得完全缓解(CR),其中8例患者在haplo-HSCT后获得完全供者嵌合。3例患者出现2级急性GVHD,但无慢性GVHD病例。经过中位15.1个月的随访,6例患者维持MRD阴性的CR状态,2例患者出现CD7阴性白血病复发,2例患者因感染死亡。患者的1年总生存(OS)率为68%,无病生存(DFS)率为54%。
这种创新的“一体化”治疗策略为不适合接受常规HSCT的患者提供了一种可行的治疗选择,实现CAR-T与HSCT全面整合。
2、CD38单抗治疗免疫性血小板减少症安全有效
研究团队:张磊:中国医学科学院血液病医院(中国医学科学院血液学研究所)

研究解读:研究探索了一种新型抗CD38单克隆抗体(CM313)治疗免疫性血小板减少(ITP)的安全性和有效性。纳入22例既往接受过多种治疗的ITP患者,中位年龄36岁。
CM313以16mg/kg剂量每周静脉注射给药8周,随后进行16周随访。研究的主要终点是评估不良反应和在治疗8周内实现两次或以上血小板计数≥50×109/L。
结果显示,95%的患者(21/22)在治疗期间达到了主要终点,中位累积响应持续时间为23周。大多数患者在首次给药后1周内即可观察到血小板计数升高。研究结束时,64%的患者维持部分缓解(PR)或CR状态。最常见的不良反应是输液相关反应(32%)和上呼吸道感染(32%),大多数不良反应为1~2级。
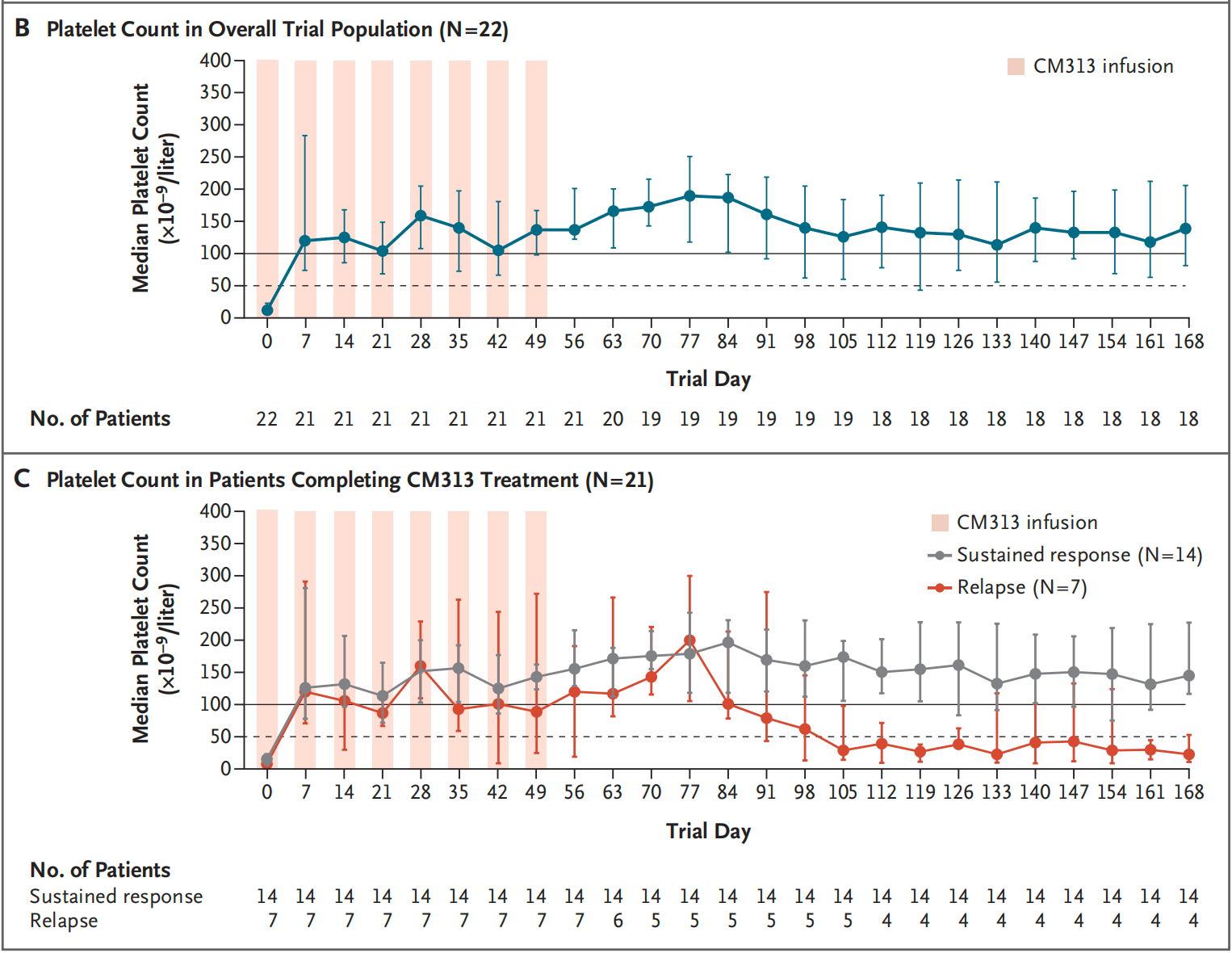
研究表明,CM313可能通过抑制NK细胞和单核-巨噬细胞系统介导的抗体依赖性细胞毒性作用,快速提高血小板计数;同时通过清除浆细胞维持长期疗效。这种治疗策略为那些对传统治疗反应不佳的ITP患者提供了新的选择。
3、胚胎肝脏保护造血干祖细胞基因组的机制
研究团队:洪登礼:上海交通大学医学院

研究解读:这项研究探讨了胎肝细胞如何通过分泌胎球蛋白A(fetuin-A)来保护造血干/祖细胞(HSPCs)的基因组完整性。研究发现,在胎肝发育早期阶段,由于肝细胞发育滞后,新迁入的HSPCs缺乏足够的基因组保护,容易受到基因毒性物质的损伤。
研究人员通过系列实验证实,胎肝细胞分泌的fetuin-A可以通过激活Toll样受体4(TLR4)通路来防止HSPCs中R-loop(一种三链核酸结构)的病理性积累。这种保护机制在胎肝发育早期由于肝细胞数量不足而缺乏,导致HSPCs对基因毒性损伤更为敏感。
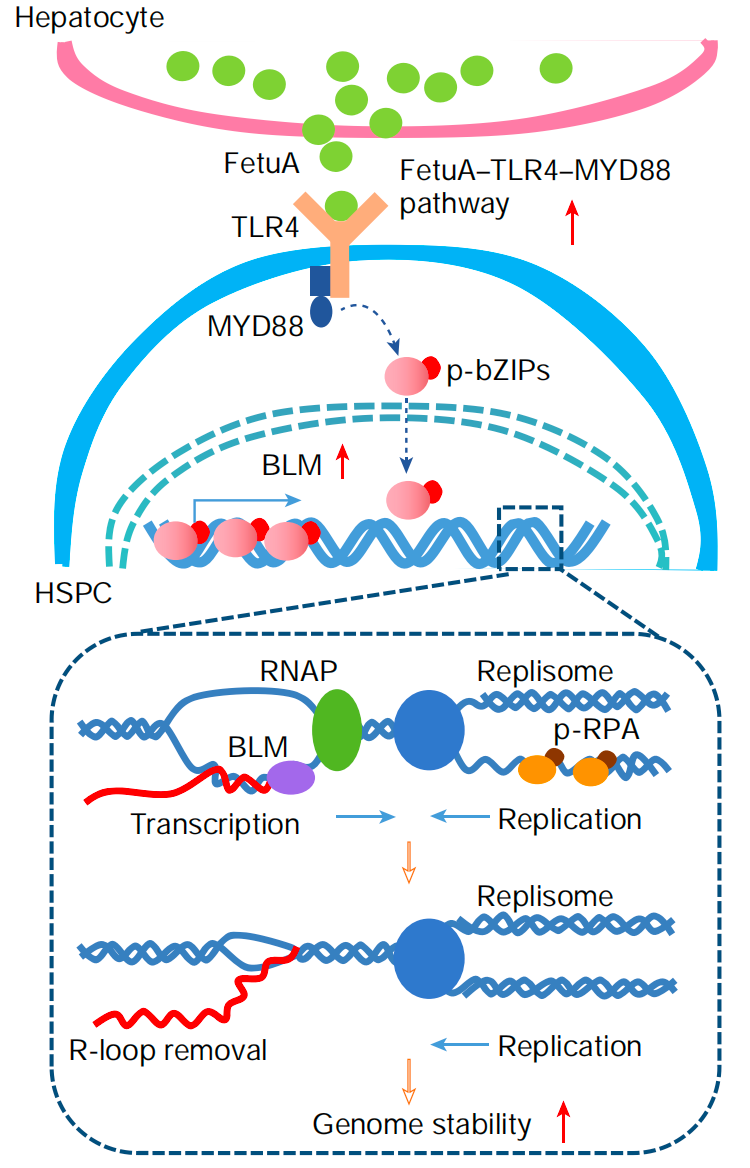
在Fetua基因敲除小鼠中,HSPCs表现出更高的基因组不稳定性和恶性转化倾向。研究还发现,多个经常发生白血病突变的造血调控基因位于R-loop富集区域,且白血病患儿骨髓血清中fetuin-A浓度显著低于非白血病患儿。
这项研究揭示了发育组织如何通过旁分泌因子来保护其干细胞基因组,对理解发育相关疾病的发生机制具有重要意义,同时也为预防和治疗发育相关疾病提供了新的思路和潜在靶点。
4、解析巨核细胞/血小板的功能多样性
研究团队:周波:中国科学院分子细胞科学卓越创新中心;王前飞、李明莹:中国科学院北京基因组研究所;程涛、程辉:中国医学科学院血液病医院(中国医学科学院血液学研究所)

研究解读:这项研究探讨了成年巨核细胞生成过程中两条不同分化途径的功能输出。研究人员开发了遗传标记系统,用以区分直接分化途径(从造血干细胞直接分化)和逐步分化途径(通过限制性祖细胞分化)。他们发现,在稳态条件下,这两条途径以相似的动力学和数量产生巨核细胞。
通过单细胞RNA测序分析发现,直接分化途径主要产生支持造血微环境的巨核细胞,而逐步分化途径则主要产生具有免疫功能的巨核细胞。两种途径都能生成产板细胞的巨核细胞。研究还表明,在化疗后,直接分化途径被优先激活,产生更多支持造血微环境的巨核细胞以促进造血干细胞再生;而在炎症条件下,逐步分化途径被优先激活,产生更多免疫巨核细胞以参与免疫应答。
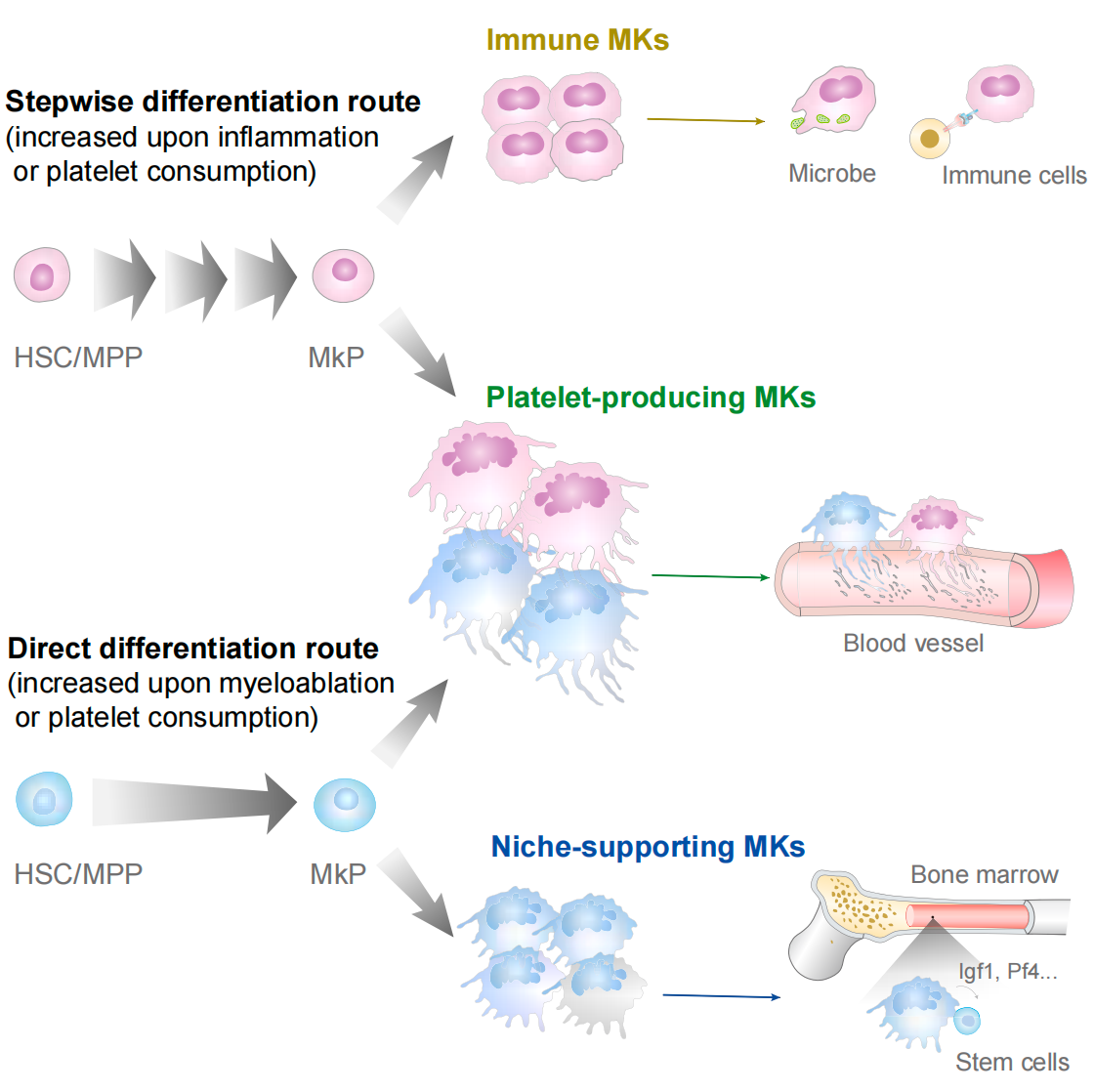
这项研究首次将分化途径与巨核细胞功能异质性联系起来,揭示了不同分化途径如何产生功能不同的巨核细胞亚群,以应对不同生理需求。这一发现为理解巨核细胞发育和功能调控提供了新的视角,也为临床上改善血小板生成和免疫功能提供了潜在的治疗靶点。
5、MSC在单倍体造血干细胞移植后早期续贯输注是预防GVHD的最优方案
研究团队:张曦、高力:陆军军医大学第二附属医院血液病医学中心

研究解读:这项研究是一个开放标签、多中心、平行随机临床试验,旨在评估在haplo-HSCT早期阶段(移植后45天和100天)重复输注脐带间充质干细胞(MSCs)以预防慢性移植物抗宿主病(cGVHD)的效果。
研究从2016年4月至2022年1月进行,共纳入158例急性白血病患者,其中148例被随机分配到MSC组(74例)或对照组(74例)。MSC组患者在移植后45天开始每2周接受一次MSCs输注(1×106个细胞/kg),共4次,而对照组接受常规预防方案。
结果显示,MSC组2年严重cGVHD的累积发生率显著低于对照组(5.4% vs.17.4%,P=0.03)。MSC组II-IV期急性GVHD的发生率也明显降低(HR 0.25,P=0.01)。此外,MSC输注并未增加白血病复发风险(HR 1.17,P=0.68)。MSC组的无GVHD和无复发生存率优于对照组(HR 0.62,P=0.04)。在安全性方面,MSC输注未增加不良事件发生率,且在出血性膀胱炎等并发症的管理上显示出积极作用。
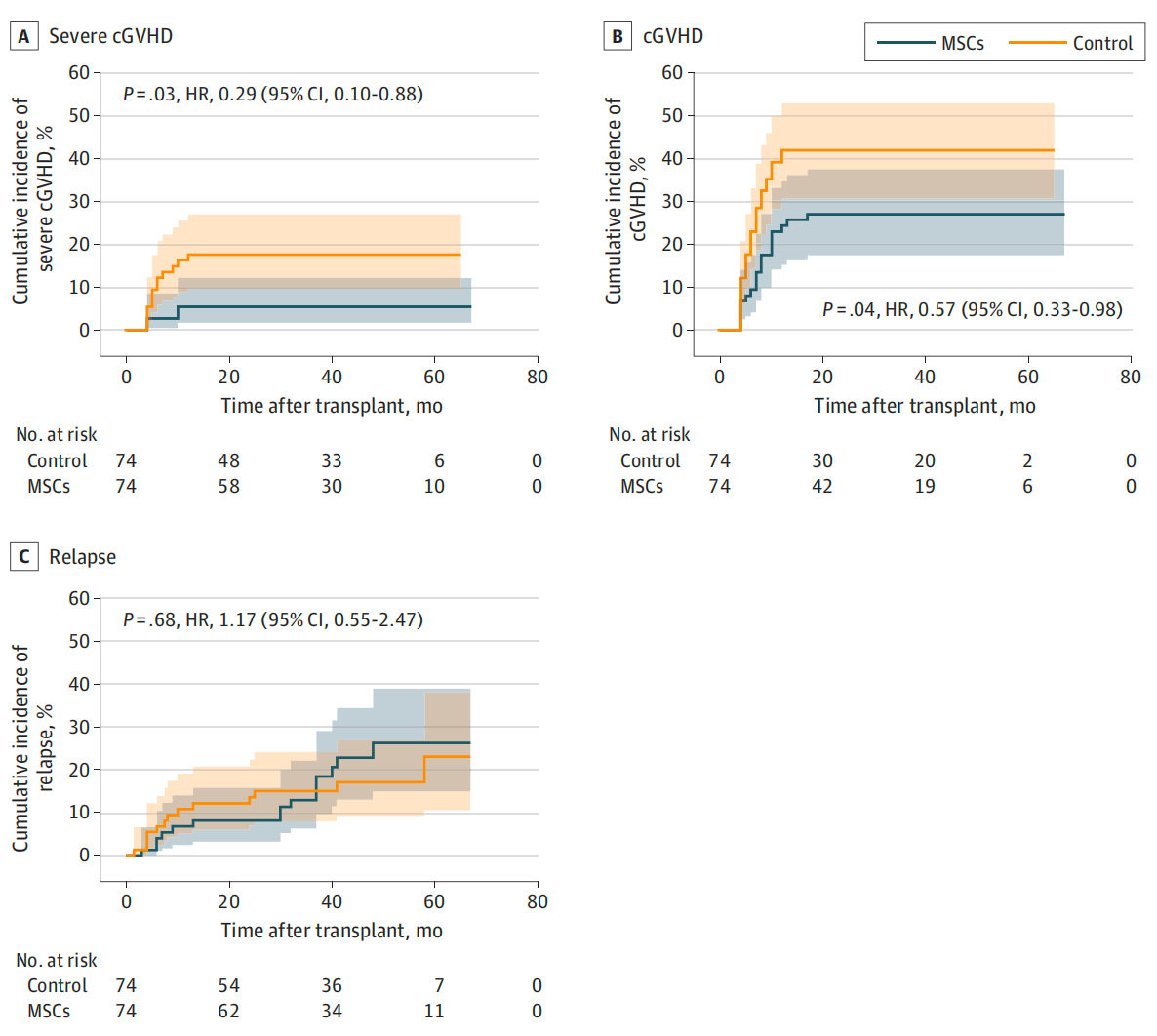
研究表明,haplo-HSCT后早期重复输注MSCs能有效降低慢性和急性GVHD的发生率和严重程度,同时改善患者的无GVHD和无复发生存率,这为haplo-HSCT后GVHD的预防提供了一种新的治疗策略。
6、首个异体CD5 CAR-T治疗T系白血病的临床研究成果
研究团队:潘静:北京高博医院;冯晓明:中国医学科学院血液病医院(中国医学科学院血液学研究所)

研究解读:这是一项评估CD5 CAR-T细胞疗法治疗复发/难治性T细胞急性淋巴细胞白血病(r/r T-ALL)的一期临床试验。共纳入19例患者,其中多数患者此前接受过CD7 CAR-T治疗但失败。患者被分为两组:A组(11例)使用既往移植供者来源的CAR-T细胞,B组(5例)使用新配型供者来源的CAR-T细胞。
主要终点是评估21天内剂量限制性毒性和30天内不良事件。次要终点包括治疗反应、药代动力学和30天后的严重不良事件。16例患者接受了输注,其中10例患者接受目标剂量1×106/kg。所有患者在30天内都出现了3~4级血细胞减少,1例3级感染。到30天时,所有患者(100%)都达到CR或血细胞计数不完全恢复的完全缓解。
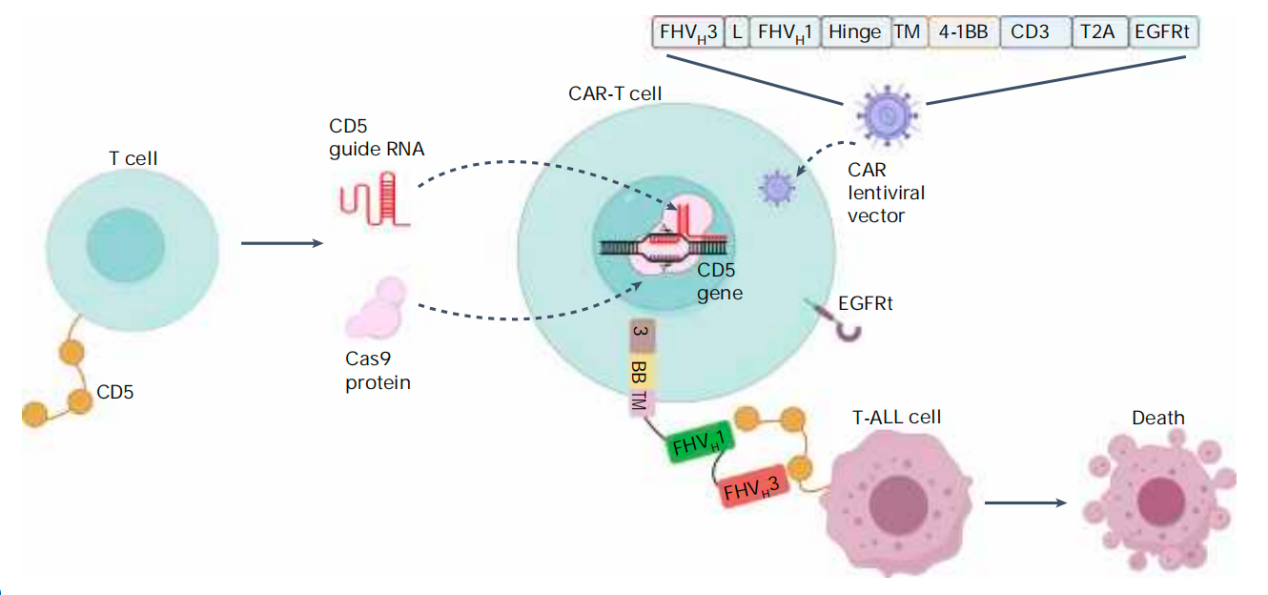
在中位随访14.3个月时,4例患者接受了移植,3例处于缓解状态,1例死于感染。12例未移植患者中,2例维持缓解,3例复发,5例死于感染,2例死于血栓性微血管病。CAR-T细胞持续存在并清除了CD5+T细胞。CD5-T细胞(主要是经过CD5基因编辑的)增加但仍低于正常水平。
该研究首次报道了供者来源的敲除CD5基因的CD5 CAR-T治疗r/r T-ALL的安全性及有效性;揭示了CD5 CAR-T治疗后复发的潜在机制;为r/r T-ALL患者提供了治疗的新希望。
7、人类固有淋巴细胞初始起源的系统性解析
研究团队:刘兵:解放军总医院第五医学中心;兰雨:暨南大学;程涛、刘晨:中国医学科学院血液病医院(中国医学科学院血液学研究所)

研究解读:这项研究探索了人类胚胎造血干细胞(HSC)形成之前卵黄囊来源的天然淋巴样细胞发育。研究人员通过单细胞RNA测序和细胞分选等方法,发现在Carnegie stage 10阶段的人类卵黄囊中存在表达CD34、IL7R、LTB和IRF8的淋巴样祖细胞(YSLPs)。这些细胞在数量和淋巴发生潜能方面都显著高于胚胎本体。
通过体外培养和CITE-seq分析表明,YSLPs倾向于分化为天然淋巴样细胞和树突状细胞。在HSC定植胎肝之前和之后,胎肝中的淋巴样祖细胞表现出不同的转录特征,其中早期的祖细胞与YSLPs更为相似。细胞通讯分析显示,胎肝基质细胞通过产生趋化因子和生长因子来招募和支持这些淋巴样祖细胞的增殖。
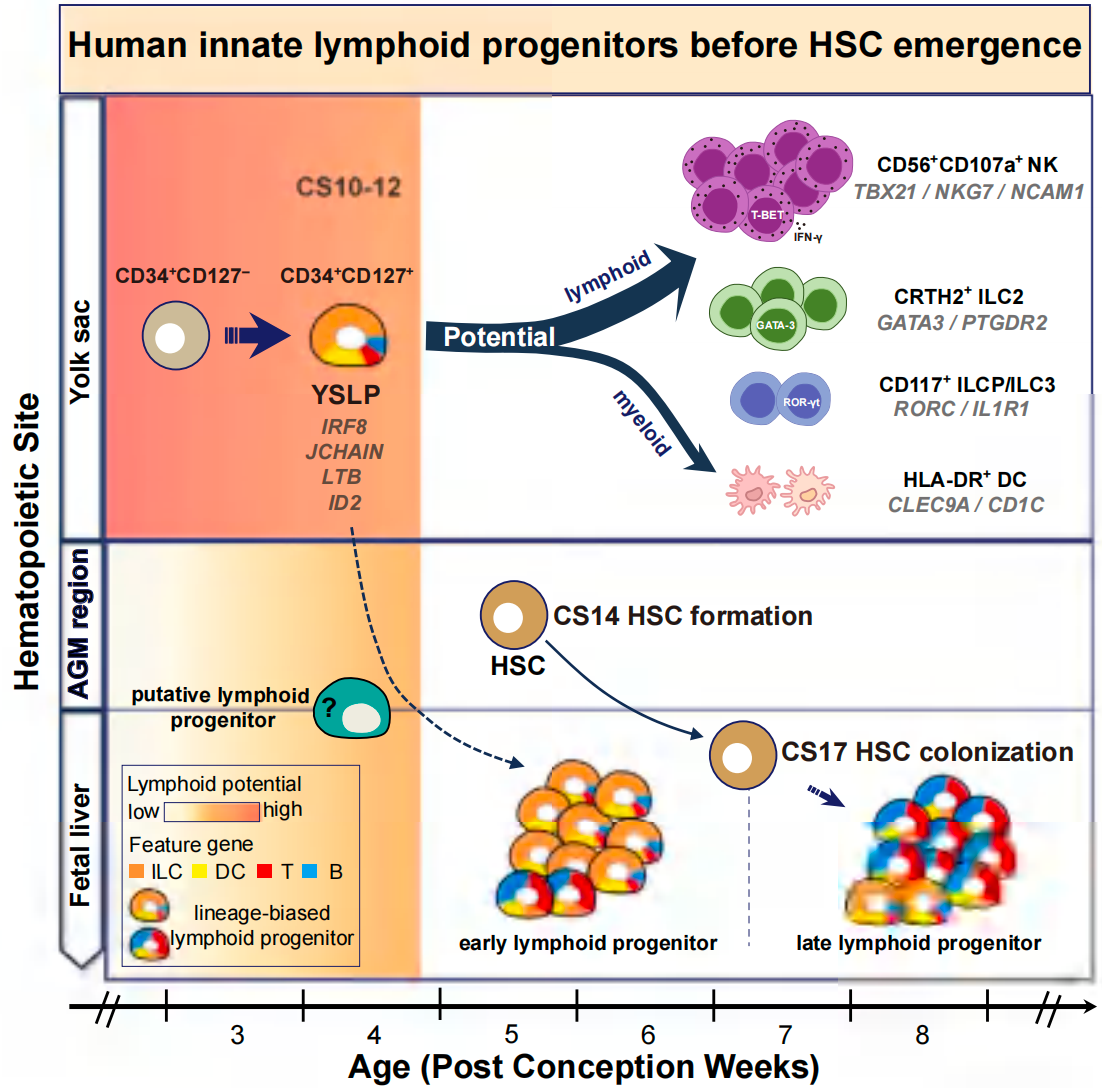
这项研究首次揭示了人类HSC形成前卵黄囊中天然淋巴样多能祖细胞的起源、发育潜能和迁移动态,为理解人类天然免疫系统的逐步建立提供了新见解。这些发现对于理解儿童血液系统疾病的发病机制以及利用多能干细胞重现早期人类造血发育具有重要意义。
8、慢性髓性白血病患者酪氨酸激酶抑制剂治疗失败的临床预测模型
研究团队:江倩、黄晓军:北京大学人民医院

研究解读:研究团队分析了1955名接受伊马替尼或第二代TKI治疗的慢性期髓性白血病(CML)患者数据来建立预测模型,用于评估CML患者接受TKI治疗的失败风险,模型在另外76家医疗中心的3454例患者中进行了外部验证。
该模型基于6个临床指标:性别、年龄、血红蛋白浓度、血液中原始细胞比例、脾脏大小和费城染色体阳性细胞中的高危染色体异常,可将患者分为低风险、中等风险和高风险三组,这些组别在治疗失败的累积发生率上存在显著差异。
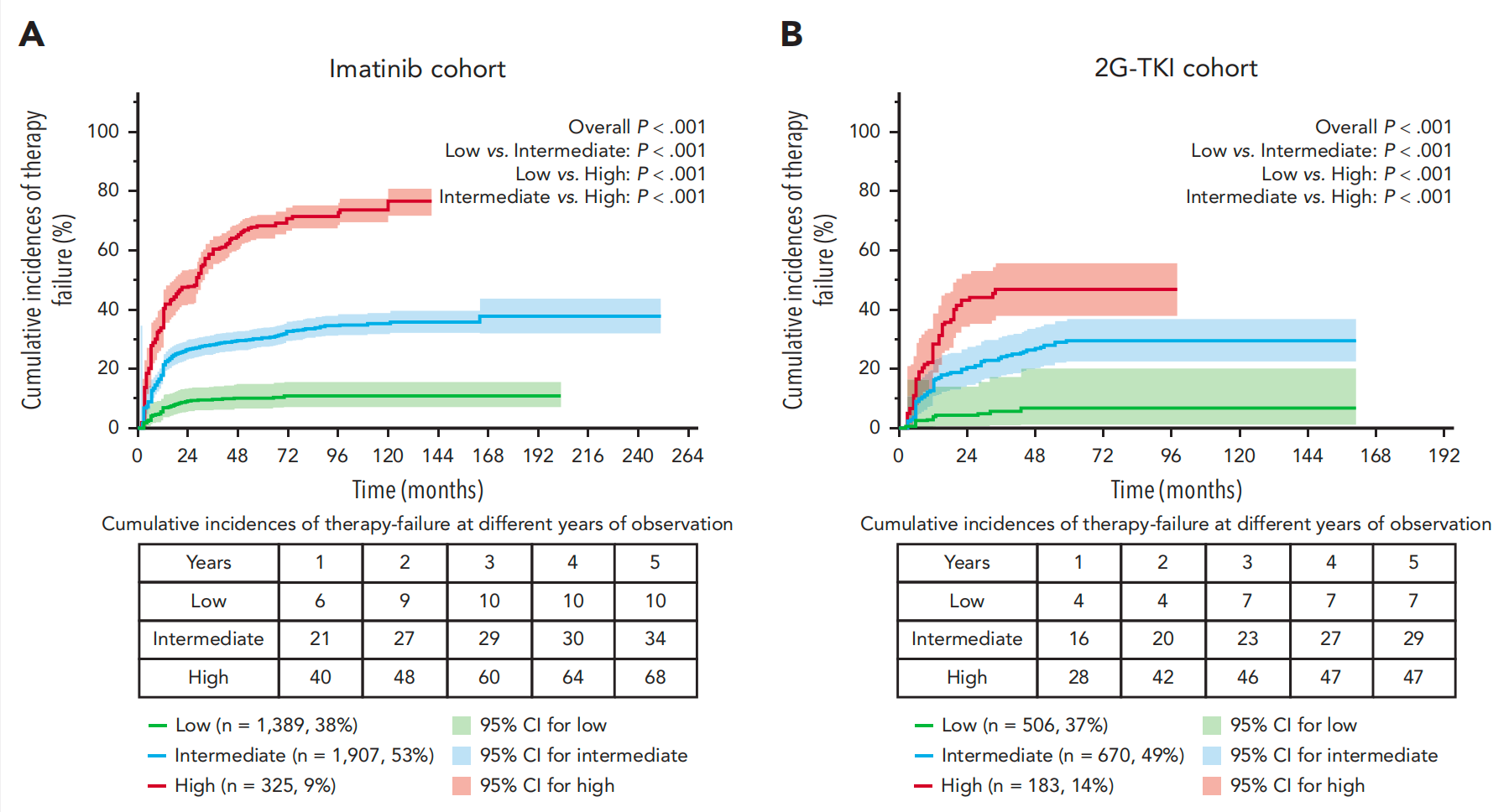
与现有的Sokal评分和ELTS(欧洲治疗与结局研究长期生存)评分相比,新模型在预测TKI治疗失败方面表现更好。特别是,被Sokal或ELTS评分认定为低风险的患者可以通过新模型进一步分层,从而获得更准确的风险评估。模型可以更好地为CML患者个体化选择一线TKI治疗提供依据。
9、急性髓系白血病发生发展与耐药的新型蛋白翻译控制系统
研究团队:张好建、周芙玲、韩国强:武汉大学;孙妍:广东省人民医院/医学科学院

研究解读:这项研究揭示了RREB1在急性髓系白血病(AML)发展中的关键作用。研究人员发现RREB1通过调控线粒体功能和琥珀酸代谢来维持白血病干细胞的功能。他们鉴定出一种新的RREB1短异构体(RREB1S),它可以与eEF1A1协同作用,促进核编码线粒体蛋白的翻译。
研究发现RREB1的缺失会降低线粒体活性和琥珀酸代谢,从而损害白血病干细胞功能和AML的发展。补充线粒体复合物II亚基SDHD可以纠正这些缺陷。值得注意的是,抑制复合物II可以使AML细胞重新对维奈托克治疗产生敏感性。
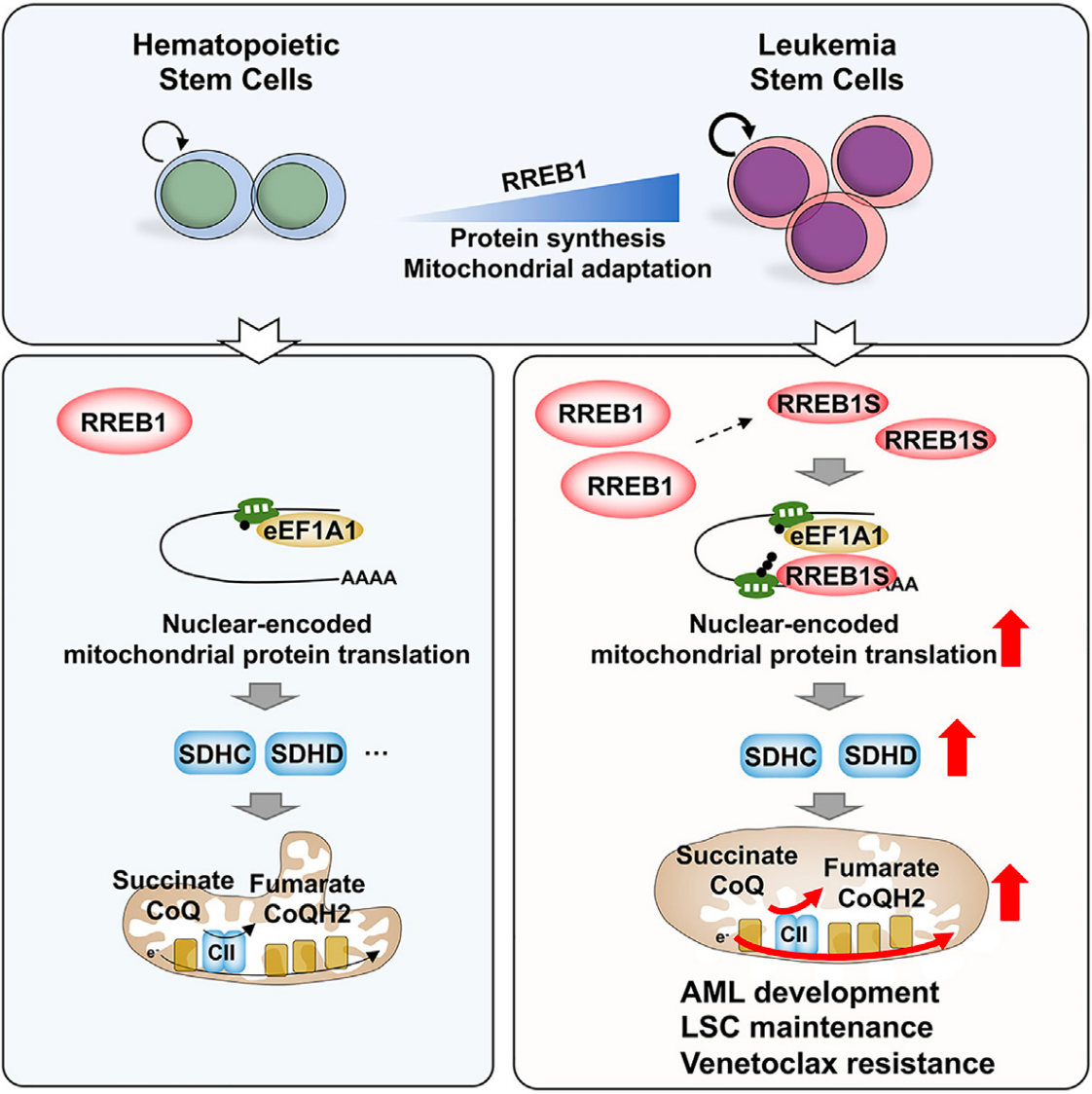
机制研究表明,RREB1S可以结合到3'UTR上的保守基序,并与eEF1A1协同作用来增强核编码线粒体mRNA的蛋白质翻译。总的来说,这项研究揭示了白血病干细胞获得线粒体适应性的新路径及其在AML发生发展与耐药中的作用与机制,为AML临床治疗提供重要理论依据和干预新策略。
10、造血应激损伤后干细胞池的维持机制新解
研究团队:王军平、杜长虹、胡梦佳、王愁:陆军军医大学
研究一:

研究解读:第一篇研究主要探讨线粒体中丝氨酸分解代谢对造血干细胞(HSC)池维持的作用。研究发现HSCs是丝氨酸营养缺陷型细胞,高度依赖外源性丝氨酸。通过SHMT2-MTHFD2轴驱动的线粒体丝氨酸分解代谢,产生NAD(P)H来维持氧化还原平衡,从而降低HSCs的铁死亡敏感性。
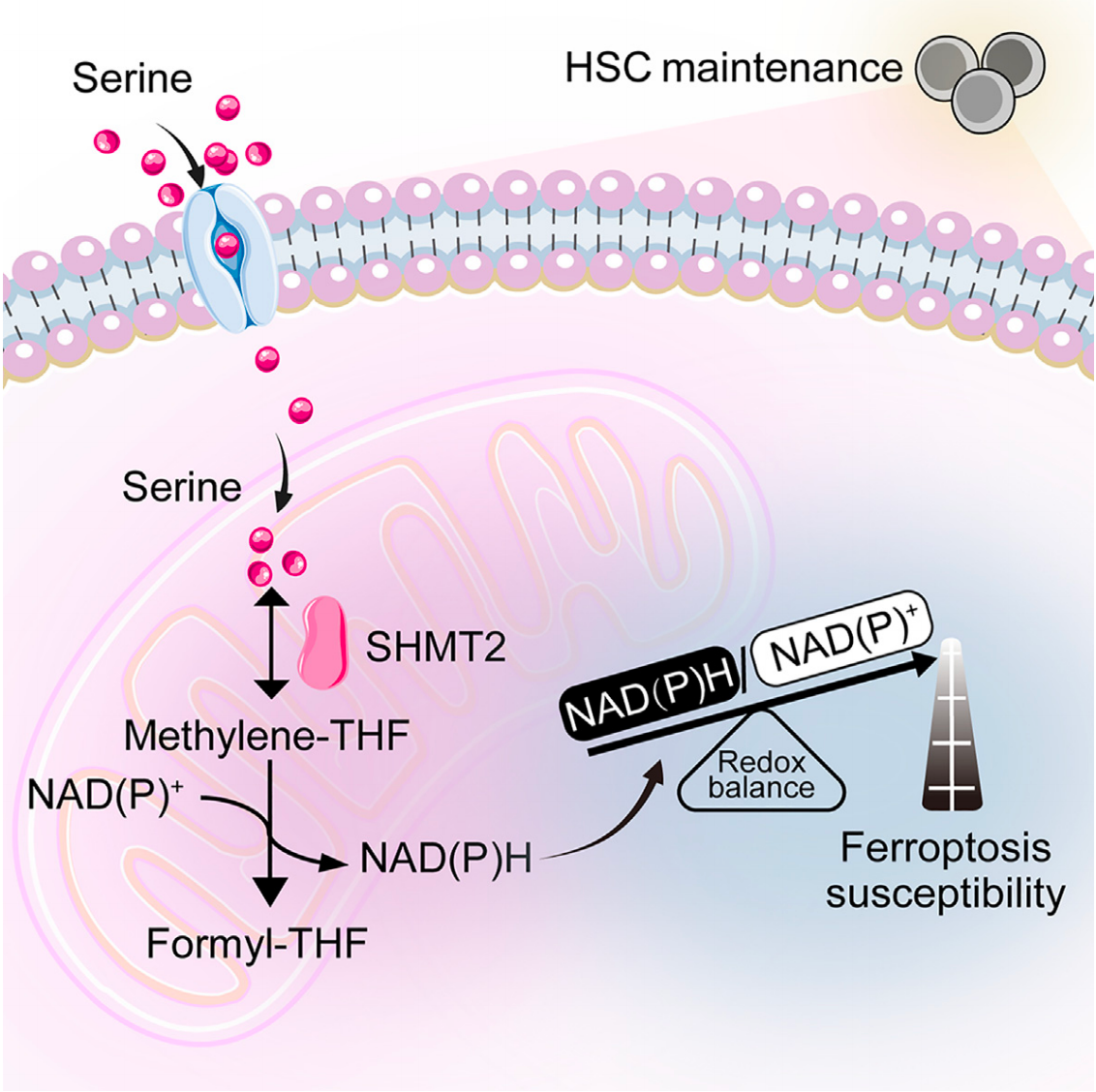
当饮食缺乏丝氨酸,或者基因/药理抑制SHMT2-MTHFD2轴时,会增加HSCs的铁死亡敏感性,导致HSC池维持受损。此外,外源性丝氨酸通过促进线粒体丝氨酸分解代谢来减轻铁死亡,可以保护HSCs免受辐射诱导的骨髓抑制损伤。这些发现首次揭示了丝氨酸代谢在调节HSC内部氧化还原平衡、抑制铁死亡中的重要作用及机制,
研究二:

研究解读:第二篇研究揭示了三分体基序蛋白47(Trim47)通过调节MAVS介导的先天免疫信号通路来保护造血干细胞。研究发现Trim47在原始HSCs中富集表达,其缺失会损害HSC在化疗药物5-FU和辐射等压力条件下的功能和存活。
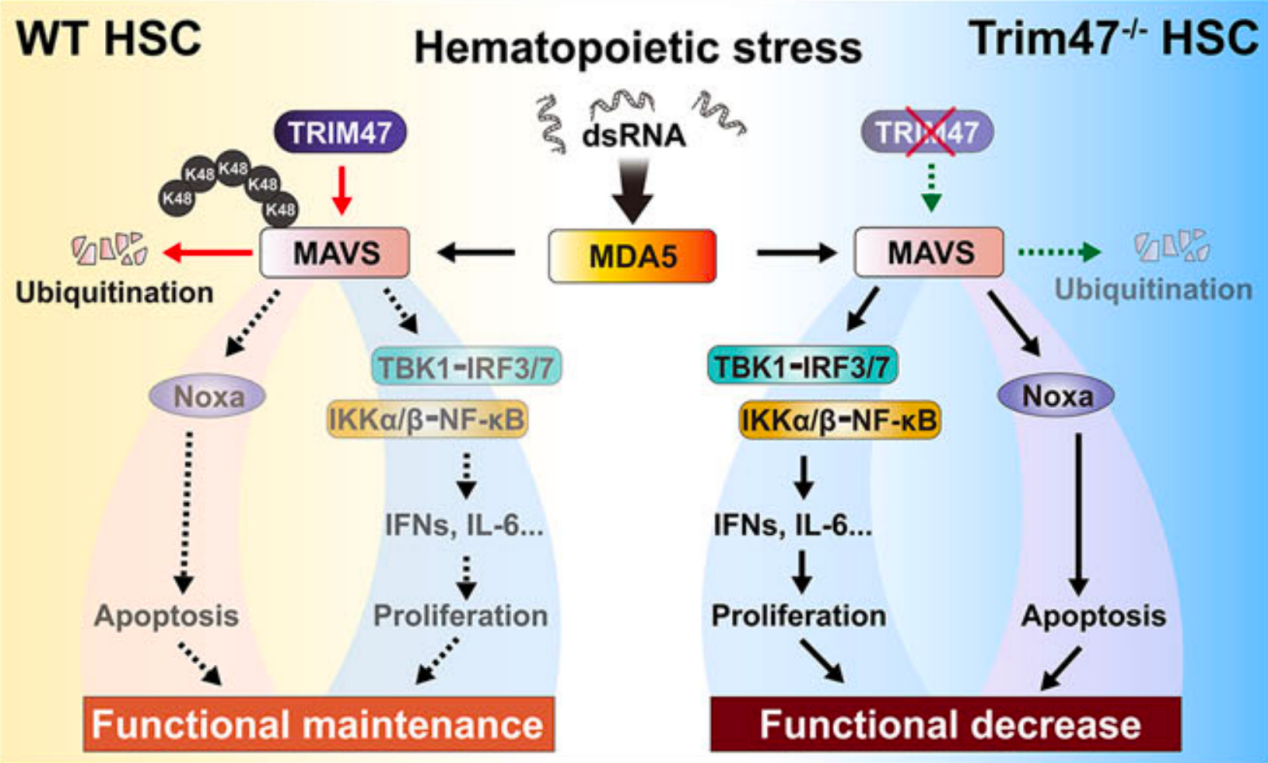
机制研究表明,Trim47通过K48泛素化修饰促进MAVS蛋白降解,从而抑制过度的先天免疫反应。此外,敲低MAVS显著恢复了Trim47缺失HSCs在压力条件下的表型和功能。该研究首次阐明了Trim47在调控HSC维持中的重要作用,并提供了一个潜在的治疗靶点。
小结
2024年度中国血液学十大研究进展兼顾临床与基础研究,涵盖了多个关键领域。这些研究展示了中国血液学领域的重要突破,为血液系统疾病的诊断和治疗提供了新的思路和方法,也为全球血液学的进步贡献了中国智慧与力量。
[1] Hu Y,Zhang M,Yang T,et al.Sequential CD7 CAR T-Cell Therapy and Allogeneic HSCT without GVHD Prophylaxis.N Engl J Med.2024;390(16):1467-1480.doi:10.1056/NEJMoa2313812
[2] Chen Y,Xu Y,Li H,et al.A Novel Anti-CD38 Monoclonal Antibody for Treating Immune Thrombocytopenia.N Engl J Med.2024;390(23):2178-2190.doi:10.1056/NEJMoa2400409
[3] Guo XL,Wang YD,Liu YJ,et al.Fetal hepatocytes protect the HSPC genome via fetuin-A.Nature.Published online December 4,2024.doi:10.1038/s41586-024-08307-x
[4] Li JJ,Liu J,Li YE,et al.Differentiation route determines the functional outputs of adult megakaryopoiesis.Immunity.2024;57(3):478-494.e6.doi:10.1016/j.immuni.2024.02.006
[5] Huang R,Chen T,Wang S,et al.Mesenchymal Stem Cells for Prophylaxis of Chronic Graft-vs-Host Disease After Haploidentical Hematopoietic Stem Cell Transplant:An Open-Label Randomized Clinical Trial.JAMA Oncol.2024;10(2):220-226.doi:10.1001/jamaoncol.2023.5757
[6] Pan J,Tan Y,Shan L,et al.Allogeneic CD5-specific CAR-T therapy for relapsed/refractory T-ALL:a phase 1 trial[published correction appears in Nat Med.2024 Oct 16.doi:10.1038/s41591-024-03348-1].Nat Med.Published online October 1,2024.doi:10.1038/s41591-024-03282-2
[7] Ni Y,You G,Gong Y,et al.Human yolk sac-derived innate lymphoid-biased multipotent progenitors emerge prior to hematopoietic stem cell formation.Dev Cell.2024;59(19):2626-2642.e6.doi:10.1016/j.devcel.2024.06.010
[8] Zhang X,Liu B,Huang J,et al.A predictive model for therapy failure in patients with chronic myeloid leukemia receiving tyrosine kinase inhibitor therapy.Blood.2024;144(18):1951-1961.doi:10.1182/blood.2024024761
[9] Han G,Cui M,Lu P,et al.Selective translation of nuclear mitochondrial respiratory proteins reprograms succinate metabolism in AML development and chemoresistance.Cell Stem Cell.2024;31(12):1777-1793.e9.doi:10.1016/j.stem.2024.09.008
[10] Du C,Liu C,Yu K,et al.Mitochondrial serine catabolism safeguards maintenance of the hematopoietic stem cell pool in homeostasis and injury.Cell Stem Cell.2024;31(10):1484-1500.e9.doi:10.1016/j.stem.2024.07.009
Chen F,Lu Y,Xu Y,et al.Trim47 prevents hematopoietic stem cell exhaustion during stress by regulating MAVS-mediated innate immune pathway.Nat Commun.2024;15(1):6787.Published 2024 Aug 8.doi:10.1038/s41467-024-51199-8
排版编辑:肿瘤资讯-Kaylee











 苏公网安备32059002004080号
苏公网安备32059002004080号


