岁末年初,为更好地传递胃癌治疗的最新研究动态,在山东大学齐鲁医院“齐肿内科大查房”第162期栏目中,山东大学齐鲁医院肿瘤内科刘联教授为大家系统梳理并深入解读了2024年胃癌治疗领域的重磅研究进展。【肿瘤资讯】整理该报告要点,以飨读者。

胃癌,作为全球范围内高发的恶性肿瘤之一,其治疗进展一直备受瞩目。近年来,胃癌治疗取得飞速发展,免疫治疗、靶向治疗和转化治疗等新策略为患者带来希望。回顾2020年至今,从免疫治疗的初步探索到ADC药物的崛起,每一次进步都为胃癌患者带来新的希望。
2024年,胃癌治疗领域的研究继续高歌猛进,取得了令人瞩目的成果。刘联教授将结合自身丰富的临床经验和最新的研究成果,重点关注围手术期治疗、晚期胃癌治疗等方面的探索,并结合临床实践经验,为临床医生提供参考和指导,助力胃癌治疗的进一步发展。
围手术期治疗
2024年,胃癌围手术期治疗领域的研究进展主要集中在既往研究的长期随访结果和新辅助治疗策略的探索。令人遗憾的是,备受期待的MATTERHORN和DRAGON IV两项大型III期临床试验,在2024年仍未公布最终的生存分析结果。
KEYNOTE-585研究:新辅助治疗降期与长期生存获益相关
KEYNOTE-585研究在既往报道病理完全缓解(pCR)数据的基础上,进一步分析了主要病理缓解(MPR)、T分期、N分期和淋巴结降期等指标与长期生存的关系,发现这些指标均与长期生存显著相关,且新辅助免疫治疗组的各项指标均较化疗组提升约10%(图1)。

虽然MPR指标在免疫联合化疗组表现更佳(HR=0.6),但两组的总生存(OS)差异无统计学意义(图2,3)。这表明,无论是免疫联合化疗还是单纯化疗,只要近期治疗能使肿瘤降期,就有可能转化为远期生存获益。该研究首次在大样本胃癌新辅助治疗研究中证实了近期疗效与远期生存的相关性。


TOPGEAR研究:添加术前放疗未能改善可手术胃癌患者生存
TOPGEAR研究评估了术前同步放化疗联合术后化疗,对比单纯术前化疗联合术后化疗,治疗可手术胃癌的疗效差异。研究背景是既往研究已证实术后放疗对淋巴结阳性或D1手术患者有生存获益,但术前放疗的价值尚不明确。
TOPGEAR研究纳入570例患者,主要研究终点为OS,次要研究终点为无进展生存期(PFS)等。研究者预期术前放疗能使患者死亡风险下降24%(HR=0.76),并将5年生存率从40%提升至50%。结果显示,虽然术前放疗组的pCR率显著高于单纯化疗组(16.8% vs 8%),但未转化为生存获益,两组的OS和PFS均无显著差异(图4,5)。此外,术前放疗组的毒性反应也更明显(图6)。



TOPGEAR研究结果表明,对于可手术胃癌患者,在术前同步放化疗基础上增加放疗并不能改善患者的OS和PFS,反而会增加毒性反应。因此,目前不推荐在术前新辅助治疗中常规应用放疗。该研究结果为胃癌围手术期放疗策略的制定提供了重要参考依据。
晚期胃癌一线治疗——HER2阴性
COMPASSION-15研究:卡度尼利单抗为HER2阴性晚期胃癌带来新突破
在2024年4月AACR大会上公布的COMPASSION-15研究结果显示,卡度尼利单抗联合化疗一线治疗HER2阴性晚期胃癌取得了显著的疗效,尤其是在既往研究中难以获益的PD-L1表达水平较低的患者群体中也展现出优势。
卡度尼利单抗是一种PD-1/CTLA-4双特异性抗体,其设计理念是基于肿瘤微环境中同时表达PD-1和CTLA-4的淋巴细胞比例较高这一现象,通过将两个靶点结合在一个抗体上,提高对肿瘤局部的靶向性。此前,该研究团队已在Nature Medicine杂志上发表了卡度尼利单抗的早期临床研究COMPASSION-3的结果,显示其在包含PD-L1低表达患者的群体中取得了良好的疗效和生存数据。
COMPASSION-15研究是一项双盲、III期随机对照试验,主要终点是全人群的OS,次要终点是PD-L1高表达人群的OS(图7)。结果显示,卡度尼利单抗联合化疗组的PFS和OS均显著优于单纯化疗组,且在PD-L1表达水平不同的亚组中也均取得了阳性结果(图8,9)。值得关注的是,该研究首次证实了免疫治疗在PD-L1表达水平小于5的HER2阴性晚期胃癌患者中也能带来显著的OS获益(图10)。

图7. COMPASSION-15研究设计。

图8. COMPASSION-15的PFS结果。


然而,对于PD-L1表达水平小于1的患者,卡度尼利单抗联合化疗组虽然显示出获益趋势,但OS差异尚未达到统计学意义。因此,未来仍需进一步探索如何改善这类患者的治疗效果。
回顾过去五年的研究结果,可以发现,卡度尼利单抗是首个在PD-L1表达水平小于5的HER2阴性晚期胃癌患者中取得OS获益的免疫治疗药物(图11)。此外,既往研究大多未报告PD-L1表达水平大于等于1的患者的生存数据,而COMPASSION-15研究和KEYNOTE-859研究均显示,这类患者的OS获益显著。

综合分析这些研究结果,可以推测PD-L1表达水平在1到4之间的患者可能是一个被忽视的群体,他们也能从免疫治疗中获益。既往文献综述和真实世界研究数据也支持这一观点。因此,未来研究应将PD-L1表达水平小于5的患者进一步细分为1到4和<1两个亚组,分别探索其治疗策略。
卡度尼利单抗的成功为HER2阴性晚期胃癌的治疗带来了新的希望,也为PD-L1表达水平的界定和临床应用提供了新的思路。未来,期待更多研究能进一步完善PD-L1低表达患者的治疗策略,让更多患者获益。
Moonlight研究:双免疫联合化疗治疗HER2阴性晚期胃癌的阴性结果引发思考
与卡度尼利单抗的成功形成对比的是,备受关注的IKF-AIO-Moonlight研究结果却令人失望。该研究旨在评估PD-1抑制剂纳武利尤单抗联合CTLA-4抑制剂伊匹木单抗用于HER2阴性晚期胃癌一线治疗的疗效,结果显示,双免疫联合化疗并未带来显著的生存获益。
Moonlight研究包含三个队列:队列A1为同步使用FOLFOX方案化疗联合纳武利尤单抗和伊匹木单抗;队列A2为FOLFOX方案化疗后序贯使用双免疫治疗;队列B为单纯FOLFOX方案化疗。此外,还有一个队列C为FOLFOX方案化疗联合纳武利尤单抗单药治疗,该队列不参与统计学比较,仅进行结果描述。
研究结果显示,队列A1和A2的疗效均不优于队列B,甚至队列A2(序贯双免疫治疗)的PFS和OS均表现最差。队列C(单免疫联合化疗)的PFS和OS虽然优于队列A1和A2,但也未显示出明显的优势(图12,13)。

图12. IKF-AIO-Moonlight研究生存获益结果。

Moonlight研究结果提示,对于HER2阴性晚期胃癌,PD-1抑制剂联合CTLA-4抑制剂的双免疫治疗策略可能并不优于单纯化疗,甚至可能带来更差的预后。
Moonlight研究结果的阴性结果引发了人们对双免疫治疗策略的重新思考。PD-1/CTLA-4双靶点单抗与PD-1抑制剂联合CTLA-4抑制剂的双免疫治疗方案,为何疗效差异如此之大?这其中是否与药物的靶向性、作用机制等因素有关?这些问题都需要未来进一步的研究来解答。
IKF-575/RENAISSANCE研究:转移性胃癌转化治疗的探索
IKF-575/RENAISSANCE的III期研究探讨了转化治疗后手术能否延长转移性胃癌患者的生存期。该研究源于一项前期研究,结果显示FLO3方案化疗后约60%的患者可转化为可手术,且中位生存期延长至近2年。
RENAISSANCE研究采用随机对照设计,将患者分为两组:转化治疗组(化疗后评估是否可手术,若可手术则进行手术切除+术后化疗)和单纯化疗组。考虑到转移部位的复杂性,研究者将患者分为两大类:仅有腹膜后淋巴结转移和存在其他部位转移(如肝、肺、卵巢、骨、腹膜等)。
研究结果显示,转化治疗组术后化疗的完成率较低,仅4%的患者完成了12个周期的治疗,而单纯化疗组的完成率高达40%(图14)。此外,单纯化疗组中有15例患者最终也接受了手术治疗,这给结果分析带来了一定挑战。

按初始分组进行分析,转化治疗组的中位OS为18.5个月,单纯化疗组为23.6个月,但差异无统计学意义。将单纯化疗组中接受手术的15例患者归入转化治疗组后,两组的中位OS均为23个月左右,仍无显著差异(图15)。

亚组分析结果显示,对于仅有腹膜后淋巴结转移的患者,转化治疗组的中位OS显著延长至近30个月,3年OS率也从19%提升至近50%(图16)。而对于肝转移患者,两组OS无显著差异;对于腹膜转移患者,转化治疗组的OS反而更差(11.9个月 vs 18.6个月)。

该研究提示,对于仅有腹膜后淋巴结转移的患者,转化治疗后手术可能带来生存获益。而对于肝转移患者,手术的价值尚待明确;对于腹膜转移患者,手术可能反而不利。此外,考虑到手术对生活质量的影响,未来或可探索其他局部治疗手段(如放疗等)替代手术。
总之,IKF-575/RENAISSANCE研究结果为转移性胃癌的转化治疗提供了新的思路,也提示应根据患者的具体情况制定个体化治疗方案。
SHR-1701联合化疗一线治疗HER2阴性晚期胃癌取得显著疗效
在2024年ESMO会议上,北京大学肿瘤医院沈琳教授团队报道了SHR-1701联合化疗用于HER2阴性晚期胃癌一线治疗的研究结果,取得了令人瞩目的成果。SHR-1701是一种新型的PD-1/TGF-β双功能融合蛋白,通过同时阻断PD-1和TGF-β通路,增强抗肿瘤免疫反应。
该研究是一项III期随机对照试验,结果显示SHR-1701联合化疗组的中位OS达到了15.8个月,HR仅为0.66,显著优于单纯化疗组。尤其是在PD-L1高表达(CPS≥5)的患者中,SHR-1701联合化疗的疗效更为显著,显示出该药物对PD-L1高表达患者可能具有更好的疗效预测价值(图17)。
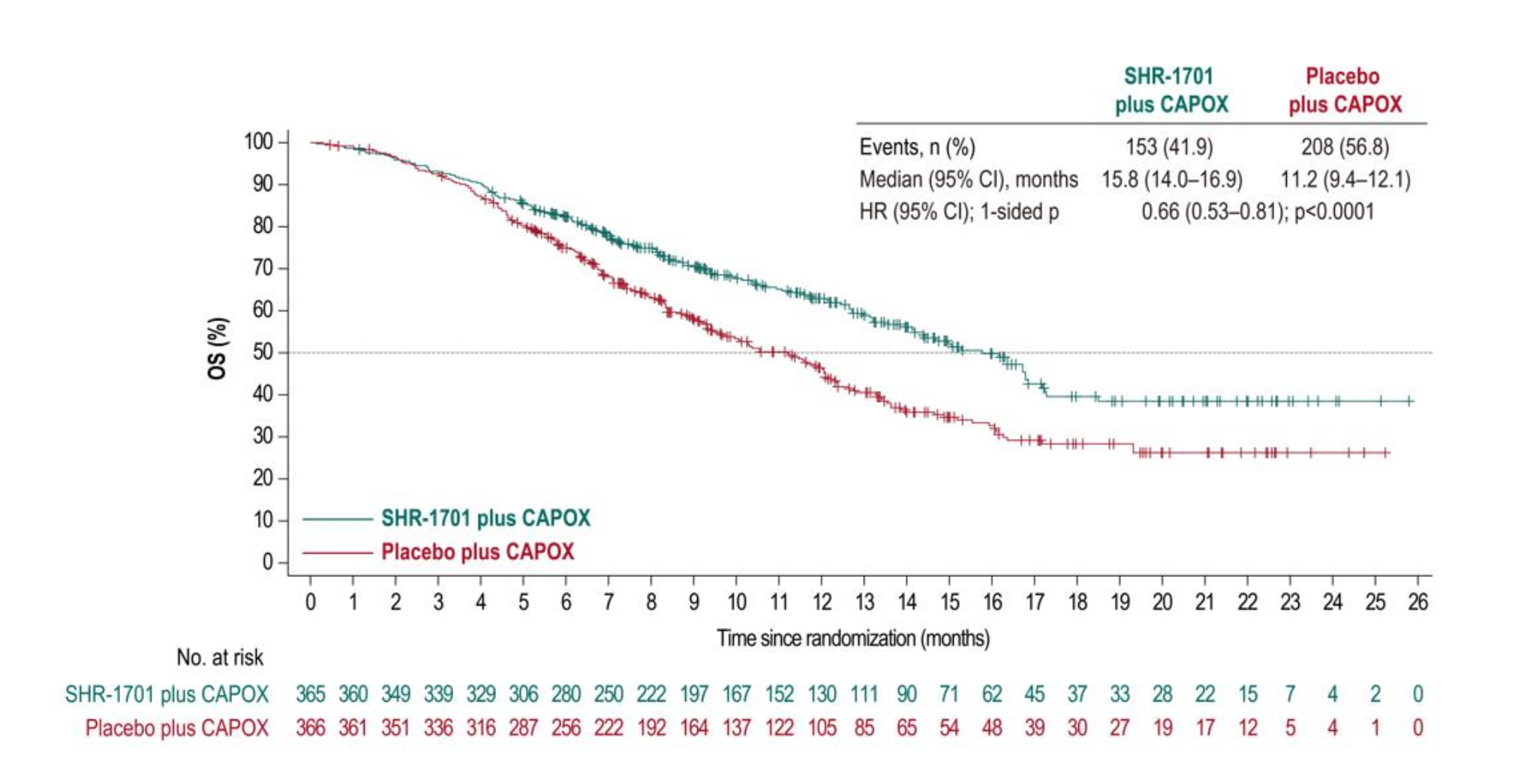
SHR-1701的优异表现为HER2阴性晚期胃癌的治疗带来了新的希望,有望在未来获批上市,为患者提供更多治疗选择。
晚期胃癌一线治疗——HER2阳性
KEYNOTE-811研究:PD-L1表达或可预测HER2阳性晚期胃癌患者免疫联合治疗的获益
KEYNOTE-811研究评估了帕博利珠单抗联合曲妥珠单抗和化疗一线治疗HER2阳性晚期胃癌的疗效。该研究此前公布的OS中期分析结果显示,HR为1.01,未能达到统计学显著差异。然而,今年ESMO会议上公布的最终OS分析结果却带来了惊喜,HR降至0.80,达到了阳性结果。虽然KEYNOTE-811研究在全人群中取得了OS和PFS的双重获益,但亚组分析结果显示,PD-L1高表达(CPS≥1)的患者获益显著,而PD-L1低表达(CPS<1)的患者的PFS和OS均未得到改善,甚至OS更短(图18)。这表明,KEYNOTE-811的阳性结果主要由PD-L1高表达的患者驱动。

KEYNOTE-811研究结果引发了对HER2阳性晚期胃癌治疗策略的思考。尽管靶向治疗联合免疫治疗已成为HER2阳性晚期胃癌治疗的新方向,但对于PD-L1低表达的患者,其疗效仍不尽如人意。因此,仍需继续探索更有效的治疗方案,以改善这类患者的预后。
RCTS研究:维迪西妥单抗联合替雷利珠单抗和替吉奥一线治疗HER2阳性晚期胃癌疗效显著
齐鲁医院肿瘤内科发起完成的RCTS研究探索了维迪西妥单抗联合替雷利珠单抗和替吉奥用于HER2阳性晚期胃癌一线治疗的研究,该研究设计参考了前期关于该方案在后线治疗中的疗效和安全性探索。
这项研究纳入11%的HER2低表达(2+FISH阴性)患者和近60%的PD-L1低表达(CPS<1)患者,这在以往的研究中并不常见。结果显示,即使在这样对结果可能不利的情况下,该方案仍取得了令人鼓舞的疗效,客观缓解率超过90%,1年PFS率达到71.6%,1年OS率达到97.6%,中位肿瘤缩小率为65.8%。这些结果已在ASCO会议上口头报道,是最早报道ADC药物联合免疫治疗和氟尿嘧啶类药物用于HER2阳性晚期胃癌一线治疗的研究结果(图19,20)。


此外,该方案的安全性也较为可接受,3级及以上不良反应发生率为52.8%。目前,该课题组正在进行一项II期随机对照试验,以期进一步验证该方案的疗效和安全性。
DESTINY-Gastric03研究:探索T-DXd联合治疗用于HER2阳性晚期胃癌一线治疗的多队列研究
一项关于德曲妥珠单抗(T-DXd)用于HER2阳性晚期胃癌的多队列研究DESTINY-Gastric03(DG-03)的结果在ESMO会议上报道。该研究共纳入340余例患者,分为6个队列,分别评估T-DXd单药、T-DXd联合帕博利珠单抗、T-DXd联合化疗+帕博利珠单抗(已停)、T-DXd联合化疗、T-DXd联合化疗+帕博利珠单抗(降剂量)以及化疗联合曲妥珠单抗的疗效和安全性。
由于该研究并非随机对照设计,队列间直接比较的严谨性有限。但结果显示,各队列的PD-L1表达水平均在50%左右,与真实世界情况较为接近。有趣的是,疗效最佳的并非三药联合方案,而是传统的曲妥珠单抗联合化疗方案,其ORR高达76%(图21)。T-DXd单药及联合方案的ORR则在58~78%,差异较大,具体原因尚待探究。

尽管队列间直接比较的意义有限,但组内分析显示,PD-L1高表达(CPS≥1)患者在T-DXd联合免疫治疗方案中的获益更为显著。此外,T-DXd联合化疗+帕博利珠单抗方案在CPS≥1的患者中的中位PFS长达14个月,中位OS也达到了23个月,较KEYNOTE 811的生存结果明显延长(图22,23)。


然而,三药联合方案的毒性较大,3级及以上不良反应发生率高达91%,且脱落率高达50%。降剂量后,毒性显著降低,3级及以上不良反应发生率降至34%(图24)。

综合来看,DESTINY-Gastric03研究结果较为复杂,但仍可从中得出一些结论:PD-L1高表达患者在T-DXd联合免疫治疗方案中获益更多;T-DXd联合化疗+帕博利珠单抗方案的疗效值得关注,但毒性较大,需谨慎选择患者。横向比较两个单臂研究RCTS和DG03的三药队列可知,两个研究的设计类似,均为抗HER2-ADC联合免疫治疗及氟尿嘧啶化疗药物,CPS≥1的比例接近(均低于50%);不同的是前者的ORR更高,且与CPS表达水平关系不大,后者报道了PFS及OS结果,与CPS密切相关。其原因是否与两种药物的化疗药物成分不同有关,尚不得而知。据悉,两个研究都启动了RCT且方案接近,RCTS2是研究者发起的II期RCT,T-Dxd是第一三共公司发起的III期RCT,比较CPS≥1的HER2阳性晚期胃癌一线患者应用T-Dxd联合帕博利珠单抗及氟尿嘧啶对比化疗联合曲妥珠单抗的疗效,主要研究终点为PFS。
排版编辑:肿瘤资讯-Kingsley











 苏公网安备32059002004080号
苏公网安备32059002004080号


