一年一度的美国血液学会(ASH)年会是全球血液学领域规模最大、涵盖最全面的国际学术盛会之一。2024年12月7日至10日,第66届ASH以线上结合线下的形式在美国圣地亚哥(San Diego)盛大召开。来自全球近100个国家和地区的数万名血液病专家、学者及行业相关人士莅临参会,分享和探讨全球最前沿的研究进展和突破性临床研究成果及宝贵的临床实践经验。在ASH大会“Myelodysplastic Syndromes: Clinical and Epidemiological: Treatment and Prognostication of MDS”专场上,来自浙江大学医学院附属第一医院佟红艳教授团队分享了全反式维甲酸(ATRA)联合地西他滨(DEC)治疗骨髓增生异常综合征-原始细胞增多型(MDS-EB)的多中心、随机对照临床研究的最新结果。【肿瘤资讯】特此整理本研究相关内容进行整理,详情如下。
破译MDS:疾病与治疗的双重挑战
MDS的背景简介
MDS是一类异质性造血系统恶性疾病,其特征为无效造血和血细胞减少,多见于中老年人群,平均诊断年龄为70岁以上。患者常表现为贫血、感染和出血倾向,同时伴有演变为急性髓系白血病(AML)的潜在风险。MDS的发病机制复杂,涉及染色体异常(如5q-、7q-)和基因突变(如TP53、SF3B1等)。诊断依赖骨髓形态学检查、染色体核型分析及分子基因检测,并通过国际预后评分系统(IPSS-R)进行风险分层。
MDS的治疗现状
传统的MDS治疗方法是根据预后分组、分层进而选择治疗方法。根据风险分层,低风险MDS以改善造血功能为主,常用促红细胞生成素(ESA)和免疫调节剂;高风险MDS则以延缓疾病进展为目标,低甲基化药物(如DEC、阿扎胞苷)是一线选择。适合的患者可考虑造血干细胞移植(HSCT)。近年来,新型靶向药物等为MDS治疗提供了新希望,但仍面临耐药性和老年患者合并症等挑战。MDS的诊疗仍需进一步优化,以改善患者预后和生活质量。
机制创新:ATRA联合DEC的协同效应
ATRA是一种通过诱导细胞分化而广泛用于急性早幼粒细胞白血病(APL)治疗的药物,而DEC则是一种低甲基化药物,主要通过抑制DNA甲基转移酶(DNMT),实现基因组去甲基化,恢复抑癌基因的正常表达。近年来,研究发现两者联合应用于MDS治疗展现出令人振奋的协同效应,其机制涉及多个层面:
去甲基化的基础作用
DEC通过抑制DNA甲基化,实现了癌基因的抑制与抑癌基因的激活。这一过程不仅改善了MDS患者中骨髓微环境的造血功能,同时为ATRA介导的细胞分化创造了更有利的基因表达环境。
RARα通路的激活
ATRA作用于细胞核内的视黄酸受体α(RARα),诱导白血病细胞分化。而相关研究表明,低甲基化状态下的RARα基因表达显著增加,提示DEC可通过调控RARα信号通路增强ATRA的分化效应。
细胞氧化应激的协同调控
ATRA通过激活Nrf2/RARα复合体,提高活性氧(ROS)水平,从而诱导MDS细胞凋亡。而DEC进一步强化了ROS的生成,并通过调节细胞内抗氧化酶活性,使MDS细胞对氧化应激更为敏感,促进了治疗效果。
细胞周期阻滞与分化的协同作用
DEC的作用不仅局限于去甲基化,还可通过诱导细胞周期阻滞,将MDS细胞同步化,进而提高ATRA介导的分化能力。这种细胞周期与分化的双重调控是两药协同效应的核心。
此外,临床前研究表明,ATRA+DEC联合使用可以显著减少骨髓微环境中的促炎细胞因子水平,从而改善微环境对造血干细胞的不利影响,为MDS治疗带来全新的机制视角。总的来说,ATRA与DEC的协同效应是多机制共同作用的结果,其核心在于低甲基化状态和RARα信号的共同激活。
ATRA+DEC临床研究的里程碑进展
2021年ASH数据回顾
2018年5月~2021年7月,共165例患者被随机分配至DEC+ATRA治疗组(n=82)或DEC单药治疗组(n=83)。主要研究发现包括:
总缓解率(ORR): ATRA+DEC组为85.2%,显著高于DEC组的56.9%(P<0.001)。
无进展生存期(PFS): ATRA+DEC组为19.2个月,DEC组为13.0个月。
不良事件(AE): 两组3/4级血液毒性发生率相似,但ATRA+DEC组的头痛发生率更高(14.7% vs. 4.0%,P<0.001)。
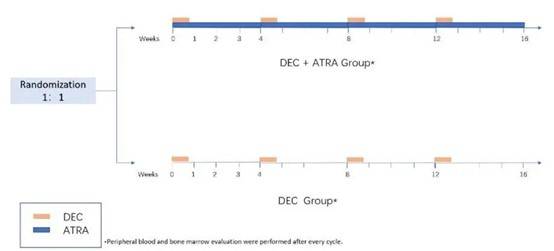
2024年ASH数据更新
在最新的多中心研究中,样本量扩大至227例,随访中位时间延长至30.1个月。这一研究提供了更深入的数据分析与临床观察,进一步巩固了ATRA+DEC在MDS治疗中的地位:
疗效显著提升: ATRA+DEC组的ORR为78.2%,显著高于DEC组的51.3%(P<0.001)。
生存获益明确: 中位总生存期(OS)显著延长至23.0个月,相比之下DEC组为19.3个月(P<0.05)。
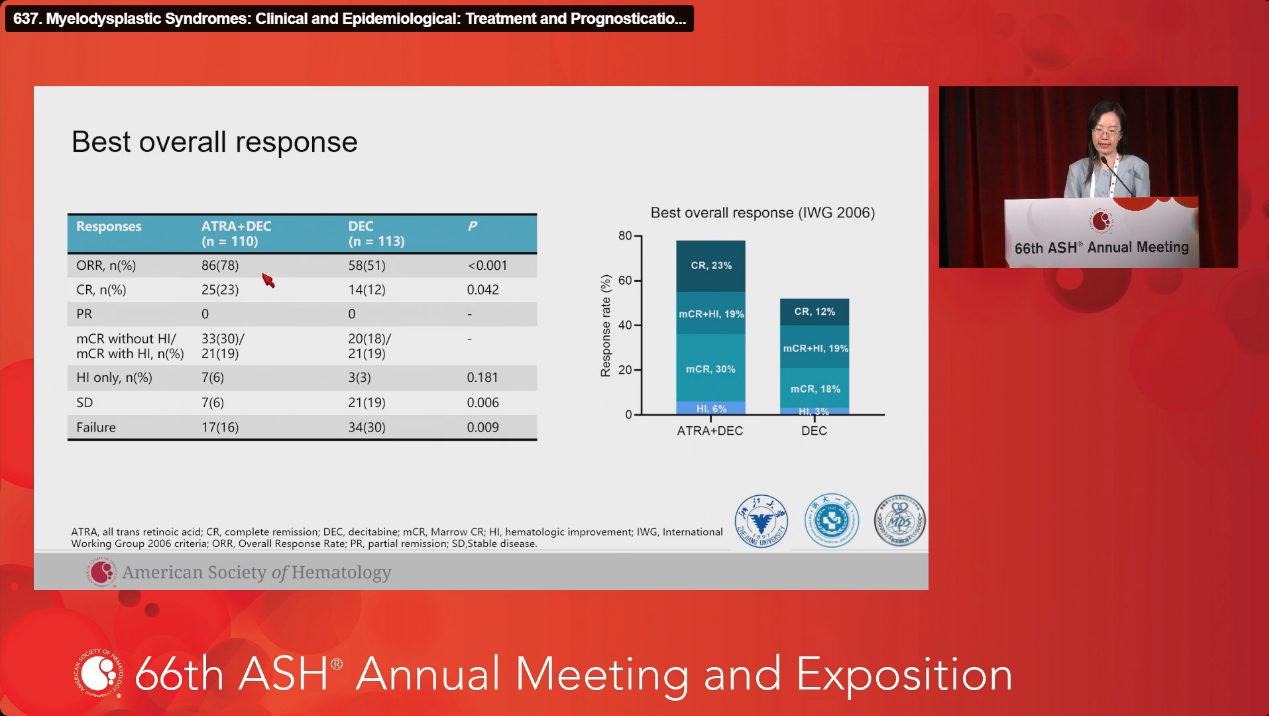
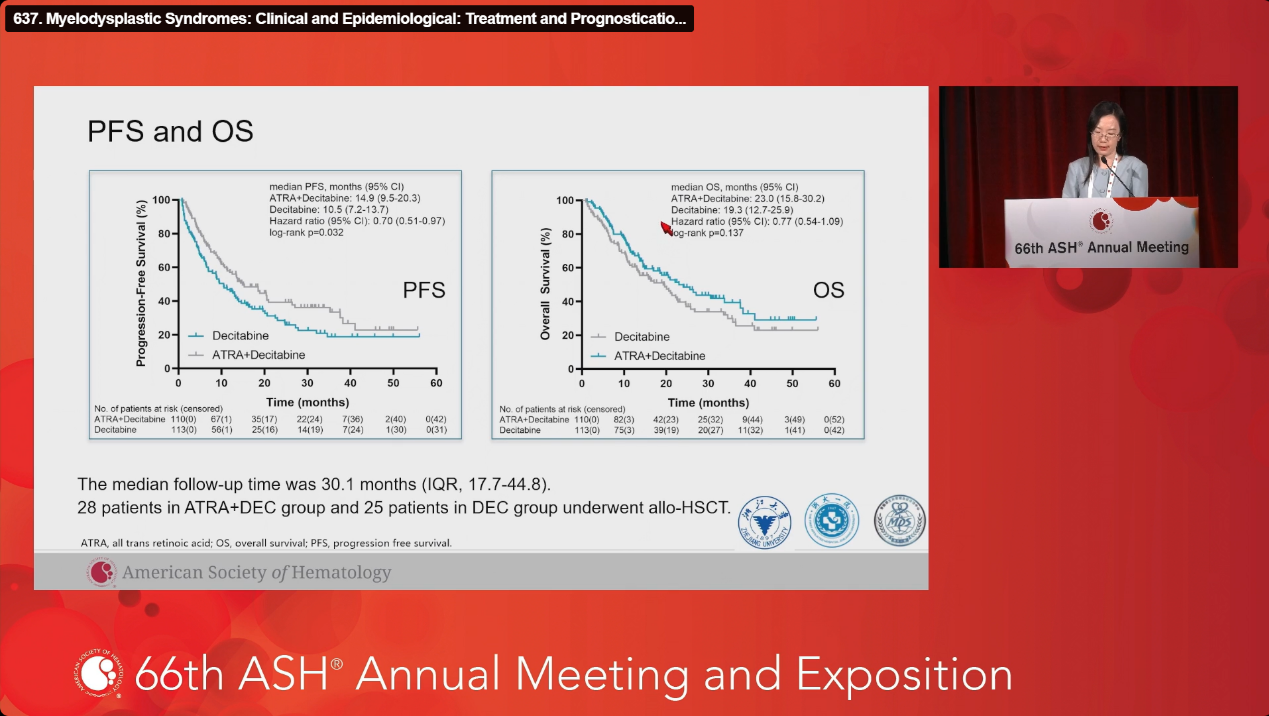
毒性管理可控: 不良事件主要为1-2级,包括皮肤干燥(34.5% vs. 15.3%,P<0.001)、头痛(19.1% vs. 6.2%,P=0.020)和高甘油三酯血症(17.3% vs. 5.3%,P=0.019)。研究者指出,这些不良反应多为轻至中度,可通过对症处理改善。

这些结果表明,ATRA联合DEC较DEC单药治疗显著提高疗效,且不良反应可控,为MDS-EB患者提供了一种安全且高效的治疗选择,并为未来的联合方案研究奠定了基础。
未来展望:探索MDS治疗的更多可能
ATRA联合DEC方案在多个临床研究中展现出显著的治疗优势,为MDS-EB患者提供了新的希望。本届ASH大会的多项研究成果表明,MDS治疗正迈向精准化与个性化的新阶段,未来值得更多期待。
新型疗法的崭露头角
在本届ASH大会上,CD3/CD123双特异性抗体Vibecotamab的研究成为亮点之一。数据显示,该药物在高危髓系肿瘤患者中的缓解率达68%,且未见显著骨髓抑制,为联合治疗提供了理论支持。此外,针对IDH1/IDH2突变的靶向药物艾伏尼布和恩西地平也在复发难治性MDS中展现出显著疗效。
持续攻克TP53突变难题
携带TP53突变的患者在MDS和AML治疗中面临巨大挑战。传统化疗手段效果有限,未来或需依赖新型靶向药物、基因编辑技术及其他前沿治疗手段,为这类患者提供更有效的治疗方案。
Hongyan Tong, et al. Decitabine Plus All-Trans Retinoic Acid Versus Decitabine Monotherapy for Myelodysplastic Syndromes with Excess Blasts: A Multicentre, Randomized Controlled Trial, Abs: 663.
https://ash.confex.com/ash/2024/webprogram/Paper200433.html
排版编辑:肿瘤资讯-Grady











 苏公网安备32059002004080号
苏公网安备32059002004080号


