本期精选5篇在2024年11月份发表的结直肠癌领域文献,部分研究邀请到辽宁省肿瘤医院张睿教授进行深入解读。
专家介绍
辽宁省“百千万人才工程” 百人层次人选;
沈阳市高层次人才 领军人才
美国结直肠外科专委会(ASCRS) 委员
国家结直肠肿瘤质控专家委员会 委员
国家卫健委医疗器械司评审专家
中华结直肠癌MDT联盟 主席
中国抗癌协会第一届青年理事会 理事
中国抗癌协会结直肠肿瘤专业委员会 委员
中国临床肿瘤学会(CSCO)黑色素瘤专家委员会 常委
中国医师协会结直肠肿瘤专业委员会青委会 副主任委员
中国医疗保健国际交流促进会神经内分泌肿瘤分会 常务委员
中国医疗保健国际交流促进会消化道肿瘤多学科分会 常务委员
中国抗癌协会结直肠癌肝转移学组 委员
中国人体健康科技促进会肠息肉防治专业委员会 常务委员
中华结直肠外科学院学术委员会 委员
中国临床成果转化学术委员会常务 委员
纳武利尤单抗联合伊匹木单抗治疗MSI-H的转移性结直肠癌[1]
高度微卫星不稳定(MSI-H)或错配修复功能缺陷(dMMR)的转移性结直肠癌患者在接受标准化疗时,无论是否联合靶向治疗,预后均不理想。在MSI-H或dMMR转移性结直肠癌的非随机研究中,纳武利尤单抗联合伊匹木单抗治疗展现出临床获益。
在这项Ⅲ期开放标签试验中,研究人员依据当地检测结果将具有MSI-H或dMMR状态的不可切除或转移性结直肠癌患者随机分配至纳武利尤单抗联合伊匹木单抗组、单独纳武利尤单抗治疗组或化疗组(可选择是否联合靶向治疗),分组比例为2∶2∶1。在经中心确认MSI-H或dMMR状态的患者中进行评估,主要终点为无进展生存期,包含两项比较:比较纳武利尤单抗联合伊匹木单抗组与化疗组一线治疗的无进展生存期;比较纳武利尤单抗联合伊匹木单抗组与单独纳武利尤单抗治疗组的无进展生存期(不论患者先前是否接受过转移性疾病的系统治疗)。在这一预设的中期分析中,评估了第一项比较的主要终点(纳武利尤单抗联合伊匹木单抗组 vs 化疗组)。
共303例未曾接受过转移性疾病系统治疗的患者被随机分配接受纳武利尤单抗联合伊匹木单抗治疗或化疗,其中经中心确认为MSI-H或dMMR型肿瘤的患者共255例。中位随访31.5个月(范围6.1~48.4个月)时,纳武利尤单抗联合伊匹木单抗组的无进展生存期结果(初始分析)显著优于化疗组(无进展生存期组间差异P<0.001,使用双侧分层对数秩检验计算)。24个月时,纳武利尤单抗联合伊匹木单抗组的无进展生存率为72%(95% CI,64%~79%),而化疗组为14%(95% CI,6%~25%)。24个月时,纳武利尤单抗联合伊匹木单抗组的平均生存期(限制均值)*比化疗组长10.6个月(95% CI,8.4~12.9个月)(图1),这一结果与无进展生存期的初始分析一致。纳武利尤单抗联合伊匹木单抗组的3级或4级治疗相关不良事件发生率为23%,而化疗组为48%。
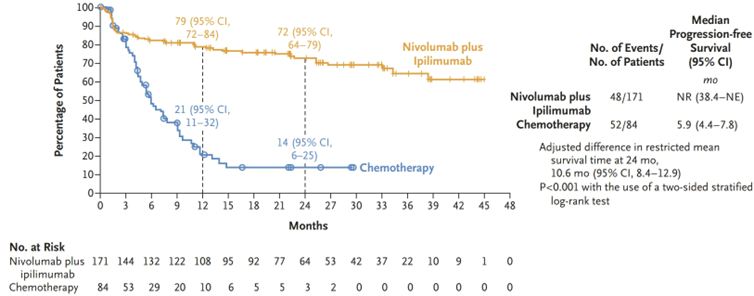
在未接受过系统治疗的MSI-H或dMMR转移性结直肠癌患者中,纳武利尤单抗联合伊匹木单抗治疗组的无进展生存期优于化疗组。(本研究由百时美施贵宝和小野制药资助;CheckMate 8HW临床试验注册号:NCT04008030)。
(* 限制均值是一种衡量从时间0到指定时间点的平均生存期的指标,可以通过在该时间点之前的生存曲线下的面积来估计。)
张睿教授:在MSI-H或dMMR转移性结直肠癌患者中,传统化疗的疗效较差,且预后不理想,因此迫切需要新的治疗方案。近年来,免疫检查点抑制剂在肿瘤治疗中的应用逐渐获得关注,MSI-H或dMMR肿瘤通常表现出较高的突变负荷和活跃的免疫微环境,这使得它们在免疫治疗中表现出较好的反应。已有研究表明,PD-1抑制剂在MSI-H或dMMR型结直肠癌患者中显示出显著的疗效。例如,KEYNOTE-177研究中,帕博利珠单抗(PD-1抑制剂)单药治疗MSI-H结直肠癌患者的无进展生存期(PFS)显著优于化疗。与此同时,CheckMate 142研究也表明,纳武利尤单抗单药治疗也可以使MSI-H结直肠癌患者的临床缓解率和总体生存期获益。尽管这些研究均展示了PD-1抑制剂在MSI-H或dMMR结直肠癌中的疗效,但由于免疫逃逸机制的复杂性,并非所有患者都能从单药免疫治疗中持续获益,因此研究者开始探索免疫联合治疗的方案。CTLA-4抑制剂伊匹木单抗已被证明能够增强PD-1抑制剂的效果,尤其在某些恶性肿瘤中表现出良好的协同作用。纳武利尤单抗和伊匹木单抗的联合使用在一些研究中也显示出显著的临床获益。
针对这一背景,研究人员开展了这项Ⅲ期临床试验,研究展示了纳武利尤单抗联合伊匹木单抗在MSI-H或dMMR转移性结直肠癌患者中的显著疗效,相较于传统化疗,能够显著提高无进展生存期(PFS)和延长患者的平均生存期,同时具有更好的耐受性和较低的不良事件发生率。研究设计严谨,采用随机、开放标签的方式将患者分为免疫治疗组、单独免疫治疗组和化疗组,确保了结果的可靠性。研究结果显示,免疫治疗组在24个月时的无进展生存率为72%,显著高于化疗组的14%,且在24个月时免疫治疗组的平均生存期延长了10.6个月。不良事件方面,免疫治疗组的3级或4级治疗相关不良事件发生率为23%,显著低于化疗组的48%。这些结果为MSI-H或dMMR转移性结直肠癌患者提供了新的治疗方案,并可能成为未来的一线治疗选择。
尽管如此,研究存在开放标签设计可能导致的偏倚风险,且随访时间相对较短,长期疗效和安全性仍需进一步验证。总体而言,免疫联合治疗的疗效和耐受性显著优于传统化疗,未来的研究可探索与其他治疗的联合方案以及进一步验证长期生存数据。
帕尼单抗联合FOLFIRI一线持续治疗或间歇治疗RAS/BRAF野生型mCRC:IMPROVE试验[2]
IMPROVE研究旨在探索一线氟尿嘧啶、亚叶酸钙和伊立替康(FOLFIRI)联合帕尼单抗(PAN)诱导治疗后,间歇性治疗是否能预防或延迟耐药的出现,并改善不可切除的RAS/BRAF野生型(wt)转移性结直肠癌(mCRC)患者的安全性和治疗依从性。
该研究(ClinicalTrials.gov标识符:NCT04425239)是一项开放标签、多中心、随机的Ⅱ期非比较试验。不可切除的RAS/BRAF wt mCRC患者被随机分配(1∶1)至持续治疗组(A组)和间歇性治疗组(B组),A组持续接受FOLFIRI联合PAN直到疾病进展,B组设有无治疗间隔,直到进展、不可耐受的毒性或死亡。研究的主要终点为12个月时的治疗无进展生存(PFSot)*。假设中位PFSot≤7个月,目标PFSot≥10个月,按二项分布检验每组需要65例患者以达到80%的检验效能和10%的Ⅰ类错误的检验条件。
在2018年5月至2021年6月期间,共有69例患者被随机分配至A组,68例患者至B组。A组的中位治疗周期数为13个,B组为16个。在中位随访43.2个月(四分位数范围,35.0~50.5个月)时,A组和B组的中位PFSot分别为11.2个月和17.5个月(图2),12个月PFSot率分别为45.7%和58.5%。两组的总缓解率分别为68.1%和61.2%。A组和B组的中位总生存期分别为36.3个月和35.1个月。PAN相关的2级以上皮肤不良事件总体发生率在A组和B组分别为30.3%和17.9%。
FOLFIRI联合PAN诱导治疗后间歇方案是可行的。该研究的主要终点达成同时减轻了毒性,使患者获得更多的非治疗时间。
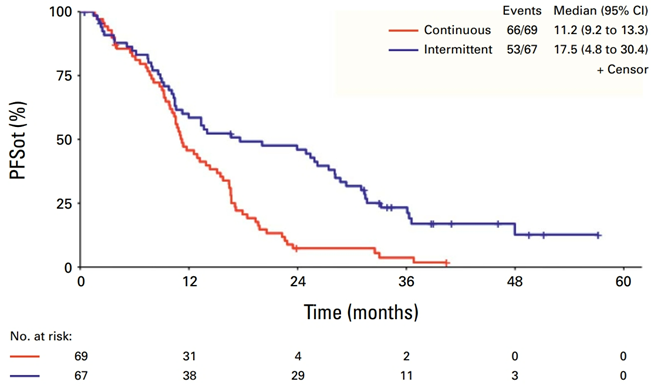
[*治疗无进展生存(PFSot)指从随机分配到治疗期间首次客观疾病进展(不包括治疗间隔期间的客观疾病进展)或任何原因死亡的时间间隔,以先发生者为准。选择PFSot作为主要终点是因为治疗间隔期间的疾病进展并不意味着对初始治疗的抗药性,允许潜在的再治疗]
张睿教授:RAS/BRAF基因突变是结直肠癌中的重要分子标志物,其中RAS/BRAF突变型肿瘤通常对抗EGFR(表皮生长因子受体)单抗类药物(如帕尼单抗)反应较差。相比之下,RAS/BRAF野生型患者通常对抗EGFR疗法有较好的反应,因此这一亚组患者的治疗方案成为了研究的重点。尽管FOLFIRI(氟尿嘧啶、亚叶酸钙、伊立替康)联合抗EGFR治疗是当前RAS/BRAF野生型mCRC的标准一线治疗方案,耐药性和治疗相关的副作用依然是限制其疗效的主要因素。尤其是耐药的发生通常出现在治疗的后期,如何延迟耐药的出现,并维持较好的疗效和安全性,仍然是该病种治疗中的关键难题。
IMPROVE研究正是在这一背景下展开,旨在探索在一线FOLFIRI联合帕尼单抗诱导治疗后,间歇性治疗是否能够延迟耐药的发生,并改善RAS/BRAF野生型不可切除转移性结直肠癌患者的治疗效果和安全性。该研究是一项开放标签、多中心、随机的Ⅱ期非比较试验,患者被随机分配到持续治疗组和间歇性治疗组,评估这两种治疗方案对疾病进展、治疗耐受性以及患者生活质量的影响。研究结果显示,间歇性治疗组在治疗无进展生存期(PFSot)上显著优于持续治疗组(17.5个月 vs. 11.2个月),且12个月的PFSot率分别为58.5%和45.7%,表明间歇性治疗有助于延缓耐药的发生,延长疾病控制期。尽管两组的总缓解率差异不大(68.1% vs. 61.2%),总生存期差异也未显著(36.3个月 vs. 35.1个月),但间歇性治疗未影响患者的生存期。更重要的是,间歇性治疗组在皮肤不良事件的发生率方面(17.9% vs. 30.3%)显著低于持续治疗组,显示出更好的治疗耐受性和患者依从性。
IMPROVE研究的创新性在于首次系统评估了间歇性治疗对延缓耐药和提高治疗耐受性的潜力,尤其是在RAS/BRAF野生型mCRC的治疗中,提供了新的思路。然而,研究作为非比较试验的局限性使得其结果不能与其他标准治疗方案进行直接对比,且研究的随访时间相对较短,长期效果仍需进一步验证。此外,研究的患者群体仅限于RAS/BRAF野生型mCRC,可能限制了结果的外推性。尽管如此,IMPROVE研究为间歇性治疗提供了初步的临床证据,表明其在延缓耐药、提高治疗耐受性方面可能具有重要意义,未来的研究应进一步验证其在不同患者群体中的疗效,并探索其长期生存益处。
腹腔镜辅助与开放手术治疗低位直肠癌(LASRE):多中心、随机对照、非劣效研究的3年生存结果[3]
腹腔镜手术在直肠癌的治疗中越来越多地被应用,但对于低位直肠癌,该治疗的远期肿瘤学预后尚未完全确证。该研究旨在评估腹腔镜手术与开放手术治疗低位直肠癌的3年生存结果。
这是一项在中国22家三级医院进行的多中心、随机对照的非劣效性试验。纳入的患者年龄在18至75岁之间,经组织学确认为cT1~2N0、cT3~4aN0或cT1~4aN1~2的直肠腺癌患者,且肿瘤距齿状线5厘米以内。入组患者被随机分配(2∶1)接受腹腔镜手术或开放手术。采用一种网络应答系统完成中心随机分配,并按临床分期、年龄、性别、BMI和美国麻醉医师协会分类进行分层。研究者、患者和统计学家均未对组别分配进行盲法处理。该研究的主要终点是3年无病生存期,其定义为从手术日期到局部复发、远处转移或因任何原因死亡的时间并以先发生者进行统计。非劣效性的定义为组间差异(腹腔镜手术组-开放手术组)的单侧97.5%置信区间下限大于-10%。初始分析在修正的意向治疗人群中完成,该人群排除了在手术期间发现远处转移的患者以及未接受手术或仅接受局部切除的患者。该试验已在ClinicalTrials.gov注册,注册号为NCT01899547,并已完成。
在2013年11月12日至2018年6月6日期间共招募了1070例患者并随机分配治疗。1039例[685例在腹腔镜手术组,354例在开放手术组;中位年龄57岁,四分位数范围50~64岁;620例(60%)男性和419例(40%)女性]被纳入修正的意向治疗分析集。腹腔镜手术组的3年无病生存率为81.4%(95% CI] 78.2%~84.1%),开放手术组为79.8%(95% CI,75.2%~83.6%)[风险比(HR)=0.92,95% CI,0.69~1.23;P=0.56](图3)。组间差异为1.60%(单侧97.5% CI,-3.34-∞,P<0.0001表明非劣效性)。腹腔镜手术组的3年总生存率为91.7%(95% CI,89.3%~93.5%),开放手术组为93.7%(95% CI,90.6%~95.8%)(HR=1.34,95% CI 0.82~2.19;P=0.24)。3年局部复发率分别为3.7%(95% CI,2.5%~5.3%)和2.3%(95% CI,1.1%~4.3%)(HR=1.64,95% CI 0.74~3.63;P=0.22)。开放手术组的5年总生存率为84.6%(95% CI,81.5%~87.1%)和86.6%(95% CI,82.5%~89.8%)(HR=1.16,95% CI 0.82~1.64;P=0.41)。
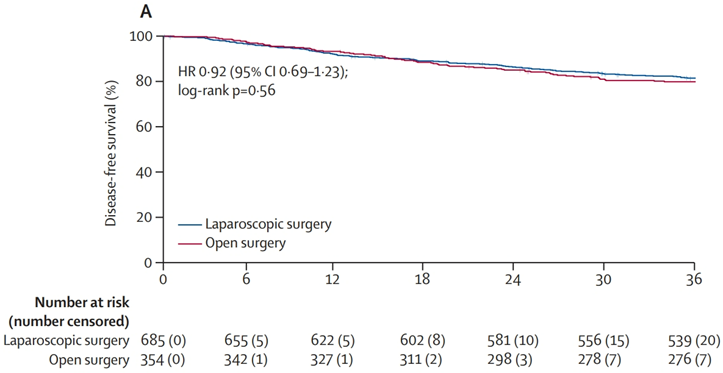
该研究在低位直肠癌患者中进行的腹腔镜手术由经验丰富的外科医生完成,腹腔镜手术的3年无病生存期不劣于开放手术。该研究的结果支持在低位直肠癌中应用腹腔镜手术。
张睿教授:低位直肠癌的治疗一直是肿瘤外科领域的难点之一,尤其在手术方式的选择上,腹腔镜手术和开放手术在肿瘤学预后上的差异长期存在争议。腹腔镜手术由于创伤小、恢复快、住院时间短等优点,在结直肠癌的治疗中得到了广泛应用,但对于低位直肠癌的远期预后尚未得到充分确证。
LASRE研究是在中国22家三级医院进行的大规模多中心、随机对照非劣效性试验,旨在评估腹腔镜手术与开放手术治疗低位直肠癌的3年生存结果,尤其是关注两种手术方式在无病生存期、总生存期及局部复发率等方面的差异。研究结果表明,腹腔镜手术组和开放手术组在3年无病生存率(81.4% vs. 79.8%)和总生存率(91.7% vs. 93.7%)方面无显著差异,且组间差异在统计学上满足非劣效性的要求(P<0.0001)。这表明腹腔镜手术在低位直肠癌的治疗中,至少在肿瘤学预后方面,与传统的开放手术相当。此外,腹腔镜组的局部复发率(3.7% vs. 2.3%)虽然略高,但差异不显著(P=0.22),进一步证实了两者在疗效上的相似性。值得注意的是,腹腔镜手术在创伤、恢复等方面的优势,使得它成为了许多患者的首选治疗方案。
研究结果不仅支持了腹腔镜手术的非劣效性,也为低位直肠癌患者提供了更多的治疗选择。然而,研究也存在一定的局限性。首先,虽然腹腔镜手术在术后恢复方面具有显著优势,但由于其技术要求较高,手术过程中的技术难度较大,这对外科医生的经验和医院的设备要求提出了较高的标准,可能影响一些医疗机构对腹腔镜手术的普及应用。其次,尽管该研究已经证明了腹腔镜手术在3年生存率和无病生存率上与开放手术的非劣效性,但长期随访结果仍需要进一步验证,以确认其在5年或更长时间内的疗效和安全性。
最后,虽然本研究是多中心、随机对照的设计,具有较高的证据水平,但仍需考虑不同地区和人群的差异,进一步的全球性研究有助于更加广泛地评估腹腔镜手术的普适性。总体而言,LASRE研究为腹腔镜手术在低位直肠癌治疗中的应用提供了有力的证据,表明其在肿瘤学预后上至少不逊色于开放手术,且其在创伤小、恢复快、住院时间短等方面的优势也使其成为患者的理想选择。随着技术的不断进步,未来可能推动腹腔镜手术在低位直肠癌中的广泛应用,但其技术要求、长期疗效和不同患者群体的适用性仍需进一步关注。
改良FOLFOXIRI加西妥昔单抗与贝伐珠单抗治疗RAS野生型转移性结直肠癌:随机Ⅱ期DEEPER试验[4]
FOLFOXIRI(氟尿嘧啶、亚叶酸钙、奥沙利铂和伊立替康)联合抗EGFR单克隆抗体西妥昔单抗在转移性结直肠癌(mCRC)中的临床意义仍存在争议。该研究报告了一项随机Ⅱ期DEEPER试验(UMIN000018217,jRCTs061180022)的结果,旨在验证改良型(m)FOLFOXIRI联合单周西妥昔单抗相较于联合贝伐珠单抗在RAS野生型(wt)mCRC患者中的优势。研究的主要终点是缓解深度(DpR)。次要终点包括客观缓解率(ORR)、第8周时的早期肿瘤退缩(ETS)、无进展生存期(PFS)、总生存期(OS)、肿瘤生长时间(TTG)、治疗失败时间(TTF)、肿瘤缩小与预后的关联、TTG与预后的关联、R0切除率和安全性。
在纳入的359例RAS wt mCRC患者中,西妥昔单抗组的中位DpR显著优于贝伐珠单抗组(57.3% vs 46.0%,P = 0.0029)(表1);然而,ORR、ETS、R0切除率、TTG、TTF、PFS和OS在两个治疗组之间相似。两组中,DpR与生存时间之间存在弱关联。TTG与OS之间的相关性在西妥昔单抗组略强。事后探索性分析显示,在左半RAS/BRAF wt患者中,西妥昔单抗组的PFS(15.3个月 vs 11.7个月;HR=0.68)和OS(53.6个月 vs 40.2个月;HR=0.54)均更优。
表1:肿瘤缓解
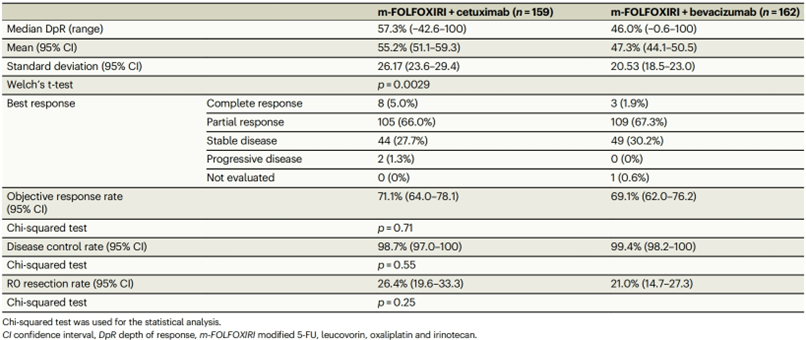
mFOLFOXIRI联合西妥昔单抗对RAS wt mCRC的肿瘤退缩具有临床益处。左半RAS/BRAF wt mCRC的生存获益需要进一步探索。
初始不可切的结直肠肝转移的一线系统治疗:CAIRO5 随机临床试验的事后分析[5]
对于伴有不可切除的单纯肝转移的结直肠癌患者(CRLM),FOLFOXIRI联合贝伐珠单抗相比FOLFOX/ FOLFIRI联合贝伐珠单抗,提升了无进展生存期、缓解率和R0/R1切除/消融率。但同时FOLFOXIRI联合贝伐珠单抗对于RAS/BRAF V600E突变和/或右半肿瘤患者也增加了毒性。对于左半RAS/BRAF V600E野生型的患者,FOLFOX/FOLFIRI联合帕尼单抗与FOLFOX/FOLFIRI联合贝伐珠单抗相比,提高了缓解率,但也伴随更多的毒性。
随机Ⅲ期CAIRO5试验呈现了以下两项比较的的远期预后:FOLFOXIRI联合贝伐珠单抗 vs FOLFOX/ FOLFIRI联合贝伐珠单抗,以及FOLFOX/FOLFIRI联合帕尼单抗 vs FOLFOX/FOLFIRI联合贝伐珠单抗。CAIRO5试验纳入的人群来源于2014年11月至2022年1月期间在荷兰的46个中心和比利时的1个中心招募的初始不可切除的CRLM患者。这些患者均经过肝脏专家小组反复评估了可切除性。RAS/BRAF V600E突变和/或右半肿瘤患者随机接受FOLFOX/FOLFIRI联合贝伐珠单抗(组1)或FOLFOXIRI联合贝伐珠单抗(组2)治疗,而左半RAS/BRAF V600E野生型患者接受FOLFOX/FOLFIRI联合贝伐珠单抗(组3)或FOLFOX/FOLFIRI联合帕尼单抗(组4)治疗。建议但不强制在根治性局部治疗后进行辅助化疗(ACT)。总生存期(OS)作为该研究的次要终点进行分析。其他结果通过事后分析得出。
共530例患者[327例男性(62%)和203例女性(38%);中位年龄62岁(四分位数范围54~69岁)]被随机分配入组:组1包含148例患者,组2包含146例患者,组3包含118例患者,组4包含118例患者。组1患者的中位OS为23.6个月(95% CI,20.1~27.5个月),组2为24.1个月(95% CI,21.0~30.9个月)(HR=0.90;95% CI,0.70~1.17;P = 0.44);组3患者的中位OS为39.9个月(95% CI,30.7~44.6个月),组4为38.3个月(95% CI,35.3~51.3个月)(HR=0.95;95% CI,0.68~1.32;P= 0.75)。接受根治性局部治疗且无早期(≤6个月)复发的患者的OS最长(64.3个月;95% CI,57.6个月~NR),接下来是早期复发后接受挽救性局部治疗的患者(58.9个月;95% CI,47.3个月~NR),然后是早期复发后未进行挽救性局部治疗的患者(30.5个月;95% CI,24.4~33.4个月)和接受非根治性局部治疗的患者(28.7个月;95% CI,25.9~38.3个月),持续不可切除的患者OS最差(18.3个月;95% CI,15.7~20.0个月)(图4)。在修正混杂因素后,ACT与更长的OS(HR=0.66;95% CI,0.44~0.98)和无复发生存期(HR=0.65;95% CI,0.48~0.88)相关。在没有挽救性局部治疗的情况下,接受了ACT的患者早期复发的风险更低(比值比=0.46;95% CI,0.25~0.85)。
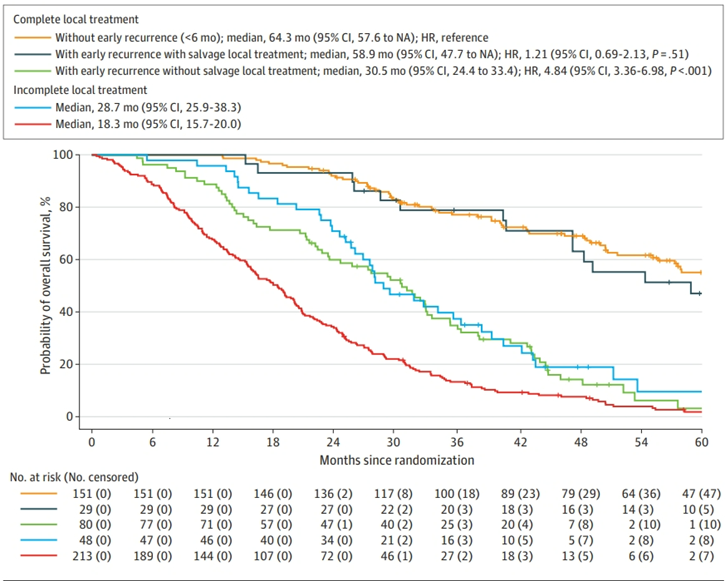
接受肝脏根治性局部治疗并在早期复发时进行挽救性局部治疗的患者具有最长的OS。对于这些患者,ACT可能值得考虑。该研究观察到ACT对于总生存期和无复发生存期具有显著益处。据报道这是第一项评估ACT疗效并在初始不可切除CRLM患者队列中评价获益的研究。(ClinicalTrials.gov NCT02162563)
本期看点:
1、一项随机Ⅲ期研究(CheckMate 8HW),结果显示对于在未接受过系统治疗的MSI-H或dMMR转移性结直肠癌患者,接受纳武利尤单抗联合伊匹木单抗治疗的无进展生存期优于接受化疗(联合/不联合靶向治疗)。
2、一项随机Ⅱ期非比较研究(IMPROVE),结果提示FOLFIRI联合帕尼单抗诱导治疗后的间歇方案是可行的,该研究达到主要终点的同时减轻了毒性,使患者获得更多的非治疗时间。
3、一项国内开展的多中心、随机对照、非劣效研究(LASRE),评估腹腔镜手术与开放手术治疗低位直肠癌的3年生存结果,结果显示由经验丰富的外科医生实施的腹腔镜手术在3年无病生存率方面不劣于开放手术,该结果支持使用腹腔镜手术治疗低位直肠癌。
4、一项随机Ⅱ期研究(DEEPER),结果提示在RAS野生型mCRC患者中,与mFOLFOXIRI联合贝伐珠单抗相比,接受mFOLFOXIRI联合西妥昔单抗作为初始治疗可显著提高DpR,且安全性可控,两组之间的生存获益相似。
5、一项随机Ⅲ期研究(CAIRO5)的事后分析,关注了不同情况下接受局部治疗的总生存获益以及辅助化疗对总生存的影响。结果提示接受肝脏根治性局部治疗并在早期复发时进行挽救性局部治疗的患者具有最长的OS。对于这些患者,ACT可能值得考虑。
[1] ANDRE T, ELEZ E, VAN CUTSEM E, et al. Nivolumab plus Ipilimumab in Microsatellite-Instability-High Metastatic Colorectal Cancer. N Engl J Med. 2024 Nov 28;391(21):2014-2026.
[2] AVALLONE A, GIULIANI F, DE STEFANO A, et al. Intermittent or Continuous Panitumumab Plus Fluorouracil, Leucovorin, and Irinotecan for First-Line Treatment of RAS and BRAF Wild-Type Metastatic Colorectal Cancer: The IMPROVE Trial. J Clin Oncol. 2024 Nov 22:JCO2400979.
[3] JIANG W, XU J, CUI M, et al. LASRE trial investigators. Laparoscopy-assisted versus open surgery for low rectal cancer (LASRE): 3-year survival outcomes of a multicentre, randomised, controlled, non-inferiority trial. Lancet Gastroenterol Hepatol. 2024 Nov 8:S2468-1253(24)00273-5.
[4] SHIOZAWA M, SUNAKAWA Y, WATANABE T, et al. Modified FOLFOXIRI plus cetuximab versus bevacizumab in RAS wild-type metastatic colorectal cancer: a randomized phase II DEEPER trial. Nat Commun. 2024 Nov 25;15(1):10217.
[5] BOND MJG, BOLHUIS K, LOOSVELD OJL, et al. Dutch Colorectal Cancer Group. First-Line Systemic Treatment for Initially Unresectable Colorectal Liver Metastases: Post Hoc Analysis of the CAIRO5 Randomized Clinical Trial. JAMA Oncol. 2024 Nov 21:e245174.
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


