小细胞肺癌约占所有肺癌病例的13-17%,5年生存率仅有7%,作为预后最差的肺癌类型,小细胞肺癌的治疗进展一直乏善可陈,直至进入免疫治疗时代,小细胞肺癌的治疗有了些许突破。目前已经有多款PD-1/PD-L1抑制剂获批临床应用。【肿瘤资讯】盘点目前已经获得批准的一线治疗策略,并简单讨论该领域目前存在的问题。
PD-L1抑制剂
阿替利珠单抗——IMpower133研究
针对PD-L1的免疫检查点抑制剂是最早获批应用于小细胞肺癌领域的药物。IMpower133研究率先探索了阿替利珠单抗一线治疗广泛期小细胞肺癌患者的疗效及安全性。这项随机、双盲、安慰剂对照III期临床研究纳入初治广泛期小细胞肺癌患者,符合入组标准的患者按照1:1比例随机分配接受单纯化疗或在联合阿替利珠单抗治疗。主要研究终点为研究者评估的无进展生存期(PFS)及总生存期(OS)。
首次数据分析时,两组中位OS分别为12.3个月和10.3个月,HR=0.70,P=0.007,1年OS率分别为51.7%和38.2%,中位PFS分别为5.2个月和4.3个月,HR=0.77,P=0.02。免疫维持治疗开始,两组的中位OS分别为12.5个月和8.4个月,HR=0.59,中位PFS分别为2.6个月和1.8个月,HR=0.63。两组3-4级不良事件分别为56.5%和56.1%。
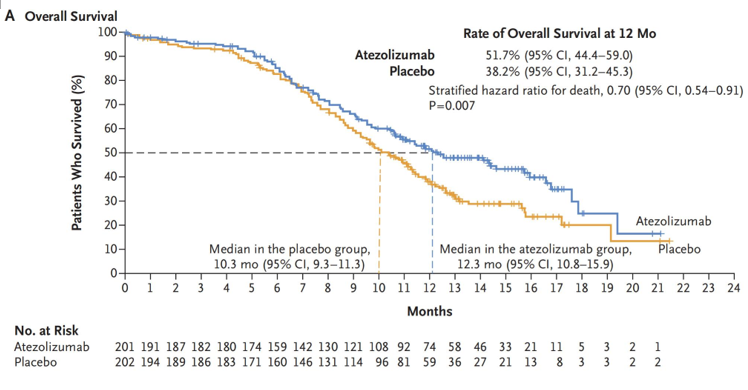 OS结果
OS结果
经过中位22.9个月随访后的数据显示,两组中位OS分别为12.3个月和10.3个月,P=0.015,18个月OS率分别为34%和21%。
患者获益和PD-L1表达水平、TMB水平无关。TMB<10的患者,两组中位OS分别为11.8个月和9.4个月,HR=0.73;TMB≥10的患者,两组中位OS分别为14.9个月和11.2个月,HR=0.73。PD-L1≥5%的患者,两组中位OS分别为21.6个月和9.2个月,HR=0.60;PD-L1<5%的患者,两组中位OS分别为9.2个月和8.9个月,HR=0.77。
度伐利尤单抗——CASPIAN研究
CASPIAN研究奠定了第2款针对PD-L1的免疫检查点抑制剂在广泛期小细胞肺癌患者中的应用。这项开放标签、III期、多中心临床研究,纳入初治广泛期小细胞肺癌患者,随后按1:1:1比例随机分配接受单免疫(度伐利尤单抗的治疗剂量为1500 mg,Q4W)、双免疫(度伐利尤单抗联合替西木单抗75mg,Q4W)以及单纯化疗。主要终点为单免疫、双免疫和化疗的OS。
首次分析数据发表于Lancet杂志。结果显示,单免疫组的中位OS为13.0个月,优于单纯化疗组的10.3个月,HR=0.73,P=0.0047;两组12个月的OS率分别为54%和40%,18个月OS率为34%和25%。单免疫组的中位PFS为5.1个月,单纯化疗组为5.4个月,两组12个月的PFS率分别为18%和5%,两组ORR分别为58%和68%。两组3级及以上不良事件发生率均为62%。基于该研究结果,度伐利尤单抗顺利获批广泛期小细胞肺癌的一线治疗适应症。
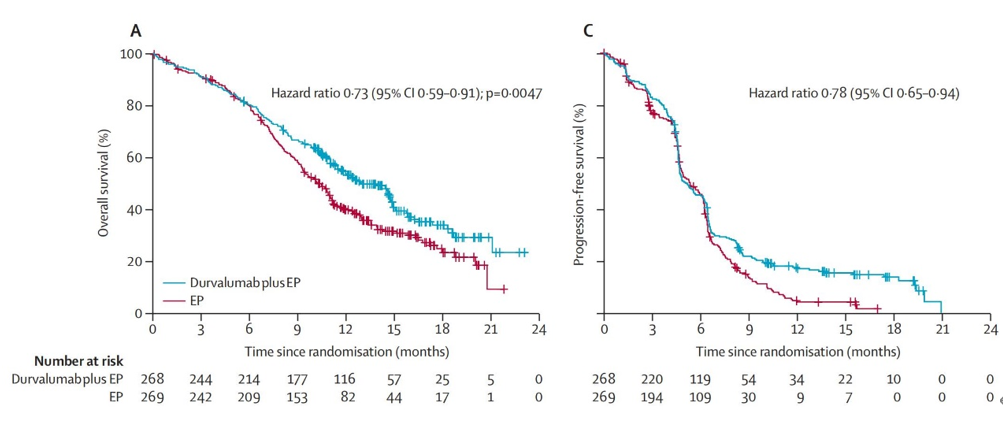
CASPIAN研究的第2次数据更新发表于Lancet Oncology。本次更新一方面确认了度伐利尤单抗联合化疗的获益,另一方面首次公布了双免疫组的疗效数据。结果显示,在度伐利尤单抗治疗的基础上进一步联合替西木单抗并不优于单纯化疗。两组中位OS分别为10.4个月和10.5个月,HR=0.82。单免疫组相较于单纯化疗组,仍然显示持续的OS获益,且与首次更新的数据类似。两组中位OS分别为12.9个月和10.5个月,HR=0.75。
双免疫联合化疗相较于单纯化疗展现出数值上的获益,两组中位OS分别为10.4个月和(双免疫)10.5个月(单纯化疗),HR=0.81,P=0.02,36个月,OS率分别为15.3%和5.8%。三组分别有32%、47%和36%的患者出现严重不良反应,较上次新增6例严重不良反应,其中,单免疫和双免疫组分别有1例和5例,三组分别有5%、11%和6%的患者因全因不良反应导致死亡事件的出现。
阿得贝利单抗——CAPSTONE-1研究
CAPSTONE-1研究是一项多中心、随机、双盲、安慰剂对照的III期临床研究,探索了阿得贝利单抗联合化疗一线治疗广泛期小细胞肺癌患者的疗效及安全性。
结果显示,联合阿得贝利单抗组和单纯化疗组的中位OS分别为15.3个月和12.8个月,HR=0.72,P=0.0017,2年OS率分别为31.3%和17.2%;中位PFS分别为5.8个月和5.6个月,12个月的PFS率分别为19.7%和5.9%,两组ORR分别为70.4%和65.9%,中位缓解持续时间分别为5.6个月和4.6个月。两组分别有100%和99%的患者出现全因任何级别不良反应。其中,3级及以上治疗相关不良反应发生率分别为86%和85%。

研究发现,在标准化疗的基础上联合阿得贝利单抗可以为广泛期小细胞肺癌患者带来OS的改善,安全性可管理,并顺利获得适应症。
PD-1抑制剂
帕博利珠单抗——KEYNOTE-604研究
KEYNOTE-604研究探索了帕博利珠单抗联合化疗一线治疗广泛期小细胞肺癌的疗效及安全性,也是第一款在小细胞肺癌领域进行一线III期随机对照临床研究的药物。遗憾的是,由于该研究统计分析策略不恰当,导致错失OS阳性结果。最终,帕博利珠单抗未能获得一线批准。研究中,符合入组标准的患者随机分为含铂双药治疗或在此基础上进一步联合帕博利珠单抗,治疗上限为35周期。4周期后评估为CR或PR的患者,允许接受预防性脑照射治疗。研究基于含铂药物选择、基线PS评分及LDH水平进行分层。主要研究终点为PFS及OS。
数据显示,全组中位随访时间为21.6个月,联合帕博利珠单抗组和单纯化疗组的中位PFS分别为4.5个月和4.3个月,12个月PFS率分别为13.6%和3.1%。第二次中期分析时,联合帕博利珠单抗仍然延长PFS,HR=0.75,P=0.0023,中位OS分别为10.8个月和9.7个月,24个月OS率分别为22.5%和11.2%,HR=0.80,P=0.0164,P值大于其预设显著性水准而错失了阳性结果。两组ORR分别为70.6%和61.8%,中位DOR分别为4.2个月和3.7个月,两组3级及以上不良反应发生率分别为76.7%和74.9%,并分别导致14.8%和6.3%的患者因不良反应导致治疗终止,分别有6.3%和5.4%的患者因不良反应导致死亡事件出现。
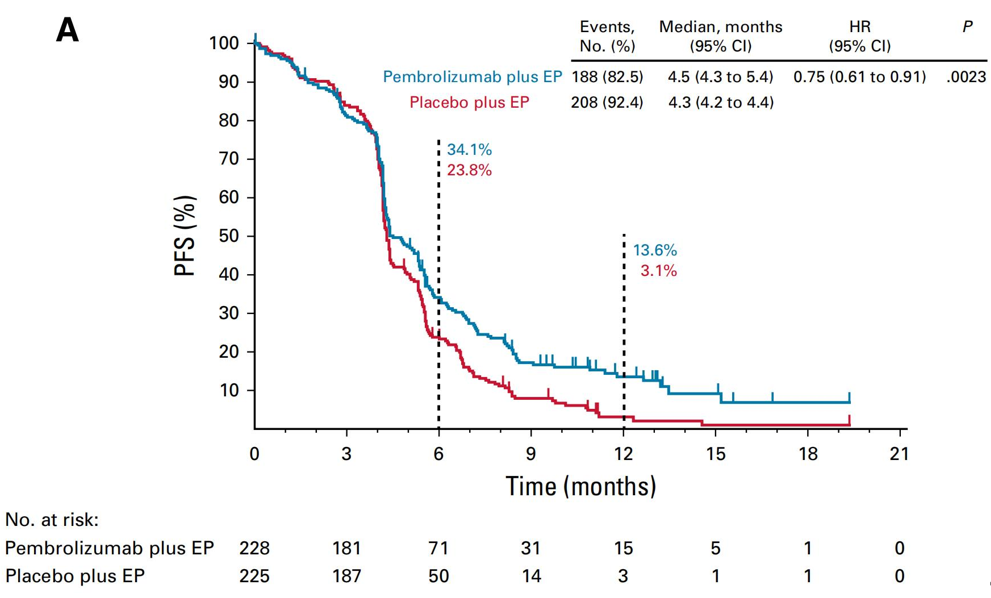 PFS结果
PFS结果
由于错失OS这一关键阳性终点,最终,帕博利珠单抗未能获批一线治疗适应症。
斯鲁利单抗——ASTRUM-005研究
基于ASTRUM-005研究,斯鲁利单抗是第一款获批在小细胞肺癌一线治疗领域应用的PD-1抑制剂。这项国际、多中心、III期、双盲、安慰剂对照的临床研究,纳入组织病理学或细胞病理学确认的初治广泛期小细胞肺癌患者。符合入组标准的患者接受标准剂量含铂双药治疗联合斯鲁利单抗4.5mg/kg或安慰剂治疗。患者每6周进行一次疗效评估。本研究主要终点为OS。
数据发现,免疫治疗组和安慰剂组的中位OS分别为15.4个月和10.9个月,HR=0.63,P<0.001,两组2年OS率分别为43.1%和7.9%。两组中位PFS分别为5.7个月和4.3个月,HR=0.48,两组ORR分别为80.2%和70.4%,中位DOR分别为5.6个月和3.2个月。未观察到PD-L1表达水平与患者获益有关。PD-L1≤1%的患者,两组中位OS分别为15.0个月和10.5个月,HR=0.58;PD-L1≥1%的患者,两组中位OS分别为未达到和12.9个月,HR=0.92,但交互性检验并未发现不同亚组之间存在有差异。3级及以上不良反应发生率分别为82.5%和80.1%。治疗相关不良反应发生率分别为69.9%和56.1%,其中3级及以上治疗相关不良反应发生率分别为33.2%和27.6%。
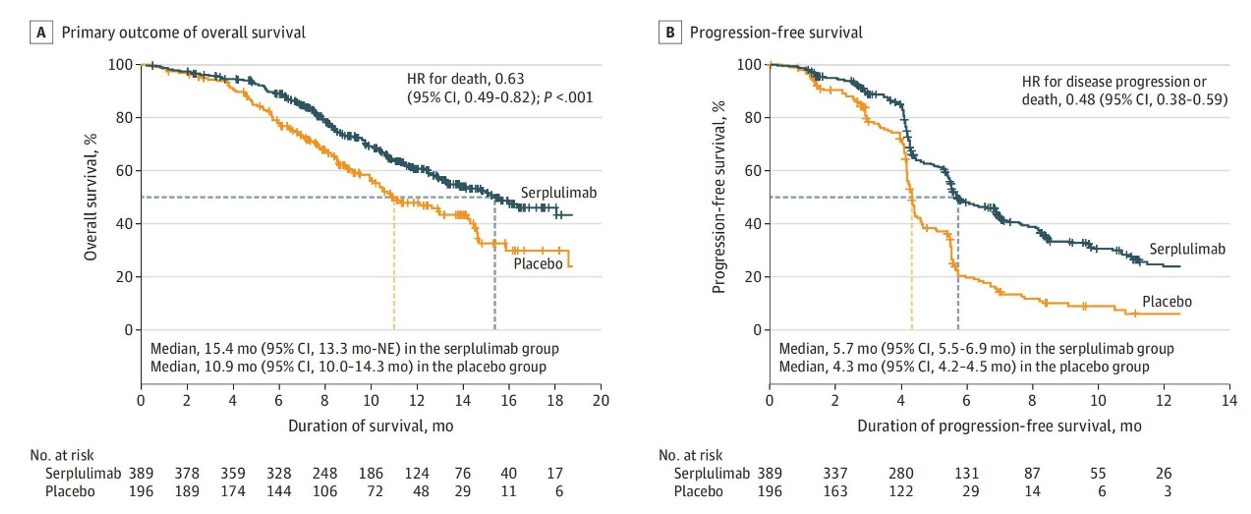
基于这项研究结果,斯鲁利单抗成为全球首款获批一线应用于小细胞肺癌领域二代PD-1抑制剂。
替雷利珠单抗——RATIONALE-312研究
替雷利珠单抗是一款针对PD-1的免疫检查点抑制剂,RATIONALE-312研究探索了在标准化疗基础上进一步联合替雷利珠单抗一线治疗广泛期小细胞肺癌患者的疗效及安全性。
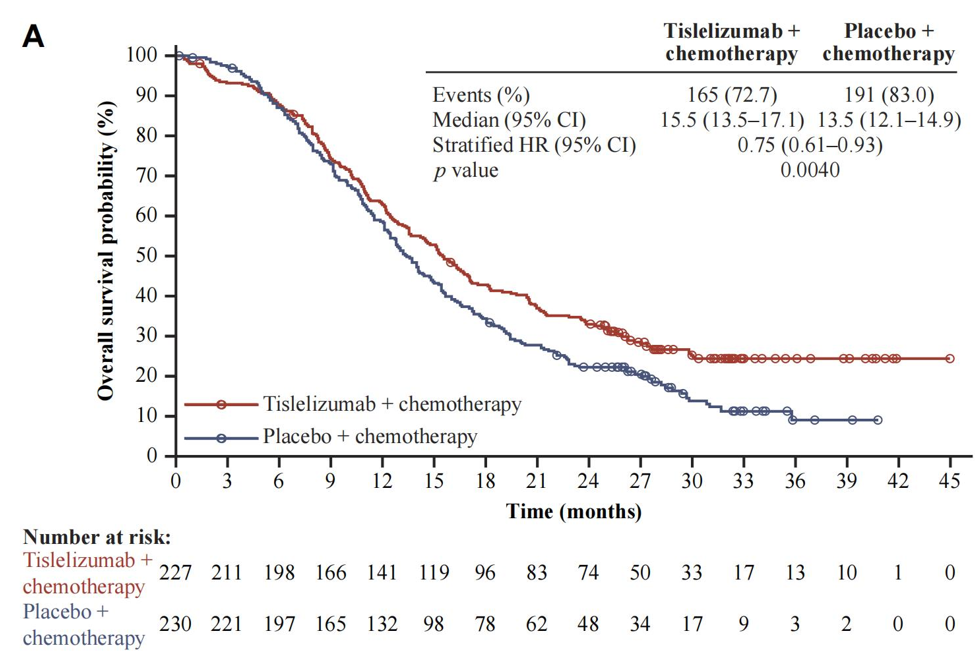
替雷利珠单抗组和安慰剂组分别入组227例和230例患者,两组患者基线特点均衡可比,中位随访时间14.2个月。数据发现,联合免疫治疗组和单纯化疗组,中位OS分别为15.5个月和13.5个月,HR=0.75,P=0.0040;中位PFS分别为4.7个月和4.3个月,HR=0.64,P<0.0001,3级及以上治疗相关不良反应发生率均为86%。两组1年OS率分别为63%和58%,2年OS率分别为33%和22%,3年OS率分别为25%和9%;6个月PFS率分别为35%和18%,12个月PFS率分别为21%和5%。
特瑞普利单抗——EXTENTORCH研究
特瑞普利单抗联合化疗一线治疗广泛期小细胞肺癌的多中心、随机对照临床研究,纳入广泛期初治小细胞肺癌患者,符合入组标准的患者按1:1比例随机分为特瑞普利单抗240mg或安慰剂联合4~6周期含铂双药治疗。主要研究终点为研究者评估的PFS和OS。
最终,两组分别入组223例和219例患者,中位随访时间13.7个月,中位PFS分别为5.8个月和5.6个月,HR=0.67,P<0.001,6个月PFS率分别为47.1%和36.3%,12个月PFS率分别为18.1%和4.9%。最终分析时,两组中位OS分别为14.6个月和13.3个月,HR=0.80,P=0.03,1年OS率分别为63.1%和54.9%,2年OS率分别为25.9%和19.5%,3级及以上全因不良反应发生率分别为89.6%和89.4%。
四药组合——ETER701研究
ETER701研究是第一项探索四药,即PD-L1联合血管靶向及化疗一线治疗广泛期小细胞肺癌患者的疗效及安全性的III期临床研究。这是一项多中心、双盲、随机对照研究。符合入组标准的患者分别接受含铂双药治疗(双药)或在此基础上联合安罗替尼(三药)或进一步联合针对PD-L1的免疫检查点抑制剂贝莫苏拜单抗治疗(四药),主要研究终点为PFS和OS。
最终4药组、3药组和两药组分别入组246例,245例和247例患者。四药组和两药组的中位OS分别为19.3个月和11.9个月,HR=0.61,P=0.0002,3药组和2药的中位 OS分别为13.3个月和11.9个月,HR=0.86,P=0.1723,3级及以上治疗相关不良反应发生率分别为93.1%、94.3%和87.0%。
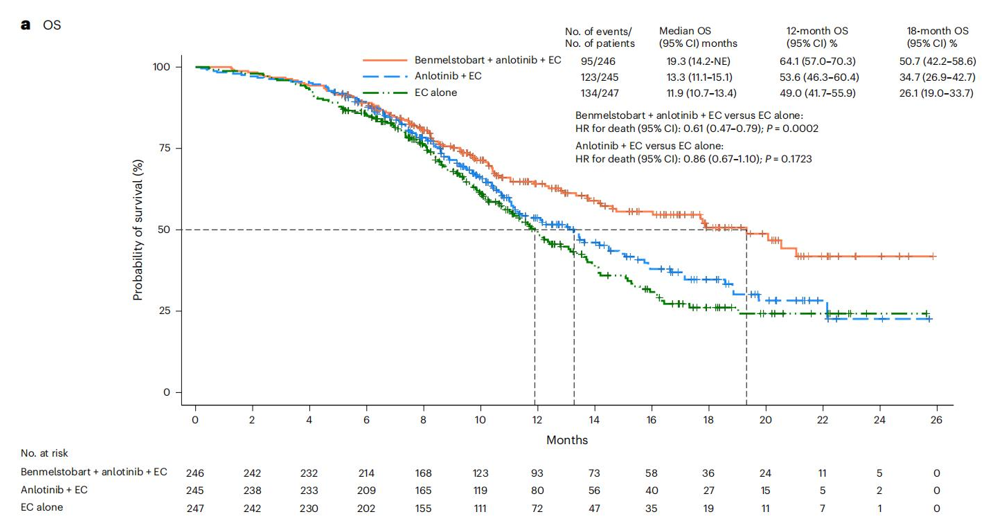
基于这项研究结果,四药组合获NMPA批准一线治疗广泛期小细胞肺癌的适应症。
思考
随着相关临床研究结果的公布,广泛期小细胞肺癌患者的一线治疗迎来越来越多的治疗选择。但是,该领域也存在许多尚待解决的问题:首先,获益有限。无论是PD-1还是PD-L1,免疫检查点抑制剂的加入只是给患者带来轻度获益,总体OS的改善时间在3-5个月左右,中位OS尚未突破2年,这与非小细胞肺癌形成鲜明的对比;其次,同质化竞争严重。从临床数据看,获批的免疫检查点抑制剂,疗效相差不太,虽然从间接比较的数据看,PD-1的疗效似乎略胜一筹,但目前尚无数据直接比较PD-1和PD-L1的疗效。第三,没有合适的标志物富集患者。免疫检查点抑制剂的加入使长期获益的患者比例明显增加。但是,在非小细胞肺癌中,未发现PD-L1表达水平与患者疗效的相关性。因此,发现有效的标志物并富集患者需要进一步研究。
[1]DOI:10.1056/NEJMoa1809064
[2]DOI:10.1016/S0140-6736(19)32222-6
[3]DOI:10.1016/S1470-2045(22)00224-8
[4]DOI:10. 1200/JCO.20.00793
[5]DOI:10.1001/jama.2022.16464
[6]DOI:10.1016/j.jtho.2024.03.008
[7]DOI:10.1001/jamaoncol.2024.5019
[8]DOI:10.1038/s41591-024-03132-1
排版编辑:肿瘤资讯-Yuno











 苏公网安备32059002004080号
苏公网安备32059002004080号


