时光交错,岁月鎏金,在精准医疗的浪潮中,HER2突变NSCLC的治疗策略逐渐从模糊变得清晰。2024年,HER2突变非小细胞肺癌(NSCLC)开启治疗新篇章,新机制及新治疗策略的研究如雨后春笋般涌现,捷报频传,HER2突变NSCLC患者正迎来更多生存希望。值此岁末,我们特邀中国医学科学院肿瘤医院的王志杰教授为我们进行2024年HER2突变NSCLC治疗盘点,共同回顾那些激动与鼓舞人心的研究进展。
北京协和医学院博士生导师
教育部“长江学者”特聘教授
国家高层次人才特支计划拔尖人才
主要研究方向为肺癌的精准诊治及转化研究
以通讯/第一作者(含共同)发表SCI论文30余篇,包括Lancet resp med、JCO、JAMA Oncol、Nat Commun、Sci Adv、PNAS等杂志
国家肿瘤质控中心肺癌质控专家委员会组员
国际肺癌研究协会(IASLC)全球多学科实践标准委员会委员
CSCO理事、CSCO非小细胞肺癌专家委员会常委
中国初级卫生保健基金会胸部肿瘤精准治疗专业委员会副主任委员
中国人体健康科技促进会肿瘤化疗专委会副主任委员
中国老年保健协会肺癌专委会副主任委员
获国家科技进步奖二等奖,教育部“高等学校科技进步奖”一等奖,第八届树兰医学青年奖等
人表皮生长因子受体2(HER2)突变是NSCLC的关键致癌驱动基因突变之一[1],在NSCLC中的发生率约为2%-4%[2]。2024年CHAPTER研究通过对23321例NSCLC样本进行分析,显示中国NSCLC患者人群中HER2突变率为3.8%[3]。其中HER2突变的主要位置是酪氨酸激酶结构域(TKD,占85%),其次是胞外结构域(ECD,占11%)和跨膜结构域(TMD,占3%)(图1)[3]。HER2突变中外显子20插入最为常见,其中Y772_A775dup (YVMA)插入占HER2突变的75%[4-5]。
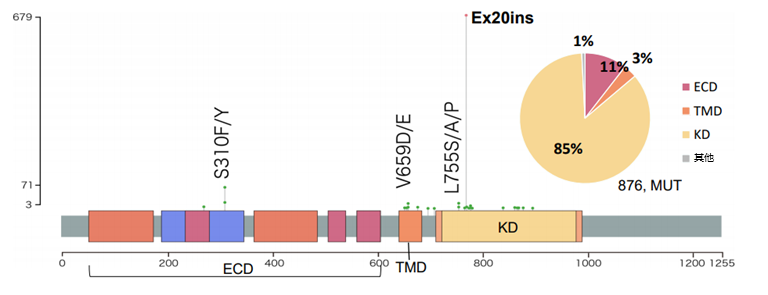
随着近年来精准医疗的深入人心,HER2基因检测规范化的进程正在不断推进。2022年、2023年接连发表《非小细胞肺癌HER2基因突变检测的共识》[6]和《非小细胞肺癌HER2基因变异临床诊疗实践中国专家共识》[7],强调了HER2检测的重要性,建议使用二代测序(NGS)进行基因检测,并推荐HER2突变与EGFR、ALK、ROS1、NTRK等驱动基因同时检测[7]。
治疗策略方面,酪氨酸激酶抑制剂(TKI)和抗体药物偶联物(ADC)类药物开始在HER2突变NSCLC中发光发热。目前2024年第11版《NCCN肿瘤临床实践指南:非小细胞肺癌》(以下简称《NCCN指南》)[8]和《CSCO非小细胞肺癌诊疗指南(2024)》(以下简称《CSCO指南》)[9]均建议HER2突变患者一线治疗参照无驱动基因治疗策略。对于后线治疗选择,《NCCN指南》推荐使用德曲妥珠单抗和恩美曲妥珠单抗[8],《CSCO指南》推荐使用德曲妥珠单抗(II级推荐),吡咯替尼(III级推荐)[9]。
旭日始旦:新型TKI迸发新生机
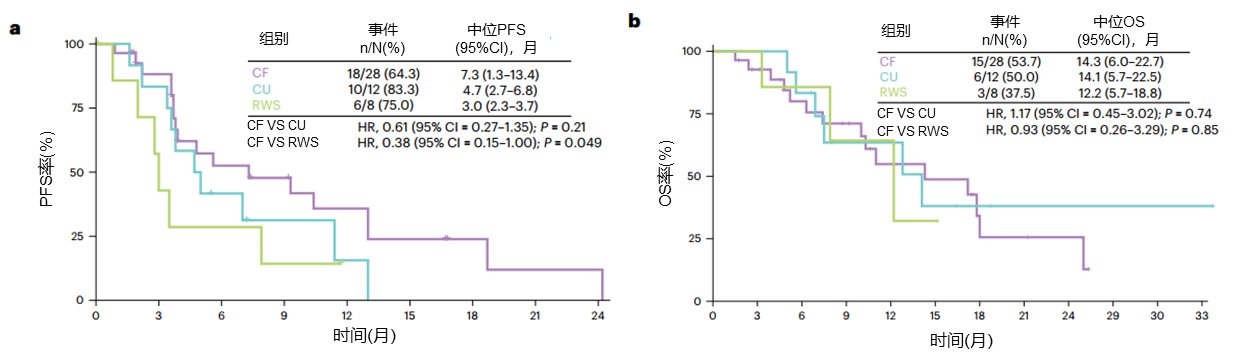
作为《CSCO指南》中推荐的HER2突变NSCLC后线治疗药物[9],口服泛HER TKI吡咯替尼,可通过不可逆地抑制HER受体家族成员HER1(EGFR)、HER2和HER4胞内区域的磷酸化,阻断下游信号通路,进而抑制肿瘤生长[10],目前国内已获批用于接受或未接受过抗HER2治疗HER2阳性复发或转移性乳腺癌患者[11]。吡咯替尼在晚期NSCLC患者II期伞式研究显示[12],符合标准(CF)组(n=28)接受吡咯替尼一线治疗的客观缓解率(ORR)为35.7%,疾病控制率(DCR)为89.3%、中位无进展生存期(PFS)为7.3个月;同情用药(CU)组(n=12)吡咯替尼一线治疗的ORR为16.7%,DCR为83.4%,中位PFS为4.7个月(图2),均优于接受医生选择的治疗方案组(RWS组)。最常见的不良事件(AE)是腹泻、皮疹、转氨酶升高等。在CU组腹泻发生率为91.7%,3-4级腹泻发生率为16.7%[12]。
2024年,以BAY 2927088和Zongertinib等为代表的新型选择性HER2 TKI开始展现出强大的治疗潜力。相比吡咯替尼,新型TKI对HER2突变型的选择性更高[5,13],同时在疗效和安全性方面呈现出良好前景。
BAY 2927088是一种口服、可逆性TKI,可强效靶向HER2和突变型EGFR(图3)[5]。BAY 2927088在HER2突变晚期NSCLC患者中显示出了令人鼓舞的初步抗肿瘤活性和可控的安全性。美国食品和药物管理局(FDA)、中国国家药品监督管理局(NMPA)均已授予BAY 2927088突破性治疗品种认证,用于既往经治的HER2激活突变的不可切除或转移性NSCLC患者[4]。
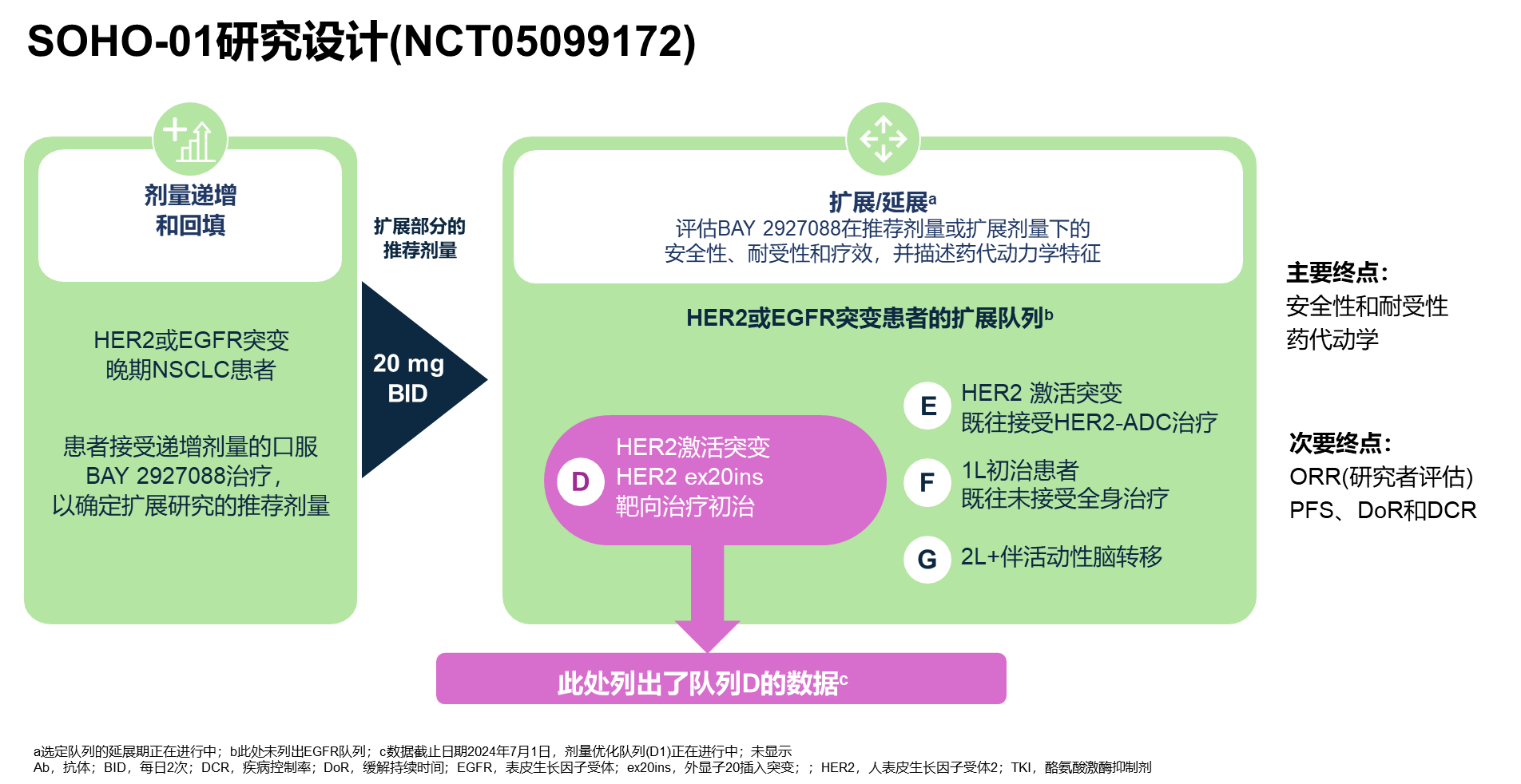
SOHO-01是一项开放标签、多中心的I/II期研究。在剂量递增和回填阶段确定了20mg、每日两次为推荐的剂量用于后续的扩展研究。在扩展/延展阶段,研究旨在评估BAY 2927088在推荐剂量或扩展剂量下的安全性、耐受性和疗效,并描述其药代动力学特性。在扩展阶段中,HER2突变患者被分为D、E、F和G四个队列;其中队列G纳入接受过至少二线治疗且伴活动性脑转移的患者。队列D旨在探究BAY 2927088在治疗HER2激活突变未接受过其他靶向治疗的NSCLC患者中的安全性和疗效,主要终点为安全性、耐受性和药代动力学,次要终点为研究者评估的ORR、PFS、缓解持续时间(DoR)和DCR(图4)。
2024年WCLC公布了队列D的研究结果,截至2024年7月1日,队列D共纳入44例患者。在43例疗效可评估患者中,ORR为72.1%,DCR为83.7%,中位DoR为8.7个月,中位PFS为7.5个月(图5)。
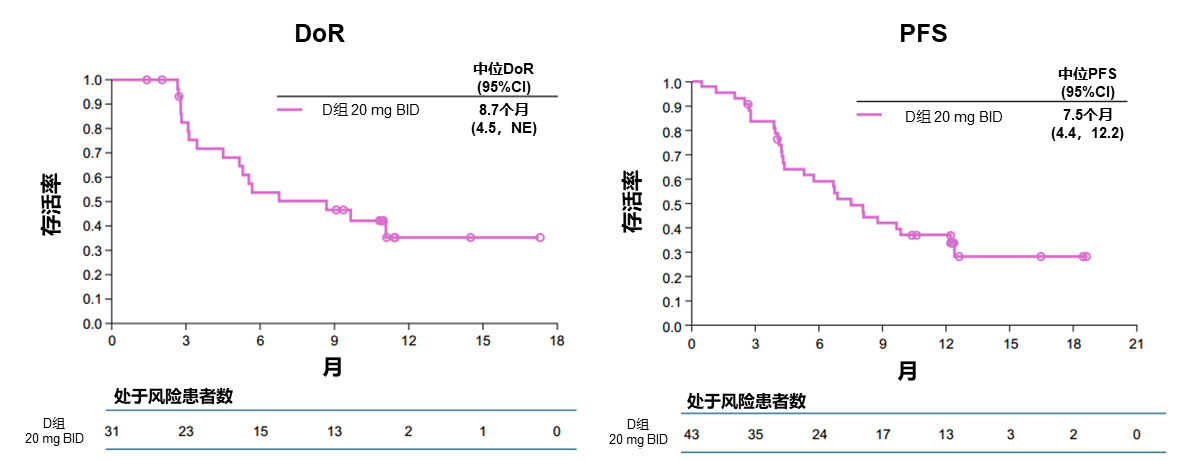
该研究入组患者中,HER2突变类型以YVMA插入突变为主,占70.5%,次之是其他插入突变(22.7%)和点突变(6.8%)。队列D 30例YVMA插入患者的ORR为90.0%,DCR为96.7%,中位DoR为9.7月,中位PFS为9.9个月。8例发生脑转移的患者的ORR为62.5%。BAY 2927088常见的治疗相关不良事件(TRAE)为腹泻、皮疹、甲沟炎等,无4级TRAE发生,无ILD/肺炎报告。BAY 2927088的安全性可管理,与既往报告一致。BAY 2927088治疗可使既往接受过治疗的HER2突变NSCLC患者产生快速、显著和持久的缓解[4]。
Zongertinib(Bl1810631)也是一种新型口服HER2 TKI,能够选择性地与野生型和突变型HER2受体的TKD共价结合,同时保留野生型EGFR的信号传导[13]。Beamion LUNG-1研究Ib期队列1纳入接受过≥1线含铂化疗但不包括接受ADC治疗的HER2 TKD突变的NSCLC患者,推荐剂量为120 mg或240 mg,每日一次,主要终点为独立中心审查根据RECIST v1.1标准确认的客观缓解。2024年WCLC公布了Ib期队列1研究数据结果,截至2024年5月23日,132例患者接受了Zongertinib治疗;中位疗效随访时间约为13周,接受120 mg治疗的所有患者(n=75)均达到了主要终点(经盲态独立中心确认的缓解),经确认的ORR为66.7%。DoR和PFS数据目前尚不成熟。根据研究者的评估,在94%的患者中观察到任何幅度的肿瘤缩小(图6)[13]。
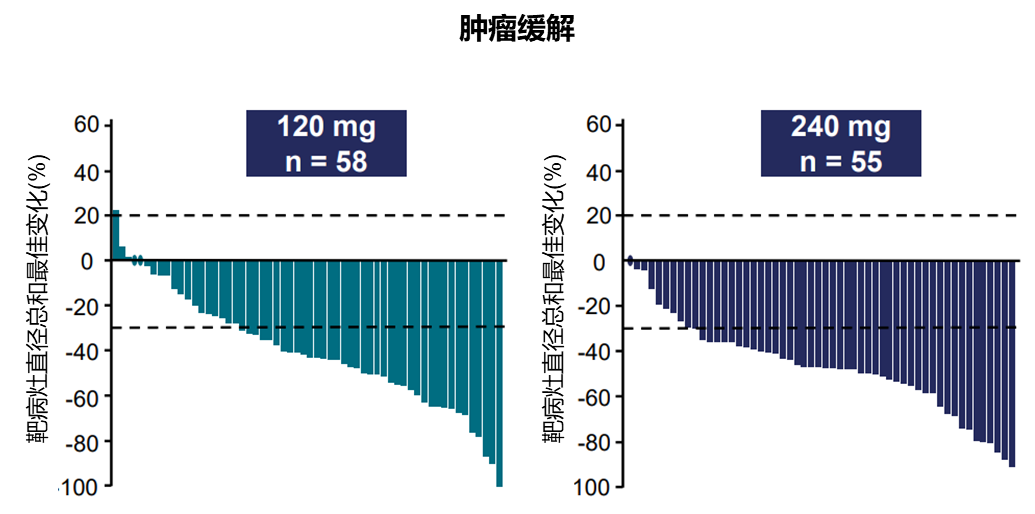
此次研究还公布了颅内缓解数据,120 mg组(n=27)经确认的ORR为33%,DCR为74%;240 mg组(n=25)经确认的ORR为40%,DCR为92%。Zongertinib显示出良好的安全性,大多数TRAE为轻度且可管理。常见的TRAE为腹泻、皮疹、转氨酶升高等,14例(11%)患者因AE导致剂量减少,4例患者(3%)因AE导致治疗终止[13]。
化疗联合免疫疗法或单独化疗等是目前CSCO指南中推荐HER2突变NSCLC患者参照的一线治疗方案,CHAPTER研究分析了2015年至2024年309例中国患者数据发现,这些治疗方案的真实世界无进展生存期(rwPFS)仅为6-9个月[3],患者生存期亟需进一步改善。新型TKI在后线治疗显示出喜人疗效的同时,一线的探索同样如火如荼。
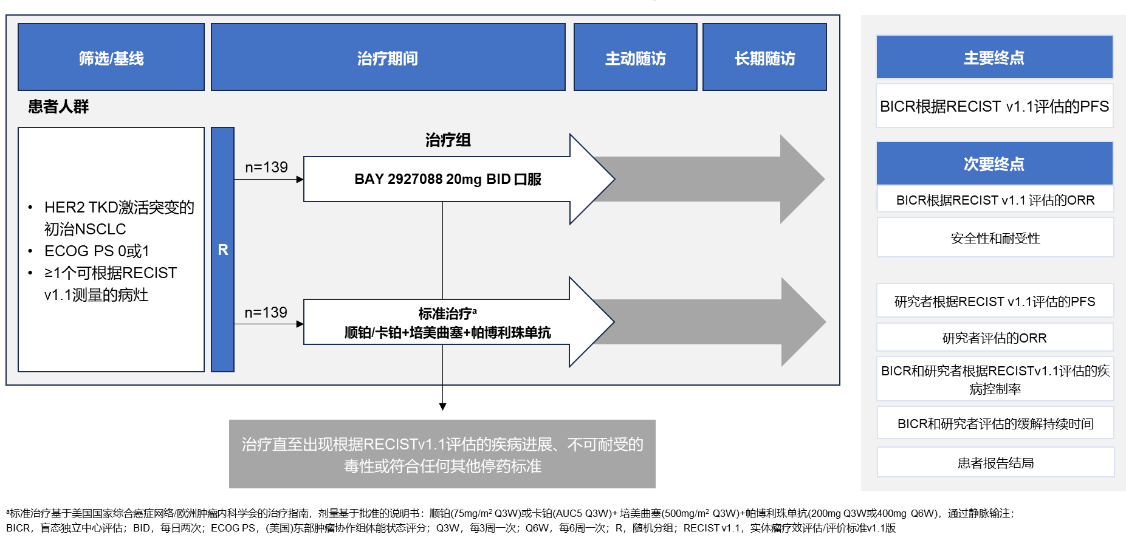
SOHO-02是一项III期、开放标签、随机、阳性对照、多中心试验,旨在评估既往未接受过全身治疗的HER2突变局部晚期或转移性NSCLC患者接受BAY 2927088和标准治疗(顺铂/卡铂+培美曲塞+帕博利珠单抗)的疗效和安全性,该研究目前处于全球入组阶段(图7)[5]。
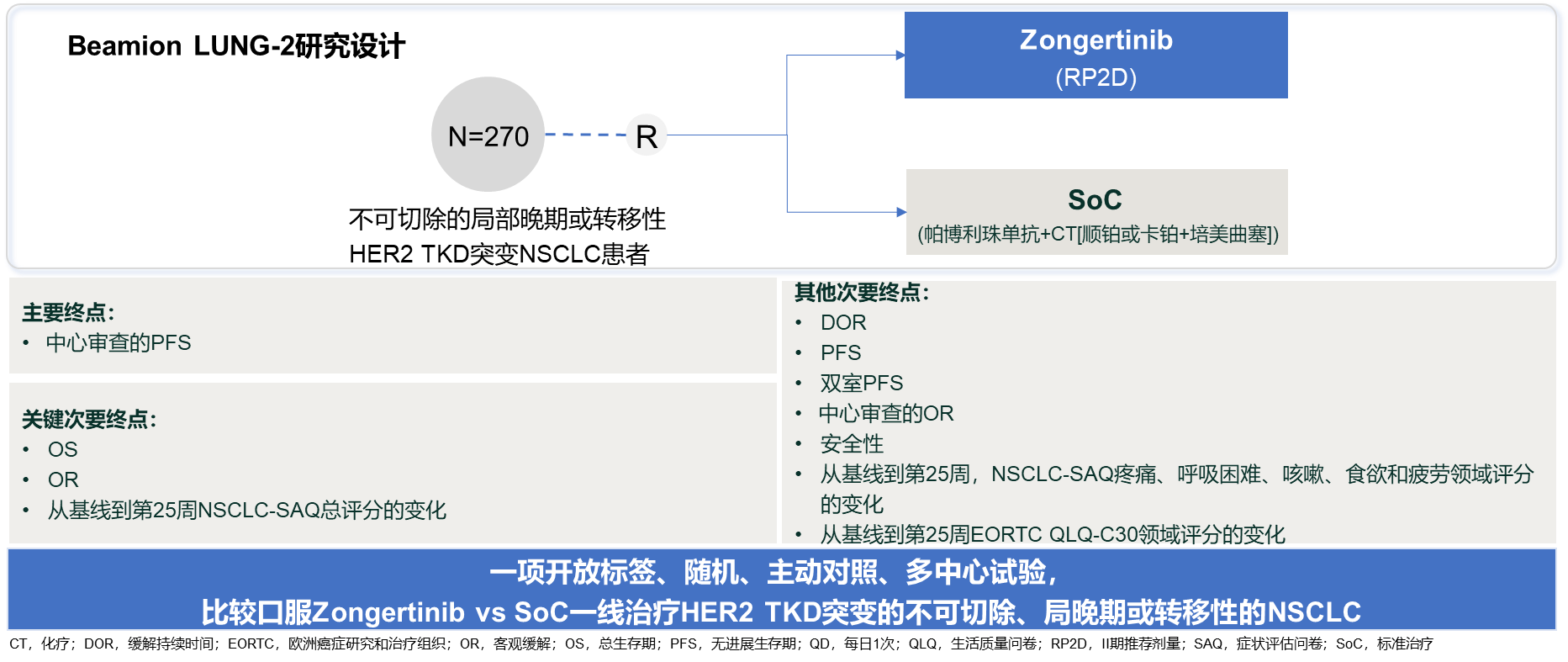
Beamion LUNG-2是一项比较Zongertinib与标准治疗(顺铂/卡铂+培美曲塞+帕博利珠单抗)一线治疗HER2突变晚期NSCLC患者的III期随机研究,目前正在入组中(图8)[14]。
新元肇启:HER2 ADC中国首获批
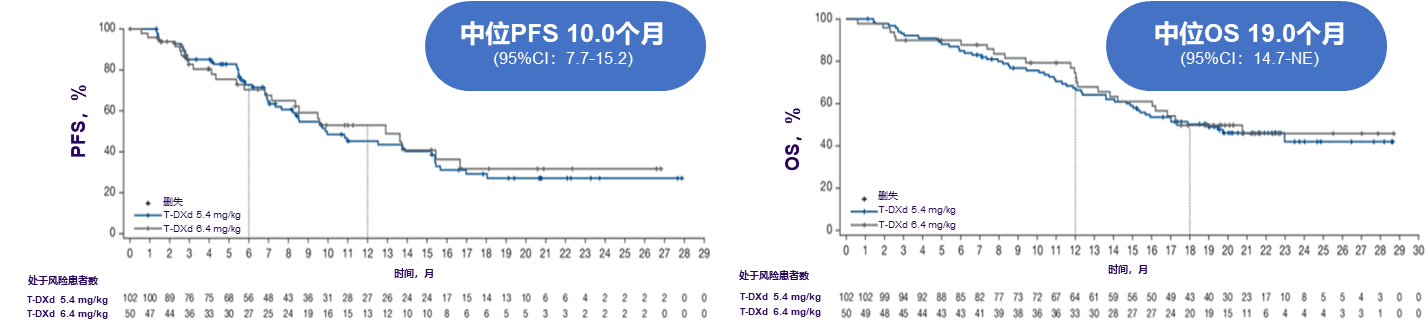
作为《NCCN指南》和《CSCO指南》一致推荐的HER2突变NSCLC后线治疗药物[8-9],德曲妥珠单抗(T-DXd,DS-8201)是一种HER2靶向ADC,已于2022年8月获得FDA的批准用于治疗HER2激活突变既往接受过全身治疗不可切除或转移性NSCLC成人患者[15],并于2024年10月获得NMPA批准用于治疗存在HER2激活突变且既往接受过至少一种全身治疗的不可切除的局部晚期或转移性NSCLC成人患者。DESTINY-Lung02研究是一项国际多中心、双盲、随机、非对照II期临床研究,旨在评估德曲妥珠单抗5.4 mg/kg和6.4 mg/kg两种剂量治疗既往经治HER2突变晚期NSCLC患者的疗效和安全性[16]。2024年美国临床肿瘤学会(ASCO)大会上公布的最终分析结果显示,5.4 mg/kg组ORR为50%,中位PFS为10.0个月,中位OS为19.0个月(图9)[16]。
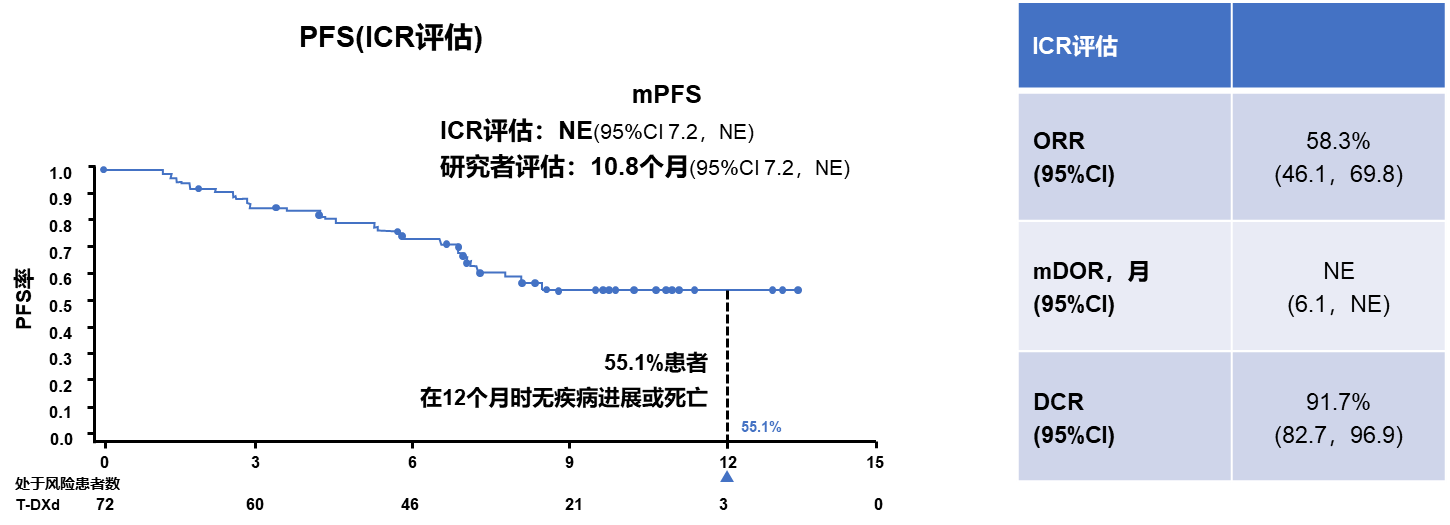
DESTINY-Lung05研究是DESTINY-Lung02在中国的桥接研究,其主要目的是评估德曲妥珠单抗在携带HER2外显子19或20突变、至少一线治疗期间或治疗后出现疾病进展的转移性NSCLC中国人群的疗效和安全性[17]。2024年美国癌症研究协会(AACR)大会上公布了最新研究结果,5.4 mg/kg组ORR为58.3%,中位PFS为10.8个月(图10)[17]。
方兴未艾:HER2治疗策略多元化
TKI和ADC联合用药为HER2突变NSCLC患者带来新的治疗希望。在HER2突变乳腺癌的研究中,TKI联合ADC治疗较单药治疗显示出更优的中位PFS获益[18]。这一发现为HER2突变NSCLC的治疗提供了新思路。临床研究数据表明,吡咯替尼联合阿帕替尼在晚期NSCLC患者中展现出显著疗效和良好的安全性特征[19]。目前,包括ADC联合免疫治疗在内的多项创新性研究正在进行中,有望为患者提供更多有效的治疗选择[20]。
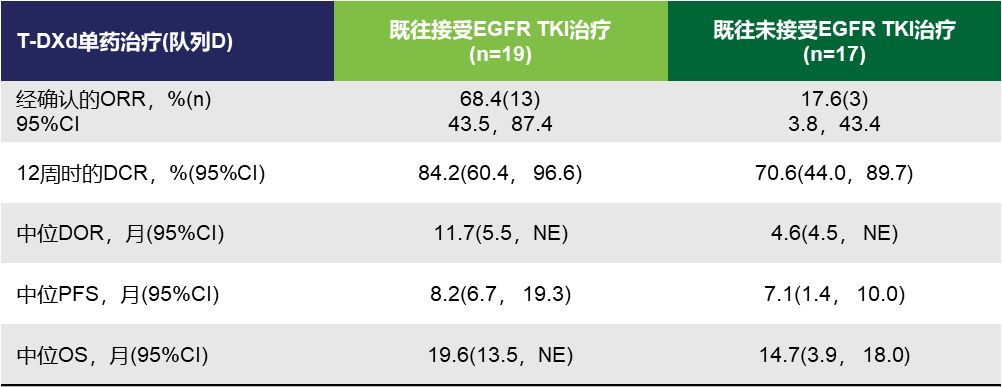
随着后续治疗药物的陆续上市,HER2突变NSCLC治疗选择的排兵布阵和全程管理同样需要明确“最优解”。2024年WCLC大会上公布了DESTINY-Lung03研究结果,该研究旨在评估5.4 mg/kg德曲妥珠单抗单药治疗在既往接受治疗后出现疾病进展的HER2过表达NSCLC患者的安全性和疗效中[21]。其探索性分析显示,德曲妥珠单抗治疗既往接受过EGFR TKI治疗的患者相比未接受过此类治疗的患者的疗效更优,其ORR分别为68.4%和17.6%,中位PFS分别为8.2个月和7.1个月(表1)[21]。或许,TKI序贯ADC治疗的价值会在不远的未来进行更深入的探索与探讨。
表1. DESTINY-Lung03研究根据既往是否使用EGFR TKI的疗效结果
随着研究的不断深入,HER2突变NSCLC的治疗策略将更加多元且完备,更多患者也会因此而实现更多获益。恰恰也正因此,HER2突变NSCLC治疗才能拥抱更光明的的未来。
王志杰教授点评:HER2突变是NSCLC的关键致癌驱动基因之一,中国NSCLC患者中HER2突变率约为3.8%[3]。随着精准医疗的发展,HER2基因检测规范化进程也在不断推进,新型TKI和ADC药物为治疗带来新的希望。新型TKI药物BAY 2927088首个获得FDA和NMPA双突破性治疗品种认证的TKI,I/II期研究展现出具有前景的疗效和良好的安全性,III期研究正在积极进行中。2024年德曲妥珠单成为NMPA首个批准用于HER2突变NSCLC后线治疗的HER2 ADC,为患者提供了临床可及的治疗新选择。在HER2治疗选择不断丰富的趋势下,探索HER2突变NSCLC更完备的全程管理策略势在必行。
医学探索的每一份成功都镌刻着无数人的努力,治疗选择的每一次跨越都彰显着科学与集体的智慧,肺癌治疗是如此,HER2突变NSCLC尤是如此。随着检测技术的进步和靶向药物的革新,HER2突变NSCLC治疗迈向了新纪元,并以前所未有的速度向前迈进。2024年,新型HER2 TKI药物研究蓬勃发展,HER2 ADC在中国获批上市,HER2突变NSCLC治疗选择与探索不断丰富。与时俱进完善治疗策略,解锁疗效的新高度,延长患者的生存期,量身定制个体化治疗,于每一位临床医生,都始终任重而道远。征途漫漫,步履铿锵,曙光已初露;不懈前行,步伐加快,前景更可期。
[1] Lim SM, et al. JCO Oncol Pract. 2024 Jan;20(1):47-56.
[2] Mar N, et al. Lung Cancer. 2015 Mar;87(3).220-5.
[3] Jia B, et al. 2024 WCLC EP.12D.03.
[4] Le X,et al. 2024 WCLC PL04.03.
[5] Goto K,et al. 2024 WCLC EP.12H.08.
[6] Ren S, et al. ESMO Open. 2022 Feb;7(1):100395.
[7] Zhang S, et al. Thorac Cancer. 2023 Jan;14(1):91-104.
[8] NCCN. Non-Small Cell Lung Cancer. Version 11. 2024
[9] CSCO. 非小细胞肺癌诊疗指南, 2024.
[10] Kreutzfeldt J, et al. Am J Cancer Res,2020,10(4):1045-1067.
[11] 吡咯替尼中文说明书.核准日期:2020年08月13日
[12] Liu SM, et al. Nat Med. 2023 Aug;29(8):2079-2086.
[13] Ruiter G, et al. 2024 WCLC PL04.04.
[14] https://clinicaltrials.gov/study/NCT06151574?intr=NCT06151574&rank=1
[15] https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-fam-trastuzumab-deruxtecan-nxki-her2-mutant-non-small-cell-lung
[16] Jänne PA, et al. 2024 ASCO Abstract 8543.
[17] Cheng Y, et al. 2024 AACR CT248.
[18] Hurvitz SA, et al. 2023 SABCS Abstract GS01-10.
[19] Jiang W, et al. 2024 ESMO 1297P.
[20] https://clinicaltrials.gov/study/NCT04042701?term=NCT04042701&rank=1
[21] Planchard D, et al. 2024 WCLC OA16.05
审核码:MA-LAR-CN-0274-1
排版编辑:肿瘤资讯-jyy











 苏公网安备32059002004080号
苏公网安备32059002004080号


