急性淋巴细胞白血病(ALL)是一种源于淋巴细胞的恶性肿瘤,其异质性较高。当前ALL的治疗主要包括诱导治疗阶段、缓解后治疗阶段以及复发难治性患者的治疗。其中诱导治疗的核心目标是迅速降低ALL患者体内肿瘤负荷,恢复正常造血功能,从而实现缓解。
根据细胞遗传学分型,ALL可分为费城染色体阳性(Ph+)和费城染色体阴性(Ph-)两种主要类型。既往研究表明,Ph状态与患者的不良预后密切相关。然而,随着治疗手段的持续创新,针对这两种亚型的治疗策略已取得显著进展,其中以抗体-药物偶联物(ADC)为代表的新型疗法为患者带来了更多希望。多项研究证实,CD22 ADC 药物奥加伊妥珠单抗(InO)不仅在治疗成人复发/难治性B细胞急性淋巴细胞白血病(R/R B-ALL)中有着良好的疗效与安全性,在ALL的诱导治疗和巩固治疗阶段也表现卓越,为改变治疗结局的ALL全程管理注入了新的动力。
2024年12月7日至10日,第66届美国血液学会(ASH)年会将在美国圣地亚哥(San Diego)隆重举行。【肿瘤资讯】特别整理了ASH大会公布的ALL诱导治疗相关重要研究的疗效结果,并邀请浙江大学医学院附属第二医院钱文斌教授对其进行点评,详情如下。
浙江大学医学院附属第二医院血液内科 主任
浙江大学医学院附属第二医院生物治疗中心 主任
科技创新2030国家重大项目 首席科学家
中国医师协会血液科医师分会 委员
中国抗癌协会肿瘤血液病学/血液肿瘤专业委员会 常委
中国抗癌协会淋巴瘤专业委员会 委员
中国老年保健协会淋巴瘤专业委员会 副主任委员
中华血液学会 淋巴细胞疾病学组、感染学组 委员
浙江省医学会血液学分会 主任委员
以第一/通讯作者在Cell Discovery, eClinical Medicine, Clin Cancer Res, Leukemia (2), Haematologica, Blood Cancer Journal, Cancer Communication, J Hematol & Oncol (2), Signal Transduction and Target Therapy, Cell Mol Immunol和Lancet Hematology等国际知名刊物发表论文90余篇
【CAR T细胞治疗NHL毒副作用临床管理指导原则】、【CAR-T细胞治疗淋巴瘤MDT全程管理专家共识】共同主编,清华大学出版社,2021年
【CAR-T细胞免疫治疗学】人民卫生出版社,2021年;【肿瘤生物细胞治疗病例精解】上海科学技术文献出版社,2024年,副主编
主持国家自然基金重点项目、原创探索项目和面上项目7项和浙江省重点研发计划等
作为负责人或主要成员获得国家科技进步二等奖2项、省科技进步一、二等奖近10项
含InO方案在Ph+和Ph- ALL诱导治疗中的应用与效果
Ph+ ALL患者:Ino联合治疗方案可提高Ph+ ALL全人群疗效,IZKF1异常患者尤为受益
P1432:一项II期研究的中期结果——InO联合达沙替尼为基础的诱导治疗在新诊断 Ph+ ALL中的疗效[1]
主要研究目的
研究旨在探索新诊断Ph+ ALL接受达沙替尼(DAS)+联合InO诱导治疗的疗效。
主要研究方法
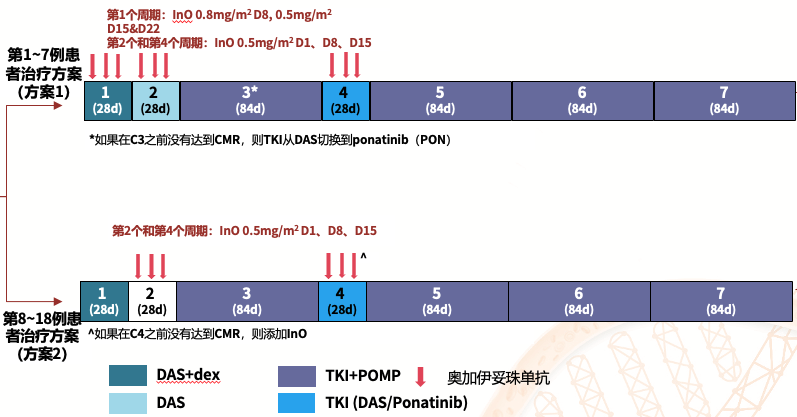
18例新诊断Ph+ ALL,年龄≥18岁,ECOG评分≤2,≥20%CD22+原始细胞,且无中枢神经系统 (CNS) 疾病的患者符合入组条件。其中8例ALL患者存在IKZF1畸变(7例IZKF1loss),3例患者存在IKZF1plus。研究的主要终点为患者经过两轮治疗后的完全分子缓解(CMR)率。入组患者将接受如下治疗:
治疗方案1:
● C1:DAS(140mg/D);地塞米松(dex,10mg/m2,D1~7和D15~21);InO (0.8mg/m2,D8;0.5mg/m2 ,D15和D22)
● C2:DAS(140mg/D);InO(0.5mg/m2,D1、8、15)
● C3:TKI + POMP(强的松、长春新碱、6-巯基嘌呤和甲氨蝶呤)
● C4:TKI + InO(0.5mg/m2,D1、8、15)
● C5-7:TKI + POMP虽从第8例患者开始,使用治疗方案2(#2)。
治疗方案2:
● C1:DAS(140mg/D);Dex (10mg/m2,D1~7 和 D15~21)
● C2:InO(0.5mg/m2 ,D1、8、15)
● C3:TKI + POMP
● C4:TKI(如未达CMR,则联合InO)
● C5-7:TKI + POMP入组患者还接受了15剂鞘内化疗作为CNS预防治疗
主要研究结果
疗效结果
● 在C3结束时,全人群的CMR率为89% (16/18)。对于接受方案2治疗的ALL患者,C3结束时CMR率为91%。
● 在C2后,研究中的MRD阴性率(MRD-)为67%,C3后提升至89%。在C3结束时,所有入组患者均达到了CMR(qRT-PCR)或MRD-(NGS),其中14例ALL患者通过NGS检测达到CMR且MRD-。
● 中位随访343天,期间未观察到ALL患者复发。研究中暂无ALL患者接受异基因造血干细胞移植(HSCT)。
亚组分析结果
● 本研中的8例存在IZKF1畸变(包括IZKF1loss)的ALL患者,C3结束时CMR率为100%;3例IKZF1plus患者在C3结束时CMR率为100%。
研究结论
该研究疗效结果表明,InO联合化疗的诱导治疗可能为新诊断Ph+ ALL患者带来一定的获益。尤其在伴有IZKF1基因异常如IZKF1loss的患者中,InO联合治疗有望突破其治疗瓶颈,成为这类患者诱导治疗新选择。
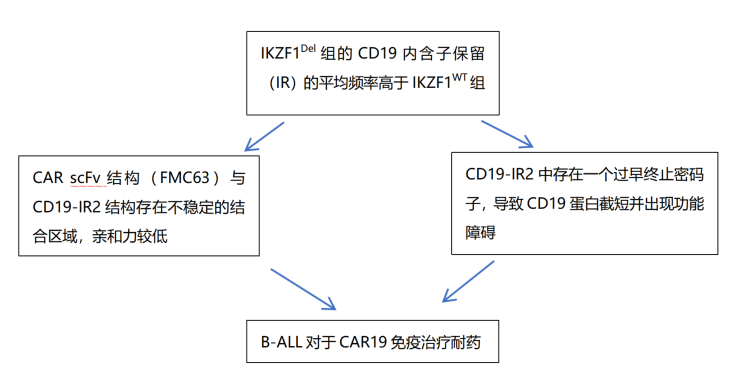
基于今年ASH大会公布的研究数据,存在IZKF1异常(包括IZKF1del和IKZF1plus)ALL更易对靶向CD19的细胞治疗等部分免疫疗法耐药。以CD19 CAR-T细胞治疗为例,在今年ASH中,一项研究发现,IKZF1del可保留B-ALL患者体内的CD19内含子,从而引发其对CAR19细胞治疗的耐药性(具体机制如下)[2]。
P3412: IKZF1del通过保留CD19内含子导致R/R B-ALL对CAR19耐药
研究者发现初治伴 IKZF1delB-ALL患者保留CD19内含子的频率更高,而且CD19-IR2中存在一个过早终止的密码子,导致CD19蛋白截短且功能障碍。另外,IKZF1delB-ALL患者也可通过不稳定的接触结构导致患者出现CAR19耐药。因此,多数存在该类异常ALL患者无法从常规免疫治疗中获得缓解,亟需更为且效的治疗方案。
P2836:Gimema ALL2820研究中Ph+ALL患者的MRD水平监测结果[3]
本研究探索了BiTE联合TKI作为Ph+ ALL患者诱导治疗的疗效。该研究结果显示,在诱导治疗阶段,伴有不同IKZF1突变状态(IKZF1plus vs IKZF1 WT/IKZF1缺失)Ph+ ALL患者的BCR::ABL1与免疫球蛋白/T 细胞受体克隆基因重排(IG/TR)的一致性相似,且均较低(48.4% vs 44)。这一结果提示伴有该突变的ALL患者可能对BiTE联合TKI诱导治疗等的整体敏感性较低,或与异质性克隆相关。
除在Ph+ALL患者中,含InO治疗方案在Ph- ALL患者同样表现出色,或可为该类患者带来显著的治疗效果,改善其长期生存结果。
Ph- ALL患者:免疫治疗前移±化疗在不同年龄段ALL患者中的均展现显著的疗效
老年患者
P1441:mHCVD+InO±Blina治疗新诊断 Ph- B-ALL老年患者的10年更新结果[4]
主要研究目的
研究探索了mHCVD+InO±Blina方案作为新诊断Ph- B-ALL的老年患者诱导治疗的疗效,并将报告10年随访结果。
主要研究方法
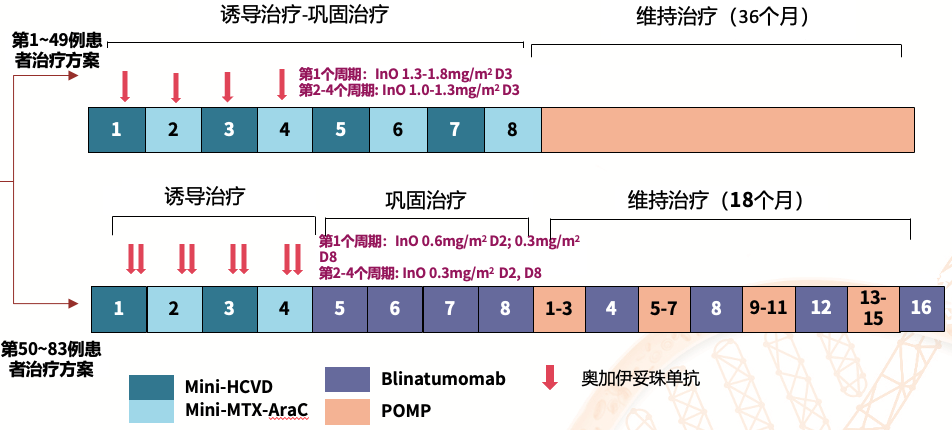
2011年12月~2022年8月,83例年龄≥60岁,初治或既往接受过≤2个周期的治疗,ECOG PS≤3且器官功能正常的Ph- B-ALL患者符合入组条件,中位年龄为67岁。其中6例ALL患者在入组时已经达到CR(5例患者MRD+)。
治疗方案1:
● 诱导治疗(C1~C8):mHCVD+InO(C1D3,1.3~1.8mg/m2;C2~4D3,1.0~1.3mg/m2)+利妥昔单抗(如CD20≥20%,则在C1~4 D8,给予375mg/m2)
● 维持治疗:POMP
治疗方案2:
● 诱导治疗(C1~C8):mHCVD+InO(InO分次给药,最大累积剂量为2.7mg/m2[C1D2,0.6 mg/m2,C1D8,0.3 mg/m2,C2~4D2/D8,0.3 mg/m2])
● 巩固治疗(C5~8):贝林妥欧单抗(Blina,28µg/天)
● 维持治疗:POMP+Blina
● 所有患者均接受熊去氧胆酸治疗以及12剂鞘内注射甲氨蝶呤(MTX)/阿糖胞苷(Ara-c)以预防中枢神经系统疾病。
主要研究结果
疗效结果
●在入组时未达到完全缓解(CR)的ALL患者中(n=77),最佳缓解(CRc)率为99%。在疗效可评估的ALL患者中(n=81),MRD-的最佳缓解率为93%,包括入组时为MRD+的患者。
●经过1疗程治疗后,研究中的MRD- 率为75%。中位随访37个月,在灵敏度=10-6水平下MRD- 率为94%,且无一例复发。
●在121个月的随访中,研究的中位无进展生存期(PFS)为47个月,总生存期(OS)为62个月,中位持续缓解时间(CRD)尚未达到。
●研究的5年PFS率、OS率和CRD率分别为46%、50%和79%。
研究结论
基于该研究疗效结果,对于Ph- ALL老年患者而言,mHCVD+InO±Blina是一种有效且耐受性良好的诱导治疗方案,且长期获益显著。另外,该研究提示进一步减少化疗剂量,尤其是对于≥70岁的患者,或有助于改善临床结局。
而以上研究结论在大会报告的另一项研究中得到证实。该研究评估了InO联合Blina和更低剂量化疗诱导方案在≥70岁Ph- B-ALL老年患者一线治疗中的疗效,并取得了显著的进展。
P1442:InO联合Blina和低剂量化疗方案一线治疗Ph- B-ALL老年患者中的疗效[5]
主要研究目的
研究探索了InO联合Blina和低剂量化疗作为Ph- B-ALL老年患者一线治疗方案的疗效。
主要研究方法
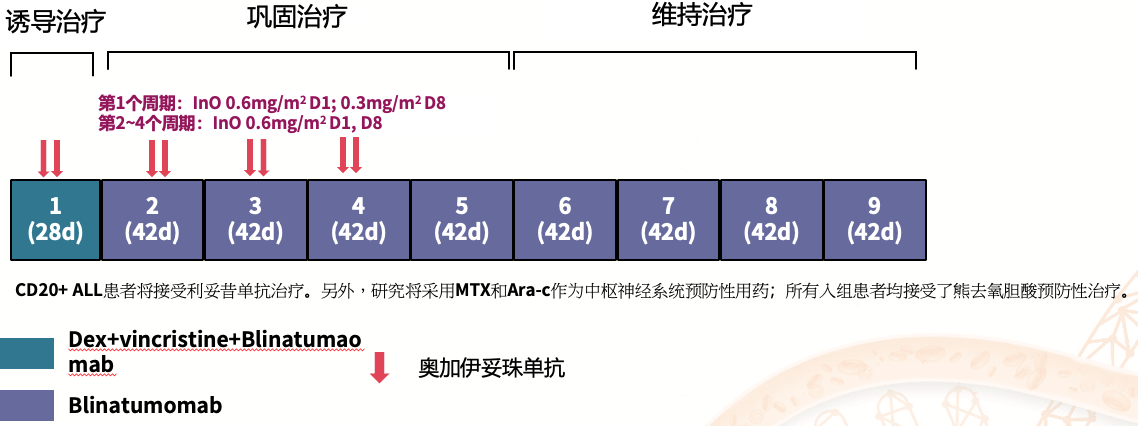
2021年4月~2024年5月,年龄≥70岁(或60~70岁unfit)、ECOG评分≤3且器官功能正常的14例Ph-B-ALL患者符合入组条件,中位年龄为76岁。其中6例接受评估的患者具有高危(HR)细胞遗传学特征。
治疗方案:
●诱导治疗(C1):Dex(20mg D1~D4)+长春新碱(1mg,D4)+InO(0.6mg/m2,D1;0.3mg/m2,D8)+Blina(9ug/D×2,28ug/D,D15~D28)
●巩固周期(C2~C5):Blina(28 ug/D ,D1-D28/42天周期)+InO(0.6 mg/m2 ,仅C2-C4D1、D8;InO最大累积剂量=2.7 mg/m2)。
●维持治疗:Blina(28 ug/D,D1~D28/42天周期,4个周期)
●CD20+ ALL患者将接受利妥昔单抗治疗。另外,研究将采用MTX和Ara-c作为中枢神经系统预防性用药。
●所有入组患者均接受了熊去氧胆酸预防性治疗。
主要研究结果
疗效结果
●研究中CRc最佳缓解率为93%。所有获得缓解的患者(100%)均达到MRD-,其中11例患者在1个周期后即达MRD-。在更高灵敏度(10-6)的检测下,92%的B-ALL患者维持MRD-。
●中位随访15个月,研究中共有2例B-ALL患者复发;中位PFS、CRD和OS尚未达到,1年PFS、CRD和OS率分别为64%、70%和73%。
主要研究结论
本研究证实,InO联合低剂量化疗作为诱导治疗在Ph- B-ALL老年患者中展现了良好的缓解率。研究结果进一步支持,InO联合更低剂量化疗的诱导治疗方案可能为B-ALL老年患者带来更大的生存获益。
全人群
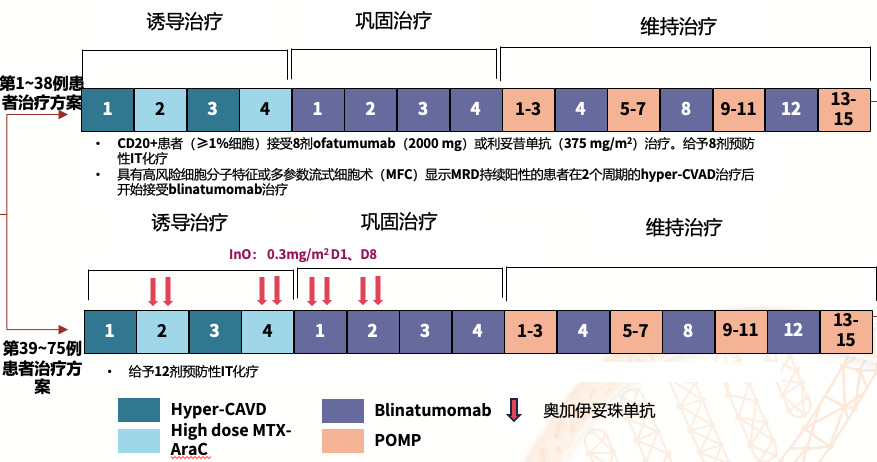
P1439:新诊断 Ph- B-ALL患者接受Hyper-CVAD±InO并序贯Blina治疗的II期研究更新结果[6]
主要研究目的
研究旨在探索Hyper-CVAD±InO随后序贯Blina方案在新诊断B-ALL患者中的效果,并将报告患者30个月的随访数据。
主要研究方法
截至2024年7月,75例14~59岁的新诊断(包括既往接受过不超过1个周期化疗)Ph- B-ALL患者符合入组条件并接受了治疗。入组患者的中位年龄为33岁,其中48%的患者具有高危细胞分子特征(包括Ph样ALL等)。另外,16例B-ALL患者经1~2个周期的方案外治疗后在入组时达到CR,其中10例患者为MRD-。
第1-38例患者治疗方案:
● 诱导治疗(C1~C4):Hyper-CVAD与高剂量MTX和Ara-C交替治疗
● 巩固治疗(C5~C8):Blina(标准剂量)
● 维持治疗
C1~3、C5~7、C9~11和C13~15:POMP
C4、8和12:Blina
第39-75例患者治疗方案:
●诱导治疗(C1~C4):Hyper-CVAD与高剂量MTX和Ara-C交替治疗+InO(0.3 mg/m2,D1和D8,2个周期)
●巩固治疗(C5~C8):Blina(标准剂量)+InO(0.3 mg/m2,D1和D8,2个周期)
●维持治疗
C1~3、C5~7、C9~11和C13~15:POMP
C4、8和12:奥法妥木单抗/利妥昔单抗:CD20+ B-ALL患者,8剂;所有患者均需接受预防性IT化疗;
持续MRD+ B-ALL患者将接受Hyper-CVAD方案序贯Blina治疗。
研究结果
疗效结果
● 在研究开始时患有活动性疾病的59例B-ALL患者中,CR率100%,其中84%的患者在C1后达CR。
● 在疗效可评估B-ALL患者中(N=65),MRD- 率为95%(灵敏度为10-4),其中66%的B-ALL患者在C1后达到了MRD-。而在灵敏度为10-6水平下,研究的MRD- 率为71%(40/56)。
● 研究的预计3年无复发生存率(RFS)为82%,3年OS率为90%。在30个月RFS率和OS率方面,InO治疗组均优于非InO治疗组(RFS:91%vs74%,P=0.05;OS:100%vs82%,P=0.008)。在HR患者中,InO治疗组同样保持着该优势(RFS:92%vs 67%,P=0.07;OS: 100%vs76%,P=0.05)。
● 中位随访为38个月,53%B-ALL患者在未行SCT情况下持续缓解,3例患者在CR时死亡。
● 在预后方面,首次缓解时行SCT与未行SCT的患者之间无显著差异(3年OS率:91%vs94%,P=0.9),而HR B-ALL患者的预后与标准风险患者相当(3年OS率86% vs 95%,P=0.3)。
研究结论
对于患有新诊断 Ph- B-ALL的全年龄段的成人患者,Hyper-CVAD+InO序贯Blina作为诱导治疗有助于进一步改善患者的长期获益,有望为患者带来更优的生存结局。
总结
总体而言,ALL的诱导治疗策略在不断演进并取得了显著的进展,免疫治疗前移为Ph+和Ph-患者都带来了更深的缓解与更好的长期生存获益。以InO为代表的免疫疗法,在ALL多阶段治疗中展现出显著优势。今年ASH大会数据显示,含InO的诱导治疗方案不仅可帮助Ph+ ALL患者实现深度缓解,特别是在伴有IKZF1del等基因异常的患者中展现出广大的前景,或将突破传统治疗瓶颈。对于Ph- ALL患者,低强度化疗联合InO的诱导治疗策略也在老年患者中显现良好前景,标志着ALL诱导治疗进一步向精准化和个体化迈进。未来,更多临床研究将助力优化ALL诱导治疗方案,为患者提供更优的生存结局。
钱文斌教授:近年来, ALL诱导治疗策略持续优化,特别是在Ph+和Ph-患者的治疗中取得了重要突破。这些进展源于对ALL发生机制及分子生物学基础的深入研究,推动了免疫治疗手段的开发与应用。其中, InO作为一种ADC,通过特异性靶向CD22,在ALL多阶段治疗中表现出卓越疗效,为患者带来新的希望。
在Ph+ ALL患者中,基于ASH大会的最新数据,含InO的诱导治疗方案显示出优异的深度缓解率,C3治疗后MRD-率达89%,所有患者均在C3结束时实现CMR或MRD-。尤其是在伴有IKZF1del等高危基因异常的患者中,该方案展现出显著的生存获益潜力,有望突破传统治疗对这一亚组疗效受限的瓶颈,为改善生存预后提供了重要依据。
同时,在Ph- ALL患者的治疗中,InO联合方案同样取得了显著成果。研究显示,Hyper-CVAD±InO序贯Blina的治疗在Ph- ALL患者中CR率高达100%,MRD-率高达95%,30个月联合InO的治疗方案OS率达100%。对于老年Ph- ALL患者,低强度化疗联合InO的治疗策略同样展现出强大抗肿瘤活性,超过90%获得缓解的患者达到MRD-,预示其在延长老年B-ALL患者长期生存方面具有重要潜力。
这些研究成果标志着ALL诱导治疗正朝着更加精准化和个体化的方向迈进,同时为临床实践提供了针对性更强的治疗选择。展望未来,ALL治疗的持续优化仍需更多高质量的临床研究支撑。随着精准医学和个体化治疗的深入应用,我们有理由期待进一步改善患者生存结局,为ALL治疗领域带来新的里程碑式突破。
1. P1432,https://ash.confex.com/ash/2024/webprogram/Paper193442.html
2. P3412,https://ash.confex.com/ash/2024/webprogram/Paper203362.html
3. P2836,https://ash.confex.com/ash/2024/webprogram/Paper210731.html
4. P1441,https://ash.confex.com/ash/2024/webprogram/Paper208824.html
5. P1442,https://ash.confex.com/ash/2024/webprogram/Paper208742.html
6. P1439,https://ash.confex.com/ash/2024/webprogram/Paper208854.html
排版编辑:肿瘤资讯-Julian











 苏公网安备32059002004080号
苏公网安备32059002004080号


