近年来,过继细胞免疫治疗在治疗各类肿瘤中取得了巨大的进展,尤其是在血液系统肿瘤中的治疗,其中主要包括细胞因子诱导的杀伤细胞(CIK)、嵌合抗原受体T细胞(CAR-T)、嵌合抗原受体自然杀伤(CAR-NK)细胞技术等。目前CIK细胞及CAR-T疗法当前在临床上已开始广泛被应用,尤其在血液系统肿瘤方面都取得了巨大的成就,自然杀伤(NK)细胞是先天免疫系统的主要组成部分,尤其是用于肿瘤免疫监测。研究发现基于NK细胞的过继细胞疗法可能在很大程度上规避一些风险,如CAR-T疗法引起的细胞因子释放综合征(CRS)和神经毒性作用,以及移植物抗宿主病(GVHD)等风险,NK细胞从而成为继T细胞之外CAR工程的潜在候选细胞,同时CAR-NK细胞疗法在肿瘤的治疗上也展现了巨大的发展前景,但目前仍处于起步阶段。文章从NK细胞的生理、CAR-NK细胞作用机制及其在临床上的应用进行综述。
NK细胞生理特征
NK细胞是由Ronald Heberman于1975年发现的,是机体内重要的免疫细胞,由骨髓中CD34 +淋巴细胞分化而来,约占血液中所有免疫细胞的15%,属于天然免疫系统的核心细胞,主要分布于外周血、脾脏、肝脏等。NK细胞根据CD56表达水平的高低可分为CD56dim和CD56bright 2个亚群,其中CD56dim属于完全成熟细胞群,约占外周血的90%,主要发挥细胞毒作用。具体为:
(1)释放穿孔素及颗粒酶等细胞毒性作用,进而诱导靶细胞溶解;
(2)Fas/FasL途径介导细胞凋亡,当NK细胞表达的Fas配体(FasL,CD178)与其同源受体Fas(CD95)在靶细胞表面的相互作用,膜结合的FasL与Fas的结合在靶细胞杀伤以及自分泌和旁分泌T细胞死亡期间诱导细胞死亡;
(3)释放细胞毒性因子,如NK细胞毒因子、肿瘤坏死因子(TNF)等,与靶细胞表面受体结合杀伤靶细胞;
(4)通过抗体依赖细胞介导的细胞毒作用(ADCC)来直接杀伤靶细胞,当NK细胞识别抗体调序靶细胞时,ADCC被触发,细胞表面受体FcγRIIC(CD32c)和FcγRIIIA(CD16a)结合具有结合靶抗原的抗体的Fc部分的结合触发穿孔素和颗粒酶B的释放,从而裂解靶细胞。另一个亚群CD56bright为不完全成熟细胞群,占外周血的5%~15%,起产生细胞因子(干扰素、TNF和粒细胞巨噬细胞集落刺激因子等)、免疫调节等作用
NK细胞拥有很强的细胞因子能力(如inf-v、tnf-x、gm-csf、il-3、m-csf等),可通过杀伤效应及分泌多种细胞因子能力正向或负向调节机体免疫。有研究表明,当在受到白细胞介素(IL)-2、IL-12、IL-15等刺激时,所有NK细胞亚群的细胞毒性活性显著增加。因此它们可成为用作NK兴奋剂的候选者。NK细胞发挥作用无需抗原致敏,抗体参与,无需其他细胞参与,且无MHC的限制,单独可识别和攻击肿瘤细胞、癌细胞及病毒等,并对正常组织细胞无损伤作用。
NK细胞的杀伤活性受细胞表面的抑制性受体[(如程序性死亡受体1(PD-1)、TIGIT、CD96、CD94/NKG2A、KIRS等)和激活性受体(如NCR、DNAM-1、NKG2D、CD226、CD94/NKG2C)]的共同调控,当激活与抑制的平衡被打破,即激活性配体上调或抑制性配体下调时,NK细胞便开始发挥它杀伤细胞的作用 。
CAR-NK细胞的作用机制
CAR技术是基因工程与免疫疗法的完美融合,是当前肿瘤治疗领域最具前景的研究方向之一,CAR是一种人工抗原受体,介导抗体靶向识别,它赋予细胞新的能力。CAR-NK细胞不仅通过CAR特异性识别表达抗原肿瘤的能力,而且通过NK细胞受体本身来消除肿瘤。同时决定NK细胞活性的是刺激和抑制信号的平衡,而不是抗原特异性。
用于NK细胞的CAR构建体由3个结构域组成:细胞外抗原识别结构域,跨膜结构域和细胞内细胞质信号转导结构域,外域包含来自识别肿瘤抗原抗体的单链可变片段(scFv)。跨膜结构域将CAR结构锚定在效应细胞膜上。CAR与其抗原在肿瘤细胞上的结合触发信号转导级联,scFv可特异性识别靶细胞上的抗原,进而通过细胞内信号转导结构域,然后激活NK细胞直接或通过免疫系统的其他成分杀死靶标,因此该结构域也决定了CAR-NK细胞特异性及功能。ScFv作为认为合成抗体,它的重链和轻链的顺序是可以人为决定的,到目前为止,在CAR-NK细胞的设计中,多数研究小组更倾向于VH-VL方向。但也有研究证明重链和轻链的顺序并不影响CAR的表达水平。
CAR的演变目前总结为四代,在第一代CAR中,CAR-T和CAR-NK细胞通常使用CD3ζ作为单个激活细胞内信号转导区域,然后在第二代和第三代CAR中分别带有2个和2个附加的共刺激信号。共刺激分子通常来源于CD28家族(包括CD28、ICOS)、肿瘤坏死因子受体基因家族(包括4-1BB、OX40和CD27)或信号淋巴细胞活化分子(SLAM)相关受体家族(包括2B4)。最近,第四代携带转基因"有效载荷"的CAR,如IL-2或IL-15,已被设计用于改善CAR-NK细胞增殖,生存周期和抗原阴性肿瘤细胞的细胞毒性。如图1为目前CAR-NK细胞的结构。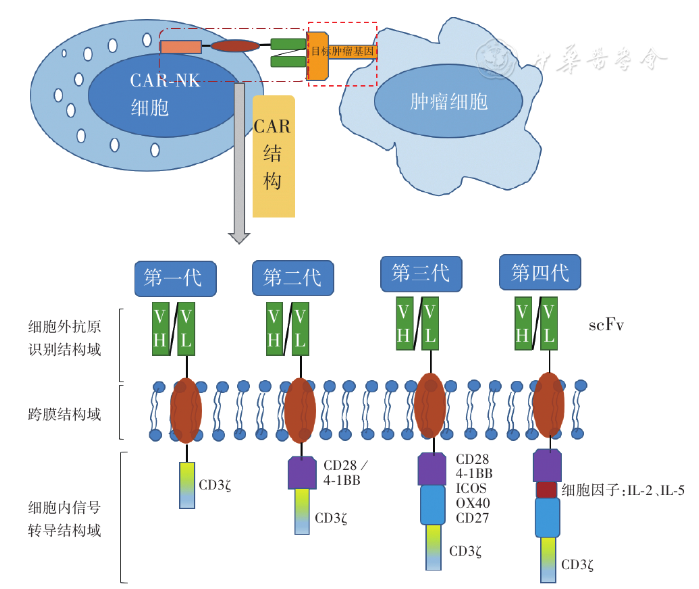
CAR-NK细胞的制备
用于制造CAR-NK细胞的NK细胞可以从多种细胞中获得。异基因NK细胞可以从多种来源产生,且每种细胞系均有独特的优缺点,外周血来源的NK细胞已经成熟,无需再等待分化,但该种细胞来源NK细胞转导效率较低,长期培养可导致端粒酶缩短和耗竭,从而降低细胞毒性。NK细胞还可以来源于干细胞,如脐带血来源的NK细胞具有高增殖性,在收集时可确定样本的单体性,但该来源的细胞数量少,需离体扩增;诱导多能干细胞(iPSC)是临床应用的NK细胞的另一个重要来源,此来源的NK细胞具备无限增殖能力,可以更有效地设计以稳定地表达CAR,但此来源价格昂贵,具有恶化转化的潜力,潜在的免疫原性,可能导致胚胎干细胞的破坏,胚胎干细胞(hESC)也可用来制备CAR-NK细胞。CAR不仅可以在原代NK细胞上表达,也可在NK-92细胞株中制取,NK-92是一种NK样细胞株,来源于1例50岁的男性非霍奇金淋巴瘤患者,该细胞株具备无限增殖能力,高效抗肿瘤活性,易于操作和设计,但在输注前需进行辐照,照射后体内持久性有限,ADCC低。根据不同来源细胞的特点选择合适的NK细胞可以帮助制备更好的CAR-NK细胞。
使用合适的方法将遗传物质转移到NK细胞中是制备CAR-NK细胞最为关键的环节。目前,病毒或非病毒载体已被广泛用于CAR基因转导中。在反转录病毒RNA基因组整合过程中,病毒RNA被反转录成双链cDNA,然后在病毒整合酶的帮助下半随机插入宿主基因组。在制备CAR-NK细胞过程中,反转录病毒通常用于进行基因转移,它可以很好地使载体稳定地整合到宿主的DNA中,反转录病毒载体对外周血中原代NK细胞的转染效率极高。但是反转录病毒的载体具有不稳定性且无法感染非分裂细胞,而且反转录病毒载体会随机融入宿主基因组,增加了插入突变等其他不良反应的可能性。相比于反转录病毒,慢病毒方法允许转导原代和非活化的NK细胞,尽管它的转染效率相较于反转录病毒低得多,但它却比反转录病毒载体有着更低的插入突变率,使得慢病毒转导逐渐成为制备CAR-NK细胞的首选。电穿孔CAR进行mRNA的编码方式是一种快速、简洁的方法,然而,由于膜的持续通透性和细胞稳态的破坏,电穿孔方法中的电脉冲往往会导致多种细胞的丢失。以转座子为基础的机制,如睡美人转座子载体,已经成功地将转基因传递到宿主基因组中,并可作为病毒载体的替代。转座子载体由一个带有CAR基因序列的转座子和一个转座子(如SB100X)组成,转座子与反转录末端重复序列(itr)结合,介导随机转座子进入宿主基因组,它可以在预定的位置高效地导入CAR基因。同时,转座子系统已被使用于进行CAR-T转染的临床前及临床研究。Bashiri Dezfouli等也报道了转染非病毒型"睡美人"转座子的CD19 CAR及CIK的有效性和安全性。
CAR-NK细胞的临床应用
CAR-NK细胞疗法在血液系统的治疗应用中目前属于起步阶段,CD138作为多发性骨髓瘤(MM)的主要诊断标志物,其在MM细胞上的高表达使其成为MM的特异性免疫治疗靶标。为了增强NK-92MI对表达CD138的MM细胞的毒性,某临床试验小组用编码为scFv(4B3)-CD3ζ的重组CAR的慢病毒载体转染NK-92MI细胞,该载体是CD138特异性单链抗体片段(scFv)遗传融合到T细胞受体(TCR)复合物(另一种已知触发NK细胞毒性的信号分子)的CD3ζ链。在此次研究中发现转染的NK-92MI细胞进行10 Gy照射后可以保留其显著的离体细胞毒性。同时该研究在异种移植MM小鼠模型中证明了辐照NK-92MI-scFv的体内抗MM活性,也为在表达CD138的浆细胞恶性肿瘤中使用CD138特异性CAR修饰的NK细胞进行过继免疫治疗提供了基本原理和可行性。
Tang等使用CD33-CAR-NK-92细胞在3例复发难治急性髓系白血病(AML)患者中进行了首次Ⅰ期临床试验,首例为14岁女童,选用AML ETO(+)、C-Kit(+),输注CAR-NK-92细胞4个月后,患者出现血液学复发,未行进一步治疗。第2例为24岁男性,染色体异常的AML-M 4 t(3;16),在CAR-NK-92细胞输注2个月后,患者接受了来自非亲缘供体的造血干细胞移植(HSCT)并获得了完全缓解,但在移植4个月后复发,并在挽救化疗联合供体淋巴细胞输注(DLI)后死于Ⅳ级重度GVHD。第3例为49岁女性,诊断为CD33 + AML-M4,核型正常,并有多种突变,包括NRAS(+)、NPM1(+)、DNMT3A(+)和TET2(+),患者对治疗没有反应。CAR-NK细胞输注10 d后,骨髓检查显示79.5%为原始细胞,CD33 +表达94.6%。在此次临床试验中证明了患者输注剂量高达5×109细胞是安全的,并不会产生实质性的不良反应。有研究表明CAR工程的NK-92细胞具有抗白血病功能,而且可以克服B细胞对亲本NK细胞的急性和慢性白血病耐药性。CAR-NK细胞用于治疗血液系统恶性肿瘤和实体癌症的临床试验数量激增。有研究小组在已经完成的Ⅰ期和Ⅱ期临床试验中,从脐带血中提取HLA不匹配的抗CD19 CAR-NK细胞输注给11例复发难治CD19阳性肿瘤(非霍奇金淋巴瘤或慢性淋巴细胞白血病)的患者,用表达基因的反转录病毒载体转导NK细胞,并将提取的NK细胞设计为表达抗CD19 CAR,以IL-15和诱导的半胱天冬酶9为安全开关,尽管在此临床试验中输注的NK细胞和受体之间存在严重的HLA不匹配,但在输注CAR-NK细胞后,患者并未发生细胞因子释放综合征,神经毒性或噬血细胞性淋巴组织细胞增多症的症状。在此次试验中11例接受治疗的患者中,8例(5例慢性淋巴细胞白血病中4例,6例非霍奇金淋巴瘤中4例)有反应,7例(4例淋巴瘤和3例慢性淋巴细胞白血病)完全缓解,1例Richter转化成分缓解,但有持续性慢性淋巴细胞白血病。
CAR-NK细胞应用的挑战
尽管CAR-NK细胞治疗具有巨大的潜力,但要扩大其临床应用,仍存在一些根本问题需要解决。首先,目前的CAR是为构建CAR-T而设计的,因此,对于应用于NK细胞是一个次优选择。CAR结合表位的位置和它们与CAR-NK细胞表面的距离将会影响它们结合抗原和激活CAR-NK细胞的能力,同时也有可能会影响CAR-NK细胞发挥它最大杀伤肿瘤细胞的能力。
维持CAR-NK细胞在体内的持续表达性可能增加NK细胞疗法的疗效,这一过程需要细胞因子的刺激,这也成为了过继性NK细胞治疗的主要局限性之一,尽管这样可能降低CAR-NK细胞疗法的危险性。在一项研究中,用表达IL-2或IL-15的反转录病毒载体转导的NK-92细胞或原代NK细胞在含瘤小鼠中显示出增强的增殖和持久性。同时将IL-15转基因纳入CAR构建体可增强NK细胞增殖和体内持久性,改善抗肿瘤活性,而不会增加IL-15的全身水平或高危淋巴样恶性肿瘤患者的毒性。如何增强NK细胞过继免疫治疗中杀伤肿瘤细胞的毒性作用同样也是该细胞过继疗法的另一个需要考虑和解决的问题。许多B细胞急性和慢性白血病往往对NK细胞的杀伤具有抵抗力。Romanski等构建的αCD19-CAR NK-92细胞增强了NK细胞的敏感性及其对B系恶性细胞的细胞毒性。
总结
NK细胞是一组独特的抗肿瘤细胞,具备不受MHC限制的细胞毒性,产生细胞因子及参与免疫调节等作用。当它制备成CAR-NK细胞时,相较于CAR-T,它有着多样的细胞来源,无GVHD的风险,不产生CRS及神经毒性,同时具有更强的抗肿瘤作用。同时,NK细胞可从自体或同种异体中制备,因此相较于CAR-T的自体制备,CAR-NK细胞为通用即用型,适用于不同的个体,且可以长期冻存使用。随着未来几年更多的临床试验的开展,CAR-NK细胞治疗可能会导致肿瘤免疫治疗的革命性进展。
王兰艳,罗香凝,王娅婕. CAR-NK细胞的基础研究及临床应用进展[J]. 白血病·淋巴瘤,2024,33(10):632-636.DOI:10.3760/cma.j.cn115356-20231008-00050











 苏公网安备32059002004080号
苏公网安备32059002004080号


