本期精选5篇在2024年10月份发表的结直肠癌领域文献,部分研究邀请到中山大学附属第六医院张剑威教授进行深入解读。
专家介绍
中山大学附属第六医院 肿瘤内科 副主任
中国临床肿瘤学会(CSCO)青年专家委员会委员
中国抗癌协会结直肠肿瘤整合康复专委会 委员
中国抗癌协会肿瘤胃病学专业委员会 委员
广东省医学会肿瘤内科学分会青年委员会 副主任委员
广东省医学教育协会肿瘤学专业委员会常委
广东省研究型医院学会肿瘤内科专委会常委
广东省临床医学学会精准医疗专业委员会委员
广东省医学会肿瘤学分会生物标志学组秘书
Gastroenterology Report 学术委员会委员
Onvansertib联合化疗和贝伐珠单抗二线治疗KRAS突变型转移性结直肠癌:单臂Ⅱ期试验[1]
该项Ⅱ期研究评估了PLK1抑制剂Onvansertib联合FOLFIRI及贝伐珠单抗二线治疗KRAS突变型转移性结直肠癌(mCRC)的疗效和耐受性。这项多中心、开放标签的单臂研究招募了先前接受过奥沙利铂和氟尿嘧啶(有或没有贝伐珠单抗)治疗的KRAS突变型mCRC患者。患者接受Onvansertib(15 mg/m²,每日1次,治疗周期为28天,第1~5天和第15~19天用药)和FOLFIRI+贝伐珠单抗(第1天和第15天)治疗。主要终点是客观缓解率(ORR),次要终点包括无进展生存期(PFS)、缓解持续时间(DOR)和耐受性。此外还进行了KRAS突变型结直肠癌的转化研究和临床前研究。
分析53例接受治疗的患者,结果显示ORR为26.4%(95% CI,15.3%~40.3%),中位DOR为11.7个月(95% CI,9.4个月~未达到)。其中62%的患者报告了3/4级不良事件。事后分析显示,与接受过贝伐珠单抗治疗的患者相比,未接受过贝伐珠单抗治疗的患者ORR显著更高(76.9% vs 10.0%,OR=30.0,P < 0.001),中位PFS显著更长(14.9个月 vs 6.6个月,HR=0.16,P < 0.001)(图1)。转化研究结果也证实了前线贝伐珠单抗暴露与Onvansertib耐药之间的关系。临床前研究显示,Onvansertib抑制了缺氧信号通路并通过与贝伐珠单抗联合后抑制血管生成,展现出强大的抗肿瘤活性。
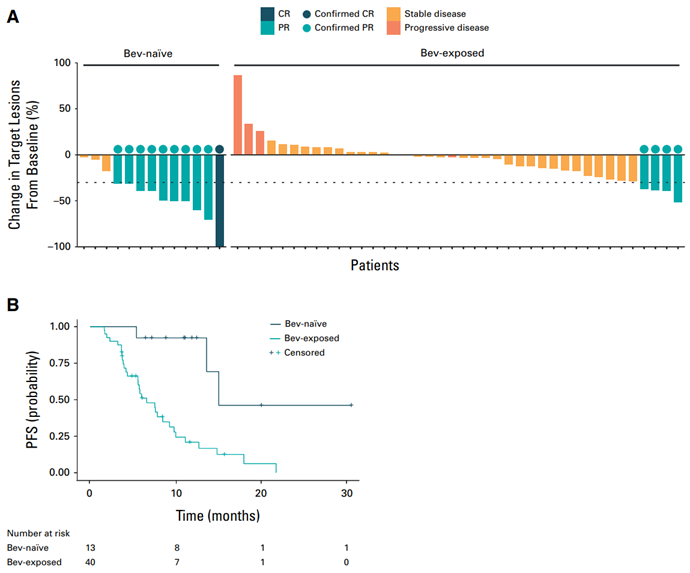
Onvansertib联合FOLFIRI及贝伐珠单抗二线治疗KRAS突变型mCRC患者显示出显著的疗效,特别是对于未接受过贝伐珠单抗治疗的患者。这些发现为该联合方案未来在一线治疗中的探索奠定了基础。(ClinicalTrials.gov编码:NCT06106308)。
张剑威教授:KRAS突变在结直肠癌中发生率达45%,在治疗选择上,一线靶向药物仅有贝伐珠单抗可选,二线治疗是贝伐珠单抗跨线治疗联合化疗,总体预后较差。虽然近年来,针对KRAS G12C这一位点的靶向药物显示出较高的有效率,但KRAS G12C仅占约3%,因此,对于KRAS突变结直肠癌的治疗,仍有较大的未被满足的临床需求。
Onvansertib是一种选择性的PLK1抑制剂,无论是作为单药使用,还是与伊立替康联合应用,在结直肠癌的临床前模型中均显示出强大的抗肿瘤活性。临床前研究揭示了Onvansertib抑制缺氧通路、下调 HIF1a表达,进而减少肿瘤血管生成和增强抗肿瘤活性的机制。此外,在结直肠癌模型中还观察到了 PLK1抑制与KRAS突变之间存在合成致死效应,这提升了针对KRAS突变患者的治疗潜力。
该研究首次评估了Polo样激酶 1(PLK1)抑制剂 Onvansertib 联合标准全身治疗在KRAS突变转移性结直肠癌(mCRC)二线治疗中的应用。为KRAS突变这一难治靶点提供了新的思路和方向,打破了以往该类患者缺乏有效靶向治疗的困境。尤其是在既往未暴露贝伐珠单抗的患者中,ORR高达76.9%,中位PFS达到14.9个月,远远超过以往二线治疗中化疗联合贝伐珠单抗的疗效(ORR约15%,中位PFS 6~7个月)。这一联合策略有显著的抗肿瘤活性,为KRAS突变的患者带来新的治疗希望。
这一组合策略由于需要既往未暴露贝伐珠单抗的治疗才有更好的疗效,因此势必会探索其在一线治疗的疗效,这样才有更广泛的适用人群。在一线治疗中,联合的化疗方案FOLFOX与FOLFIRI是否有相同的疗效仍需要进一步的研究验证。目前已启动该联合策略进入一线治疗的临床研究(NCT06106308),同时探索不同化疗方案的疗效(如图2),若在一线治疗中也能取得良好疗效,将进一步扩大受益患者群体,改变 KRAS 突变 mCRC 的治疗格局。总体而言,本研究为 KRAS 突变 mCRC 的治疗带来了重要突破,具有广阔的应用前景,但仍需要更多的研究来进一步优化和拓展其在临床中的应用。
伊立替康、TAS-102联合贝伐珠单抗作为转移性结直肠癌后线治疗的Ⅱ期研究:一项前瞻性单中心探索性研究[2]
该研究的目的是探讨伊立替康、TAS-102及贝伐珠单抗联合方案后线治疗转移性结直肠癌(mCRC)患者的疗效和安全性。该研究为单中心、Ⅱ期临床试验。符合条件的mCRC患者需经标准的一线和二线治疗后进展,曾在前线维持治疗期间使用伊立替康并出现进展的患者也符合入组条件。主要终点为客观缓解率(ORR)。
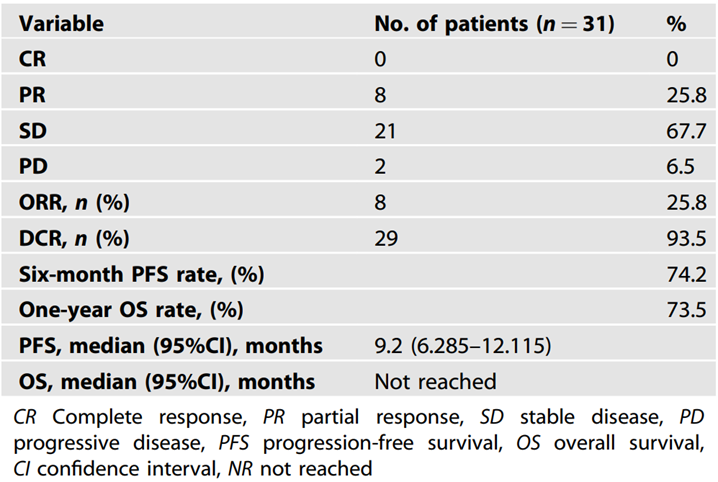
在2022年8月1日至2023年9月30日期间,共招募了35例患者,其中31例患者的疗效可评估。结果显示ORR为25.8%(8/31),疾病控制率(DCR)为93.5%(29/31)。截至2024年4月30日,中位无进展生存期(PFS)为9.2个月(95% CI,6.285~12.115个月),而中位总生存期(OS)尚未达到,1年OS率为73.5%(表1)。最常见的3/4级治疗相关不良事件为中性粒细胞减少(34.3%)、贫血(17.1%)和血小板减少(8.6%)。
表1. 疗效结果
伊立替康、TAS-102及贝伐珠单抗联合治疗作为mCRC患者的后线治疗初步显示出良好的疗效和可耐受的毒性。该方案值得在前线治疗耐药的mCRC人群中进一步探索。
张剑威教授:mCRC的后线治疗选择包括口服TKI(呋喹替尼、瑞戈非尼),和口服化疗药物TAS-102联合或不联合贝伐珠单抗,在SUNLIGHT研究后,TAS-102联合贝伐珠单抗在后线治疗的应用证据也更加充分, PFS较单药TAS-102有显著延长,达5.6个月,OS延长3.3个月,达10.8个月;但总体有效率并不高,仅约6.1%,潜在的不良反应主要是骨髓抑制。
由于mCRC的药物总体仍较有限,在临床实践中,我们需要将前线使用的药物再引入治疗。该研究在后线治疗,将伊立替康再引入,联合TAS-102+贝伐珠单抗,入组条件限定前期未暴露伊立替康或在伊立替康治疗后,维持治疗期间进展。研究纳入的患者,94.3%均在前线已暴露伊立替康,在停伊立替康后维持治疗期间进展,但研究未说明维持治疗超过多长时间,一般来说,停伊立替康进入维持治疗超过3个月,认为前期方案尚未耐药,当然,这个间隔时间越长,再引入有效的机会越大。此外,伊立替康的剂量调整为150mg/m2,降低治疗相关不良反应。
研究纳入31例患者,总体ORR达25.8%,DCR为93.5%,中位PFS 9.2个月,中位OS尚未达到,主要的不良反应仍是骨髓抑制,3/4级中性粒细胞下降达34.3%。在2023年ASCO GI会议上有一项相似的研究(TABAsCO研究NCT04109924)探索了这一组合策略,纳入42例患者,ORR为16%,中位PFS为8.7个月,中位OS为16.5个月,3/4级中性粒细胞下降发生率34%。在后线治疗,虽然我们总体治疗目标是尽可能延长患者生存时间,但对于肿瘤负荷较大或存在肿瘤相关症状的患者,在后线治疗中,能有较好的缩瘤效果,才能更好地同时改善患者生活质量,缓解肿瘤相关症状。因此,这种再引入联合的治疗策略也值得进一步探索。
直肠癌器官保存的风险:来自两家国际直肠癌登记处的数据[3]
对于接受新辅助治疗并达到临床完全缓解(cCR)的直肠癌患者,器官保留已成为全直肠系膜切除术(TME)的一个有力替代方案。近30%的上述患者会出现局部再生(LR)。尽管可采取挽救性切除手术,但后期远处转移(DM)的风险也可能会增加。该研究旨在比较经过观察等待(WW)后出现LR的患者与接受TME后达到近完全病理缓解(near-complete pathologic response,nPCR)的患者,在二次评估缓解情况时发现DM的风险。比较的两组患者分别来自国际观察等待数据库(IWWD)中注册的cCR患者(经过WW管理并随后出现LR),以及来自西班牙直肠癌项目(VIKINGO项目)中接受TME的患者(nPCR定义为残留癌细胞≤10%)。主要终点是从接受WW或TME起3年的无DM生存率。次要终点是与DM相关的潜在风险因素。
508例LR患者与893例TME后nPCR患者进行了比较。总体上,LR患者的DM发生率显著高于接受了TME的患者(22.8% vs 10.2%;P ≤ 0.001)。DM的独立风险因素包括LR(vs TME;P = 0.001)、手术时的ypT3~4状态(P = 0.016)和ypN+状态(P = 0.001)。LR患者的3年无DM生存率显著低于接受了TME的患者(75% vs 87%;P = 0.001)(图3)。按病理分期分层分析发现,LR患者在所有分期中的预后均显著较差(P ≤ 0.009)。
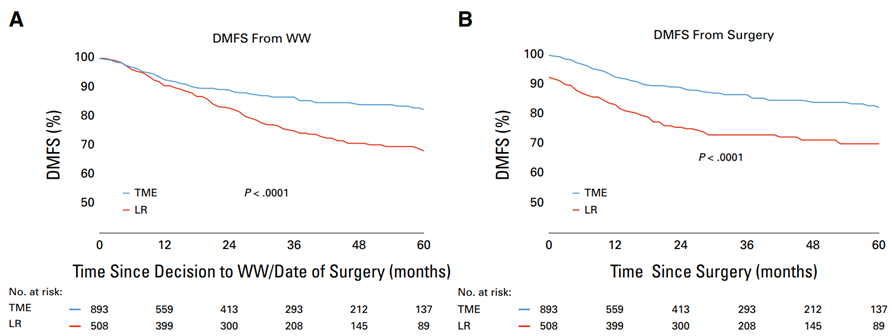
无论最终病理分期如何,LR患者与接受TME的nPCR患者相比均有更大的远期DM发生风险。因此,选择WW从而将未被检测到的原发肿瘤保留至出现LR,可能导致更差的肿瘤学结局。
张剑威教授:直肠癌新辅助治疗的模式经历了长期探索。从AIO-94研究确立了术前新辅助放化疗的地位,降低了局部复发风险并提高了保肛手术的成功率;到后续研究致力于减少远处转移风险,尝试通过强化术前药物治疗引入奥沙利铂,尽管多数研究未能获得阳性结果。目前,全直肠系膜切除术(TNT)模式已成为局部进展期直肠癌的首选推荐,即在放化疗后进行巩固化疗或在诱导化疗后进行放化疗,使病理完全缓解(pCR)率达到25%~30%。
随着新辅助治疗中pCR率的提升,我们在追求疗效的同时,也应关注患者生活质量的改善,逐步重视器官功能的保护,因此提出了“等待观察”(Watch and Wait, WW)的理念。对于那些通过新辅助治疗达到cCR的患者,可以考虑采用WW策略,并进行积极的监测和随访,以更好地保护肛门功能。若出现局部再生(local regrowth),再进行挽救性手术也是可行的,但这一策略的安全性需要长期随访来进一步验证。
本研究通过比较国际观察等待数据库(IWWD)中注册的cCR患者(经WW管理后出现局部再生)与西班牙直肠癌项目(VIKINGO项目)中接受TME治疗的患者(nPCR定义为残留癌细胞≤10%),揭示了WW策略的潜在风险,即一旦发生局部再生,即使可以进行挽救性切除手术,患者后期远处转移(DM)的风险也可能增加。
随着治疗目标转向追求cCR,WW策略成为可能的选择,但当前面临的主要挑战是cCR的评估标准和准确性。cCR并不等同于pCR,对于评估为cCR但实际上仍有肿瘤残留的患者,若选择WW直至出现局部再生,可能导致更糟糕的肿瘤学结果。鉴于评估cCR的挑战,我们需要收紧评估标准,或开发更精确的生物标志物和影像学技术,以提高cCR评估的准确性。这将有助于更准确地选择适合WW策略的患者,实现器官功能保护与疗效的双重目标。
在免疫治疗时代,将免疫治疗纳入术前新辅助治疗,确实观察到了更高的pCR率。目前Ⅲ期研究(如UNION研究)的数据显示,短程放疗后,化疗联合免疫巩固治疗的pCR率达到39.8%,我们需要等待3年无病生存(DFS)结果,以评估pCR率的提高是否转化为生存获益。此外,免疫治疗后cCR的评估也无统一标准,存在一定的主观性,但新的策略若能进一步提高pCR率,那么cCR的概率也更高,这种WW策略的安全性也有可能提高。
然而,在当前的临床实践中,采取WW策略需要进行充分的风险知情沟通,了解这一策略的潜在风险和好处,包括局部再生和远处转移的可能性,并基于患者个体情况进行决策。
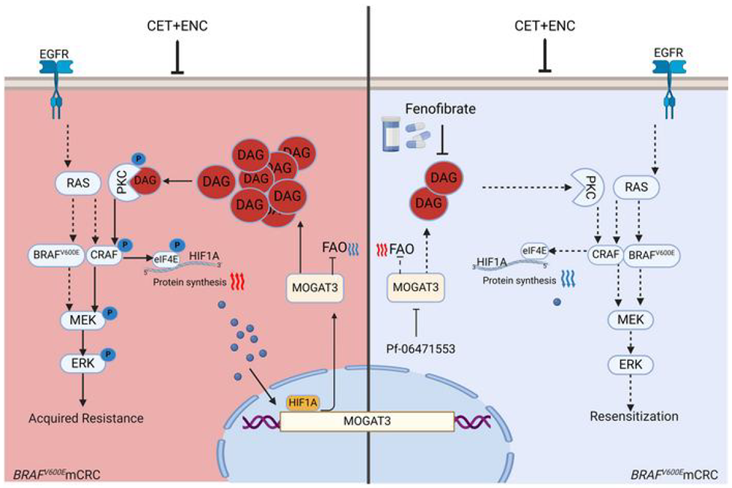
MOGAT3介导的DAG累积驱动BRAF V600E突变型转移性结直肠癌对抗BRAF/EGFR治疗的获得性耐药[4]
BRAF V600E突变的转移性结直肠癌(mCRC)预后较差。抗BRAF/EGFR(康奈非尼/西妥昔单抗)联合治疗可改善BRAF V600E突变的mCRC患者的临床获益。不幸的是,无法避免的获得性耐药限制了治疗的效果,且耐药机制尚未明确。该研究发现单酰基甘油O-酰基转移酶3(MOGAT3)介导的二酰基甘油(DAG)积累导致了对康奈非尼/西妥昔单抗治疗的获得性耐药,这一发现是通过分析暴露于康奈非尼/西妥昔单抗治疗的异种移植(PDX,来源于BRAF V600E突变的mCRC患者)模型得出的。
从机制来看,上调的MOGAT3促进DAG合成并减少脂肪酸氧化(FAO),导致DAG积累并激活PKCα-CRAF-MEK-ERK通路,进而驱动获得性耐药。耐药引起的缺氧促进了MOGAT3在转录水平的上升,同时MOGAT3介导的DAG积累通过PKCα-CRAF-eIF4E激活在翻译水平上增加了HIF1A的表达,进一步强化了耐药状态。有趣的是,通过非诺贝特或Pf-06471553减少肿瘤内的DAG,能够恢复康奈非尼/西妥昔单抗对耐药的BRAF V600E突变型mCRC患者的抗肿瘤效能,并阻断PKCα-CRAF-MEK-ERK信号通路(图4)。
这些发现揭示了关键代谢产物DAG作为调节因子影响康奈非尼/西妥昔单抗治疗BRAF V600E突变型mCRC的疗效,同时提示非诺贝特可能对耐药的BRAF V600E突变型mCRC患者有获益帮助。
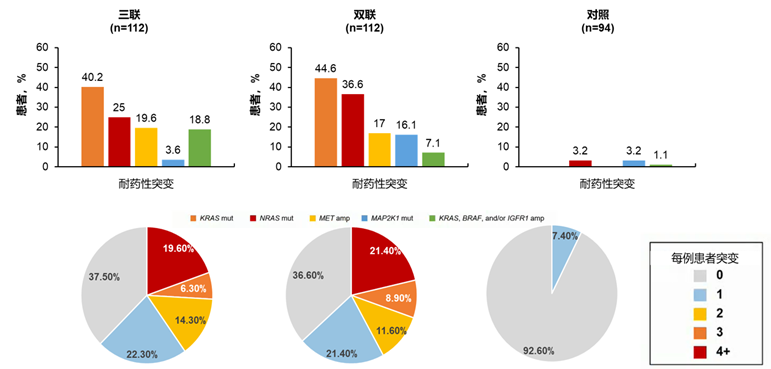
张剑威教授:BRAF突变肠癌发生率8%~10%,这部分患者总体预后较差,目前一线治疗考虑三药联合贝伐珠单抗,后线治疗采用BRAF抑制剂联合EGFR单抗。在靶向治疗后,仍不可避免地出现耐药进展的情况,而且不管是双靶联合还是三靶联合(同时联合MEK抑制剂),中位PFS均为5个月左右。前期BEACON研究同时收集了耐药后的ctDNA检测,对于暴露三靶联合和双靶联合治疗后,主要的耐药原因是出现KRAS突变或NRAS突变或MET扩增,在三靶联合治疗中,出现更多的KRAS/BRAF/IGFR1扩增,而在双靶联合治疗中,MAP2K1突变较多;此外,靶向治疗耐药后,患者可以同时存在多个耐药基因,导致后续治疗没有特别可针对性的靶点,治疗难度更大,肿瘤进展快。这也是BRAF突变肠癌预后差的原因之一。
该研究通过PDX模型,发现抗BRAF/EGFR治疗耐药与脂质代谢上调相关,最后发现,MOGAT3介导的DAG积累在BRAF V600E突变mCRC对抗BRAF/EGFR治疗的获得性耐药中起关键作用,耐药诱导的缺氧促进MOGAT3介导的DAG积累,驱动PKCα-CRAF-MEK激活,同时积累的DAG通过 PKCα/CRAF/eIF4E/HIF1A信号激活增强耐药状态。非诺贝特联合康奈非尼/西妥昔单抗的三联疗法可提高治疗效率,为克服耐药提供了潜在策略。通过基础研究发现代谢相关耐药机制,提出了新的克服耐药的策略,但在临床患者中是否真正有效还有待验证。
结直肠癌肝转移患者生物学靶点多维推荐系统[5]
当前,理解肿瘤转移的分子机制并识别出肿瘤治疗的关键生物标志物日益重要。单组学分析因其只关注于单一生物学层面的局限,无法充分阐明肿瘤分子特征的复杂性,因此可能忽视关键的分子靶点。针对这一问题,研究人员开发了一种基于多组学知识图谱的多维推荐系统(RJH-Metastasis 1.0),整合了基因组、转录组和蛋白质组学的数据及相关文献证据,并对结直肠癌肝转移(CRCLM)进行了全面分析(图6)。
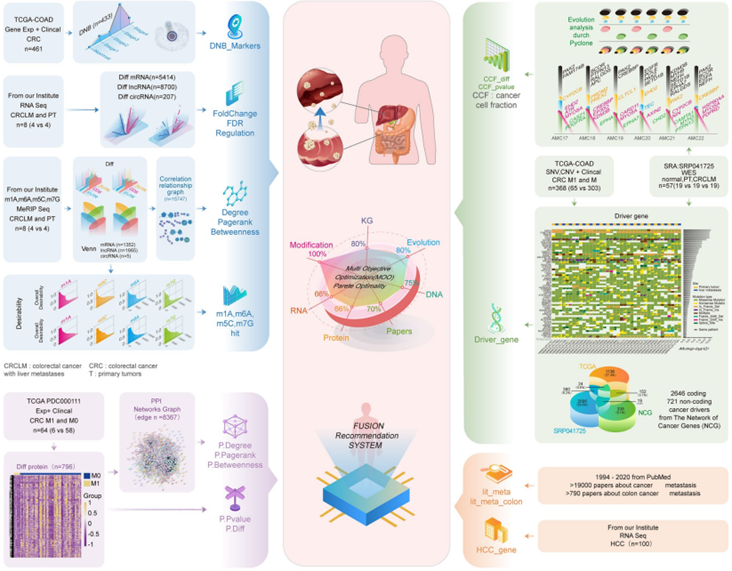
RJH-Metastasis 1.0整合了跨越四个维度的多组学数据——RNA表达、蛋白质表达、DNA表达和文献证据,以计算和识别优化的基因集合。这种综合方法通过各种数据类型之间的协同作用,提高了所选基因靶点的准确性和相关性,结合了来自不同生物层面的证据和广泛的文献。RJH-Metastasis 1.0旨在提供对肿瘤转移背后分子机制的整体理解,促进潜在治疗靶点和CRCLM生物标志物的发现。
该系统推荐了25个与CRCLM显著相关的关键基因,其中对GNB1、GATAD2A、GBP2、MACROD1和EIF5B给予了进一步关注。例如,CRCLM患者中GNB1基因的突变较少见,但其RNA转录和蛋白表达水平却高于正常水平。通过分析GNB1促进结肠癌细胞恶性行为的体外和体内研究报道,GNB1的异常表达可能通过METTL1驱动的m7G修饰来进行调控。METTL1的敲除降低了GNB1基因3' UTR端的m7G修饰,从而在肝转移过程中增加了GNB1 mRNA的转录和翻译。此外,通过促进记忆B细胞与KLRB1+PD-1+CD8+细胞之间发生的CLEC2C-KLRB1相互作用,GNB1还诱导了免疫抑制微环境的形成。GNB1的表达与CRCLM患者接受基于PD-1单抗治疗的疗效显著相关。
总之,该推荐系统可有效探索结直肠癌中的关键分子,其中GNB1被确定为一个重要的CRCLM驱动因子和结直肠癌免疫治疗的生物标志物。
本期看点:
1、一项单臂Ⅱ期研究,结果展现出Onvansertib联合FOLFIRI及贝伐珠单抗二线治疗KRAS突变型mCRC患者的显著疗效,特别是对于未接受过贝伐珠单抗治疗的患者。
2、 一项单中心Ⅱ期研究,结果初步显示出伊立替康、TAS-102及贝伐珠单抗的联合治疗作为mCRC患者后线治疗的良好疗效和可耐受的毒性。
3、一项基于国际数据库的比较分析,探讨了在观察等待期间出现局部复发与接受手术的近完全病理缓解患者之间发生远处转移的风险差异,结果发现前者比例显著更高,并进一步分析了独立风险因素。
4、一项基础研究,揭示了关键代谢产物DAG作为调节因子影响康奈非尼/西妥昔单抗治疗BRAF V600E突变型mCRC疗效的作用机制,同时提示了非诺贝特可能恢复耐药的BRAF V600E突变型mCRC患者对康奈非尼/西妥昔单抗治疗的敏感性。
5、一种基于多组学知识图谱的多靶标推荐系统,整合了跨越四个维度的多组学数据——RNA表达、蛋白质表达、DNA表达和文献证据,可有效探索结直肠癌中的关键分子,促进潜在治疗靶点和CRLM生物标志物的发现。
[1] AHN DH, RIDINGER M, CANNON TL, et al. Onvansertib in Combination With Chemotherapy and Bevacizumab in Second-Line Treatment of KRAS-Mutant Metastatic Colorectal Cancer: A Single-Arm, Phase II Trial. J Clin Oncol. 2024 Oct 30:JCO2401266.
[2] LI B, YANG W, LIU N, et al. Phase II Study of Irinotecan, Trifluridine/tipiracil (TAS-102) plus Bevacizumab as a Later-line Therapy for Patients with Metastatic Colorectal Cancer (mCRC): a prospective single-center explorative study. Br J Cancer. 2024 Oct 24.
[3] FERNANDEZ LM, SÃO JULIÃO GP, SANTACRUZ CC, et al. Risks of Organ Preservation in Rectal Cancer: Data From Two International Registries on Rectal Cancer. J Clin Oncol. 2024 Oct 28:JCO2400405.
[4] WANG J, WANG H, ZHOU W, et al. MOGAT3-Mediated DAG Accumulation Drives Acquired Resistance to Anti-BRAF/EGFR Therapy in BRAF V600E-Mutant Metastatic Colorectal Cancer. J Clin Invest. 2024 Oct 22:e182217.
[5] QI F, GAO N, LI J, et al. A multidimensional recommendation framework for identifying biological targets to aid the diagnosis and treatment of liver metastasis in patients with colorectal cancer. Mol Cancer. 2024 Oct 24;23(1):239.
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


