在结直肠癌的治疗领域,近年来取得了显著进展,特别是在精准治疗和个体化医疗方面。为了深入探讨这一领域的最新研究动态,山东大学齐鲁医院肿瘤内科王健教授在“齐肿内科大查房”第153期的“广智论坛”栏目中,解读了多项近期发表的重磅研究。这些研究涵盖了液体活检在转移性结直肠癌治疗中的应用、HER2阳性结直肠癌的创新药物疗法、以及新辅助治疗策略等,展示了多种新兴治疗手段的潜力与挑战。通过对这些前沿研究的分析,我们可以更好地理解结直肠癌的治疗趋势,并为临床实践提供重要参考。【肿瘤资讯】整理该报告要点,以飨读者。
CAPRI2-GOIM研究:液体活检指导转移性结直肠癌治疗
CAPRI2-GOIM研究是一项在意大利开展的多中心II期临床试验,旨在探索液体活检(ctDNA)全基因组检测在RAS/BRAF野生型转移性结直肠癌患者中的应用价值。
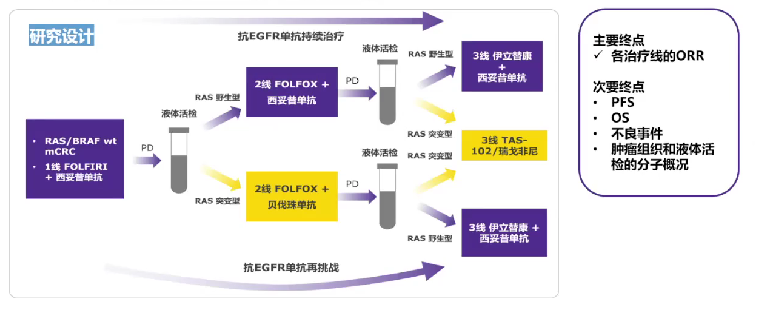
研究共招募205例组织学基因检测RAS/BRAFV600E野生型mCRC患者,一线治疗接受FOLFIRI加西妥昔单抗治疗。治疗进展后,进行ctDNA液体活检,如果仍为RAS/BRAF野生型,则二线治疗继续使用抗EGFR单抗联合化疗。
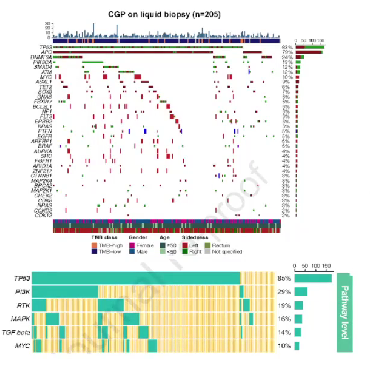
研究结果显示,ctDNA液体活检与组织检测之间具有较高的一致性(图2)。共检测到1013个基因组变异,最常见的包括TP53(83%)、APC(79%)、SMAD4(12%)、ATM(12%)和MYC(10%)等。此外,还观察到185个基因拷贝数变异,其中22个与EGFR单抗耐药相关,例如FGFR1扩增、ERBB2扩增、MET扩增和PTEN缺失等。此外,ctDNA脱落水平和肿瘤转移部位数量相关(图3)。

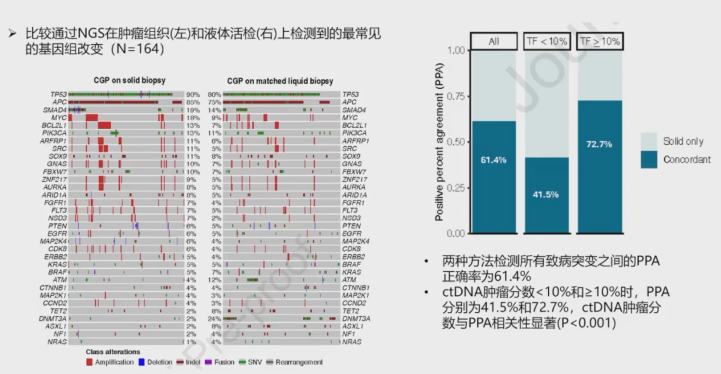
ctDNA基因检测与组织NGS检测结果高度一致,所有致病突变的符合率达到61.4%。当ctDNA肿瘤分数≥10%时,符合率升高至72.7%;当ctDNA肿瘤分数<10%时,符合率降至41.5%(图4)。在识别抗EGFR单抗耐药基因突变方面,两种方法的总符合率为83%。ctDNA肿瘤分数≥10%时,符合率高达91.5%;ctDNA肿瘤分数<10%时,符合率为72.3%(图5)。

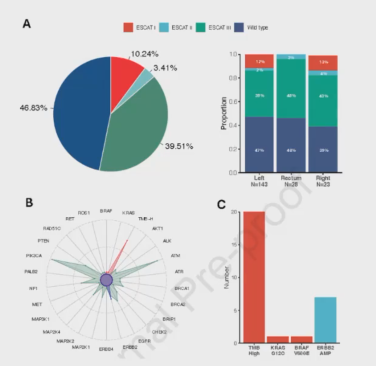
根据ESCAT量表进行的基因组改变分类显示,在基线时,205例经组织学确诊的RAS/BRAF野生型患者中,有109例(>50%)通过ctDNA检测发现了ESCAT I-III类的基因组改变,其中包括20例高肿瘤突变负荷(TMB-H)、1例BRAFV600E突变、1例KRASG12C突变和6例ERBB2基因扩增(图6)。
这项研究表明,基于液体活检的综合基因组分析(CGP)在mCRC中是可行的,ctDNA液体活检与组织基因组检测的一致性良好,可以更好地捕捉肿瘤异质性,为患者提供更全面的基因组信息。此外通过液体活检的CGP发现,近一半RAS/BRAFV600E野生型mCRC患者存在ESCAT I-III类基因组改变,这些基因突变可能对抗EGFR单抗的持续应用具有指导意义,具有潜在的临床价值。
DESTINY-CRC02研究:德曲妥珠单抗治疗HER2阳性晚期结直肠癌
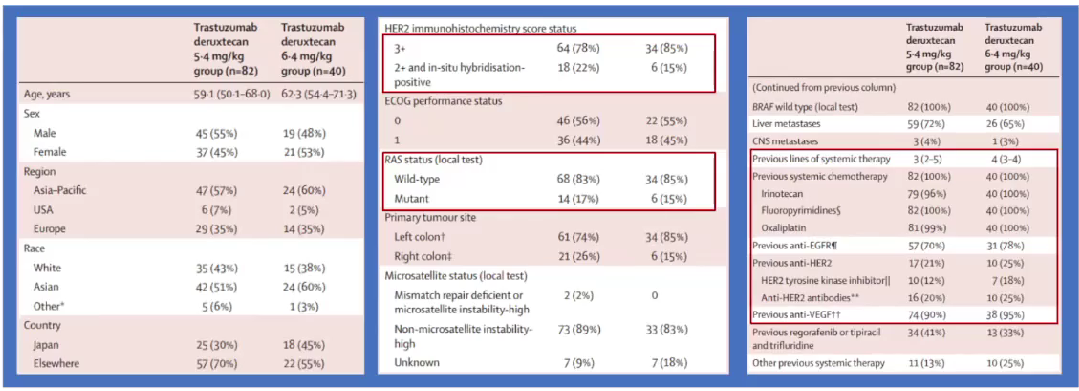
DESTINY-CRC01研究显示,德曲妥珠单抗(T-DXd)6.4 mg/kg对HER2阳性mCRC癌患者有较好的抗肿瘤活性。DESTINY-CRC02研究进一步探索了两种剂量(5.4 mg/kg和6.4 mg/kg)T-DXd对HER2阳性mCRC患者的疗效(图7)。
本研究纳入的患者群体具有以下基线特征:约80%的患者HER2表达状态为免疫组化(IHC)3+,超过80%的患者为RAS野生型。既往治疗方面,5.4 mg/kg和6.4 mg/kg剂量组的患者中位既往治疗线数分别为3线和4线,所有患者均接受过系统性化疗,约70%接受过抗EGFR单抗治疗,约20%接受过抗HER2治疗,近90%接受过抗VEGF治疗(图8)。
主要终点客观缓解率(ORR)显示,5.4 mg/kg剂量组的ORR达到37.8%,而6.4 mg/kg剂量组的ORR为27.5%。疾病控制率(DCR)方面,5.4 mg/kg剂量组为86.6%,6.4 mg/kg剂量组为85%,与2023年ASCO会议上公布的数据一致(图9)。
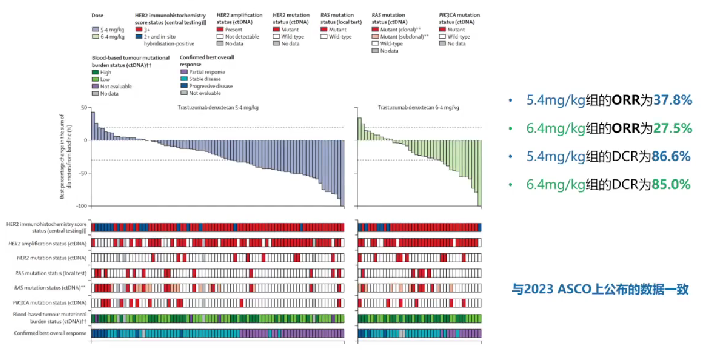
亚组分析显示,5.4 mg/kg剂量组中HER2 IHC 3+患者的ORR高达46.9%,显著优于HER2 IHC 2+患者(图10)。5.4 mg/kg和6.4 mg/kg剂量组的中位无进展生存期(PFS)分别为5.8个月和5.5个月,中位总生存期(OS)分别为13.4个月和未达到(图11)。


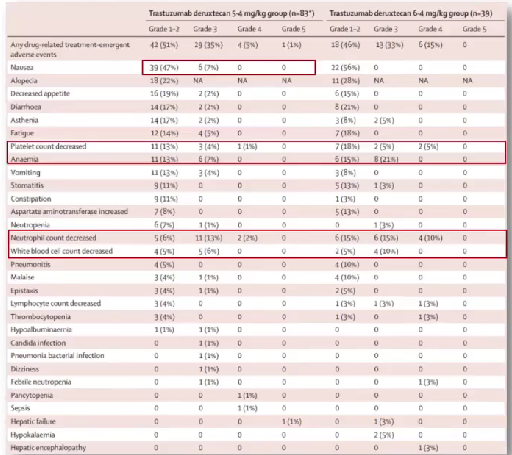
在安全性方面,5.4 mg/kg和6.4 mg/kg剂量组≥3级不良事件(AE)发生率分别为41%和49%,最常见≥3级AE包括中性粒细胞减少、贫血和恶心。5.4 mg/kg剂量组有1例患者出现治疗相关死亡(肝功能衰竭)(图12)。
本研究中,6.4 mg/kg剂量组的ORR为27.5%,低于DESTINY-CRC01研究中的45.3%。这可能是因为DESTINY-CRC01研究仅纳入了RAS野生型患者,而本研究纳入了RAS突变患者。本研究中 RAS 突变患者的ORR为32.4%,仍低于DESTINY-CRC01研究。此外,本研究6.4 mg/kg剂量组的患者ECOG评分为1分的比例高于DESTINY-CRC01研究(45% VS 30%)。
此外,本研究存在一些局限性,例如HER2 IHC 2+患者的样本量较小,以及主要分析时PFS和OS数据尚不成熟等。尽管存在这些局限性,本研究结果仍为T-DXd在HER2阳性mCRC患者中的应用提供了重要证据,尤其是5.4 mg/kg剂量组的疗效和安全性结果,可为后续III期临床试验提供参考。
替雷利珠单抗联合治疗难治性转移性结直肠癌
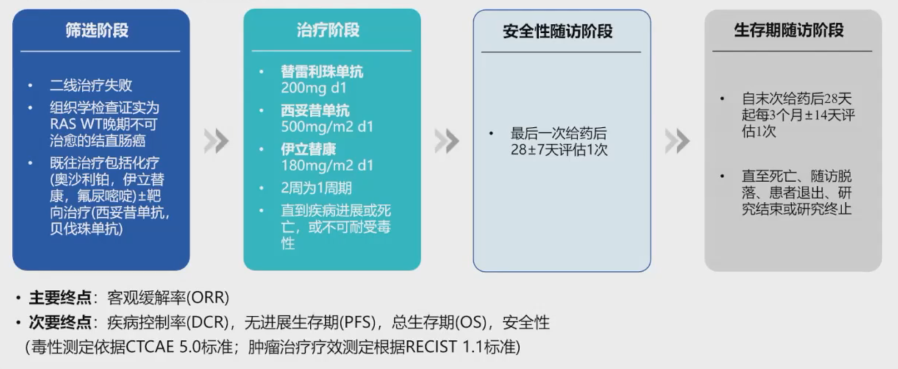
为了探索替雷利珠单抗联合西妥昔单抗和伊立替康单抗治疗难治性、微卫星稳定型和RAS野生型mCRC患者的疗效,开展了一项单臂II期临床试验。该试验纳入的患者均为既往至少接受过两线治疗失败的RAS野生型mCRC患者,所有患者接受替雷利珠单抗联合西妥昔单抗和伊立替康治疗,主要研究终点为ORR(图13)。
共33名患者至少接受了一个周期的治疗,其中22名患者至少接受过三线治疗失败。其中79%的患者既往接受过抗VEGF治疗,88%的患者既往接受过抗EGFR单抗治疗,所有患者既往均接受过伊立替康治疗(图14)。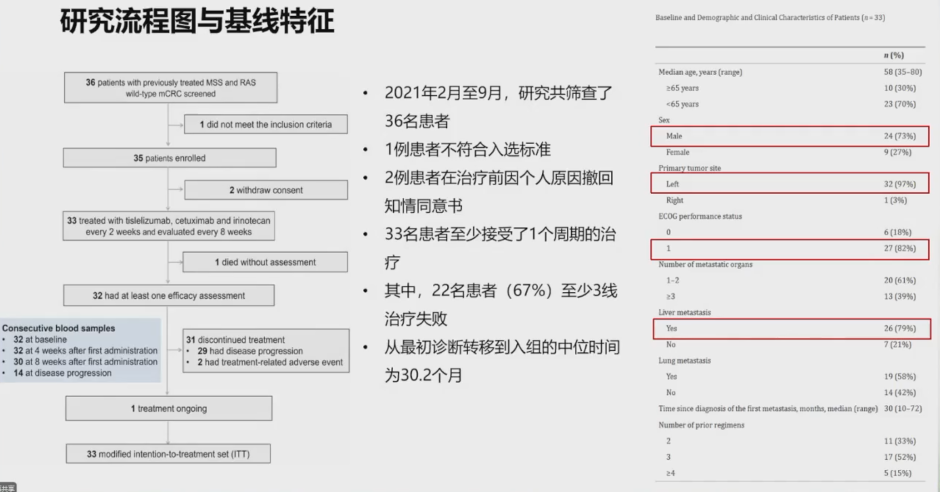
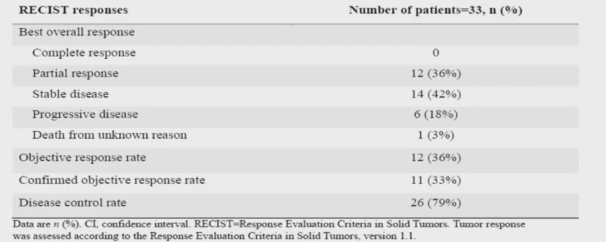
疗效评估方面,33名患者中,12名(36%)达到影像学部分缓解(PR),14名达到疾病稳定(SD),最终11名(33%)达到确认的PR,疾病控制(DCR)为79%(图15)。73%的患者观察到肿瘤缩小。达到确认PR的患者中位缓解持续时间为6.2个月,PFS为7.3个月,中位OS为17.4个月(图16)。
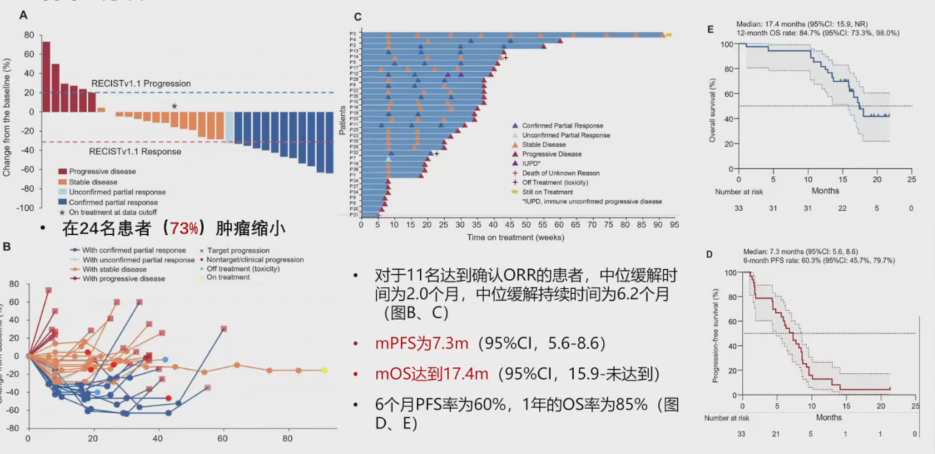
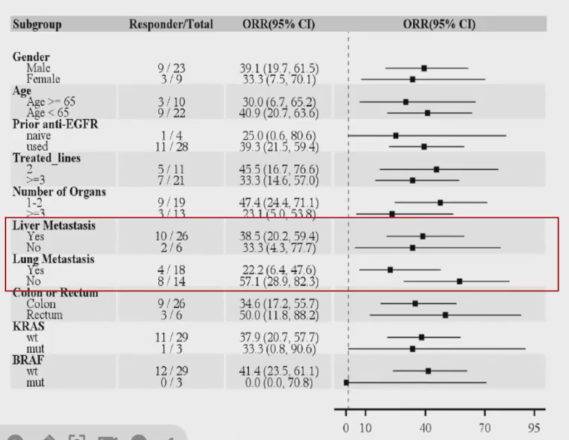
亚组分析结果显示,肝转移患者与无肝转移患者的ORR相当(38.5% vs 33.3%),但肝转移患者的PFS有缩短趋势(6.1个月 vs 8.6个月),但由于样本量较小,差异未达到统计学意义。无论是否存在肺转移,患者的中位PFS均无显著差异(有肺转移:6.8个月 vs 无肺转移:7.3个月)。然而,无肺转移患者的ORR显著高于有肺转移患者(57% vs 21.1%)(图17)。安全性方面,大部分治疗相关不良事件(AE)为1~2级。免疫治疗相关AE包括甲亢、甲减、皮炎和心肌炎,经激素治疗后均得到改善。
此外,研究还发现基线ctDNA水平较低的患者OS更长,治疗后ctDNA水平下降的患者OS高于ctDNA水平无变化或升高的患者。基线时存在RAS/BRAF突变的患者中位OS和PFS均显著缩短(图18)。蛋白质组学分析发现,无进展患者基线时免疫相关蛋白标志物水平升高,且与ctDNA水平呈负相关。基于血浆免疫蛋白组学建立了一个评分系统,发现蛋白评分高的患者生存概率更高(HR = 0.306)。
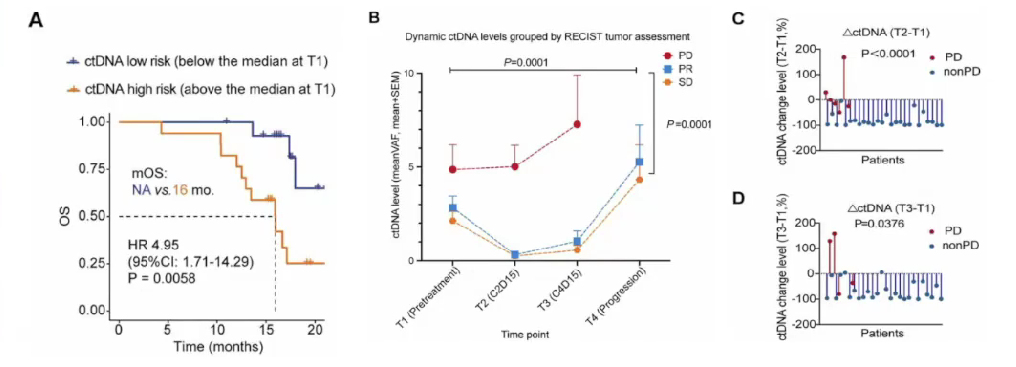
在本研究中,对于难治性RAS野生型转移性结直肠癌患者,替雷利珠单抗联合西妥昔单抗和伊立替康单抗治疗方案可取得33%的ORR,中位PFS为7.3个月,中位OS为17.4个月。基线ctDNA水平较低且免疫肿瘤蛋白水平较高的患者有望获得更好的疗效。
UNICANCER-PRODIGE 23试验:局部晚期直肠癌新辅助化疗
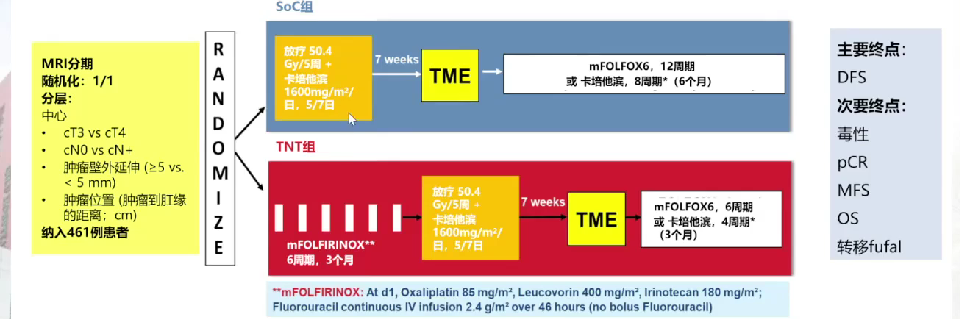
该研究比较了两种不同的治疗方案:标准治疗组采用短程放疗联合卡培他滨化疗(放化疗),随后进行TME手术,最后进行mFOLFOX6方案的术后辅助化疗;而新辅助化疗组则首先进行mFOLFIRINOX方案的术前新辅助化疗,再进行短程放化疗和TME手术,最后同样进行mFOLFOX6方案的术后辅助化疗。两种方案的主要区别在于是否在术前增加了mFOLFIRINOX方案的新辅助化疗(图19)。
研究结果显示,新辅助化疗组的5年DFS显著高于标准治疗组(73.1% vs 65.5%)。此外,新辅助化疗组的无转移生存率(MFS)和OS也均优于标准治疗组。两组的局部复发率相似,但新辅助化疗组的远处转移发生率更低(图20)。
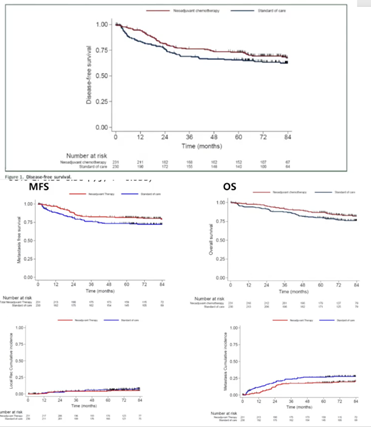
研究结果表明,对于局部晚期直肠癌患者,术前采用mFOLFIRINOX方案进行新辅助化疗可以改善OS,并带来持续的DFS和MFS获益,且不影响局部控制率。因此,mFOLFIRINOX方案新辅助化疗是局部晚期直肠癌患者的良好治疗选择之一。
TORCH试验:局部晚期直肠癌新辅助免疫治疗
TORCH研究是一项前瞻性,多中心、随机II期临床研究,纳入临床II期(T3-4NOMO)或III期(T任何N1-2M0)的LARC患者(距肛门边缘<12cm)患者,1:1随机分配至巩固治疗组(A组)或诱导治疗组(B组)(图21)。

中位随访19个月后,A组和B组的CR率分别为56.5%和54.2%,均达到主要研究终点,且两组之间无显著差异。A组在新辅助治疗结束时的临床完全缓解率(cCR)更高(43.5% vs 35.6%)。此外,两组患者的主要病理缓解(MPR)率均较高,A组为67.5%,B组为76%(图22)。两组手术患者的病理缓解情况良好,A组和B组的MPR率分别为67.5%和70.6%。
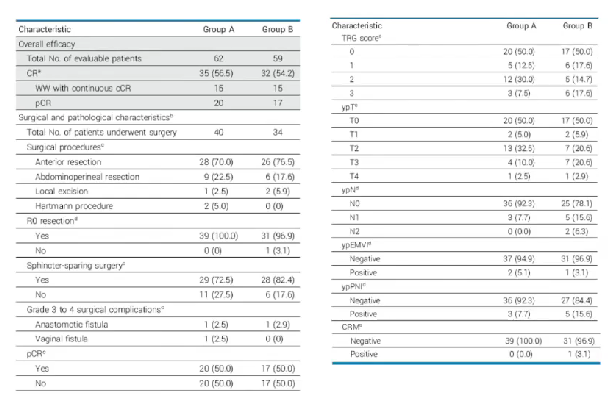
该研究表明,在全程新辅助治疗中加入免疫治疗的iTNT模式,对局部晚期直肠癌患者(包括pMMR和MSS)具有可接受的毒性,并且能够使超过半数的患者达到CR。这为局部晚期直肠癌的治疗提供了新的思路和策略。未来,期待更大规模的III期临床试验能够进一步验证该结论,并为临床实践提供更充分的证据。
王健教授的精彩报告不仅呈现了结直肠癌治疗领域的最新临床研究成果,还深入探讨了基础研究的突破性进展。这些研究成果为临床医生提供了更多治疗选择和决策依据,也为广大结直肠癌患者带来了新的希望。期待未来有更多创新研究涌现,推动结直肠癌治疗迈向更加精准、高效的新时代。
1. Ciardiello D, et. al. Comprehensive genomic profiling by liquid biopsy captures tumor heterogeneity and identifies cancer vulnerabilities in patients with RAS/BRAFV600E wild-type metastatic colorectal cancer in the CAPRI 2-GOIM trial. Ann Oncol. 2024 Aug 29:S0923-7534(24)03914-0.
2. Raghav K, et. al. Trastuzumab deruxtecan in patients with HER2-positive advanced colorectal cancer (DESTINY-CRC02): primary results from a multicentre, randomised, phase 2 trial. Lancet Oncol. 2024 Sep;25(9):1147-1162.
3. Xu X, et. al. Tislelizumab plus cetuximab and irinotecan in refractory microsatellite stable and RAS wild-type metastatic colorectal cancer: a single-arm phase 2 study. Nat Commun. 2024 Aug 23;15(1):7255.
4. Conroy T, et. al. Total neoadjuvant therapy with mFOLFIRINOX versus preoperative chemoradiotherapy in patients with locally advanced rectal cancer: long-term results of the UNICANCER-PRODIGE 23 trial. Ann Oncol. 2024 Oct;35(10):873-881.
5. Xia F, et. al. Randomized Phase II Trial of Immunotherapy-Based Total Neoadjuvant Therapy for Proficient Mismatch Repair or Microsatellite Stable Locally Advanced Rectal Cancer (TORCH). J Clin Oncol. 2024 Oct;42(28):3308-3318.
排版编辑:肿瘤资讯-Kingsley
版权声明











 苏公网安备32059002004080号
苏公网安备32059002004080号


