Claudin 18.2(CLDN18.2)作为备受期待的新靶点,其过表达与胃癌及其他实体瘤不良预后相关,是个体化治疗的关键生物标志物。2024年欧洲肿瘤内科学会(ESMO)年会上公布了胃癌/胃食管交界处癌(GC/GEJC)患者以及胰腺癌中CLDN18.2过表达的研究进展。
复旦大学附属肿瘤医院病理科,主任医师,博士生导师
中华医学会病理学分会消化疾病学组副组长
中国抗癌协会肿瘤病理专业委员会胃肠肿瘤协作组(学组)组长
中国抗癌协会肿瘤病理专业委员会肝脏疾病协作组(学组)委员
中国抗癌协会胰腺癌专业委员会神经内分泌肿瘤学组委员
中国抗癌协会肿瘤药物临床研究专业委员会委员
中国临床肿瘤学会(CSCO)胃癌专家委员会常务委员
中国研究型医院学会病理学专业委员会委员
中国医师协会外科医师分会MDT专委会委员兼副秘书长
国家卫健委MDT专家委员会委员
上海市抗癌协会肿瘤病理专业委员会副主任委员兼秘书长
上海市医师协会病理科医师分会委员会秘书长
上海市抗癌协会大肠癌专业委员会委员
上海市抗癌协会淋巴瘤专业委员会委员等
Claudin 18.2的基本介绍
Claudin 18.2是紧密连接蛋白家族成员,存在于正常胃粘膜细胞,也可能在肺、食管、胰腺和胃肿瘤细胞中表达,对维持细胞极性、调节胃酸通透性和屏障功能等起重要作用。
癌症转移过程中,上皮 - 间质转化(EMT)是关键步骤,肿瘤细胞经此获得间质表型,迁移、侵袭和抗凋亡能力增强,同时上皮细胞标志物丢失,增加迁移能力和转移风险1。上皮细胞间连接由紧密连接(TJs)、桥粒、缝隙连接和黏附连接等结构介导,紧密连接结合特性丧失是EMT第一步1。紧密连接由细胞膜上的内源性蛋白质组成,包括27种claudins(CLDNs),它们影响上皮细胞层的通透性、极性和细胞迁移。CLDNs结构由N端和C端区域、两个细胞外环和四个跨膜结构域组成,位于细胞膜顶端区域,可促进细胞粘附、维持细胞极性,允许细胞迁移、基质重塑和细胞增殖,在选择性旁细胞通透性中也有重要作用,缺乏CLDN表达可能与转移性肿瘤细胞迁移和浸润增加有关,多种癌症中CLDNs常过表达,与较高转移风险相关[1]。
正常胃粘膜中,CLDN1 - 5、CLDN7 - 12、CLDN16和CLDN18组成性表达。胃癌中,CLDN18因在胃细胞中正常表达及在胃肿瘤细胞中稳定表达而受关注。CLDN18基因有两个剪接变体:CLDN18.1在正常和肺癌细胞中表达;CLDN18.2几乎仅在正常胃粘膜细胞中存在,但也可能在肺、食管、胰腺和胃肿瘤细胞中表达。CLDN18.2存在于紧密连接中,通过调节胃酸中Na⁺和H⁺的通透性,保持细胞极性和屏障功能,并促进对胃酸的抵抗。胃粘膜正常上皮细胞向胃癌转化时,CLDN18.2表位暴露,成为潜在治疗靶点[1]。
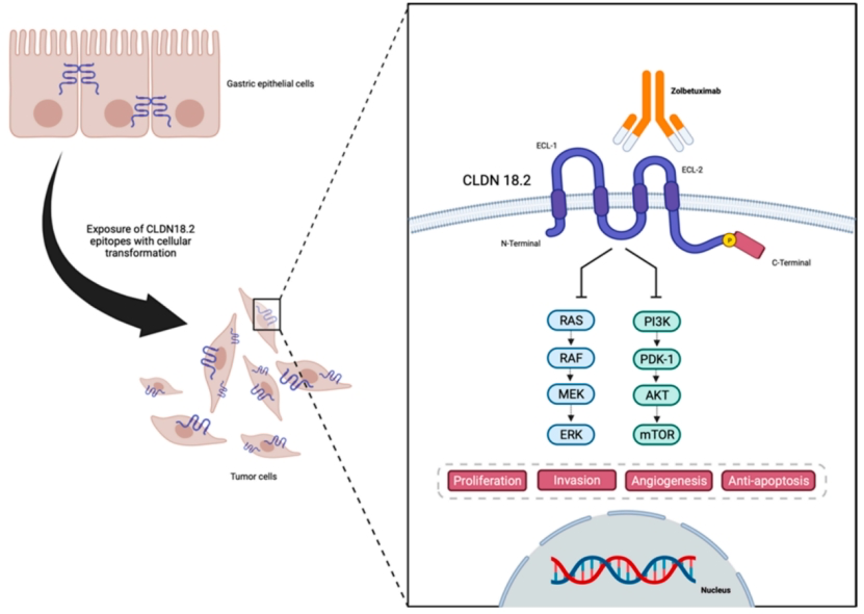
CLDN18.2在胃癌细胞中的表达、结构及与抗CLDN18.2 Zolbetuximab的相互作用
Claudin 18.2靶向治疗的临床进展
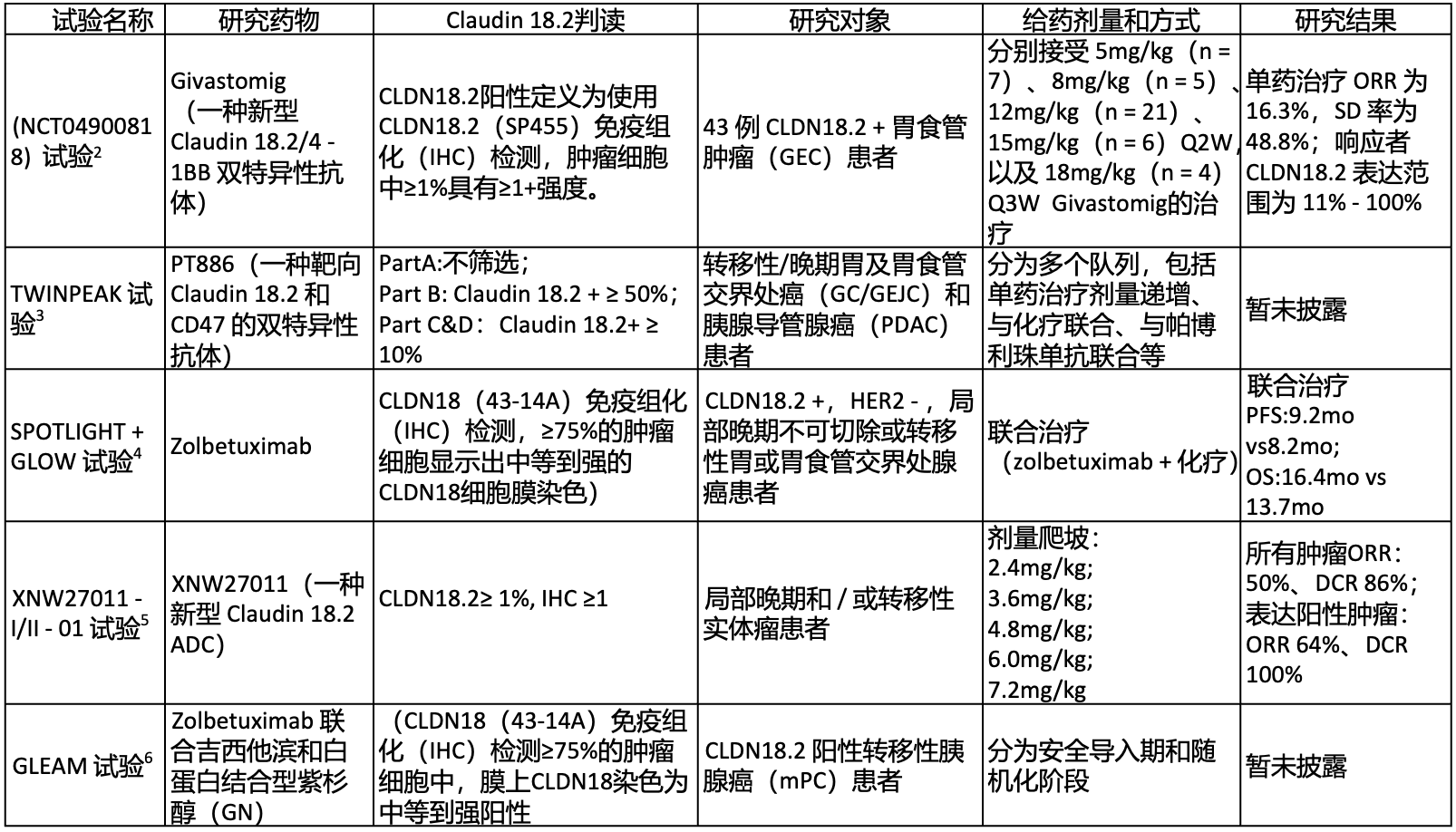
Claudin 18.2作为胃癌(GC)治疗靶点受广泛关注,多项临床研究正在开展,ESMO大会披露如下数据:
专家点评
(一)CLDN18.2在胃癌中的表达及相关特征
1. 表达与临床病理特征和预后的关联
CLDN18在正常胃组织中高度表达,在胃癌中约58%病例显著下调,肠型胃癌中可达74%,在胃癌细胞中比周围胃和肠化生粘膜更明显,可能与胃癌进展、增殖及浸润相关。早期胃癌组织研究显示,侵袭前沿的Ki67增殖指数与CLDN18表达呈负相关,但CLDN18持续表达的肿瘤患者比表达缺失患者总生存期更长[1]。
尽管CLDN18下调与胃癌增殖有关,但42.2%的胃癌表现出强免疫组化(IHC)染色,与粘蛋白表型和EBV状态相关,但与生存和其他临床病理特征无关。
2. 在不同分子亚型胃癌中的表达
胃癌分子亚型包括EBV阳性、微卫星不稳定(MSI)、基因组稳定(GS)和染色体不稳定(CIN)。EBV阳性胃癌中CLDN18.2表达率在70 - 84%之间(也有研究显示为26%);dMMR癌症中为20.8%;CIN亚型中因ERBB2扩增与CLDN18.2表达重叠有限,表达水平可能较低;CLDN18.2在早发性和/或弥漫型胃癌中过表达,但在GS亚型中,CDH1突变很少见于CLDN18.2阳性癌症中,仅占4%。尽管有这些关联,CLDN18.2过表达的胃癌尚未形成独特分子特征,可能与启动子CpG岛的低甲基化有关。
3. 免疫微环境特征
免疫学分析显示,CLDN18.2阳性胃癌中自然杀伤细胞减少,中性粒细胞增加,提示免疫抑制微环境。多重IHC分析显示,在不表达免疫检查点的CLDN18.2阳性肿瘤中,CD8 T淋巴细胞比例较高,表明这些癌症可能具有“冷”免疫表型[7]。
4. 不同地区研究中的表达差异
在韩国对367名GC患者研究中[8],CLDN18.2阳性表达率为74.4%和29.4%,呈中度至重度染色,在弥漫型胃癌和HER2阳性肿瘤患者中更高,但与生存无显著相关性。在日本研究中[9],87%的原发肿瘤和80%的淋巴结转移病例中CLDN18.2呈阳性,原发胃肿瘤中有52%和淋巴结转移中有45%表现出中到强的CLDN18.2表达,Lauren弥漫亚型和高级别肿瘤中CLDN18.2表达更高。全球范围内,CLDN18.2表达在不同人群中存在显著差异。
(二)CLDN18.2判读的挑战
针对CLDN18.2的治疗策略包括高效低毒的单克隆抗体、双特异性和三特异性抗体、抗体药物偶联物(ADCs)甚至CAR - T细胞疗法。不同研究用不同抗体和阳性标准评估CLDN18.2表达,SPOTLIGHT和GLOW试验中43 - 14A抗体识别CLDN18.1和CLDN18.2的C端,EPR1902/ab22512抗体特异识别CLDN18.2,仅46.7%的样本在两种抗体分析下表现出相同的CLDN18.2表达水平,且EPR1902/ab22512灵敏度较低[10]。
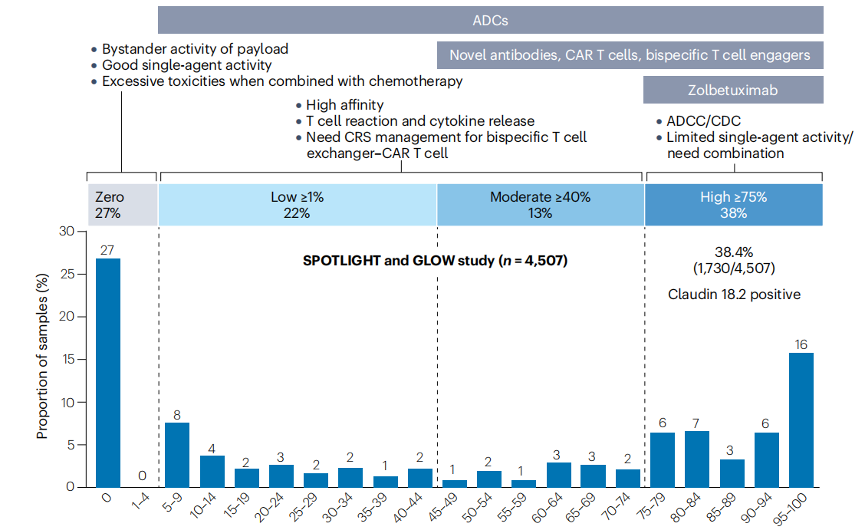
药物敏感性与Claudin 18.2表达强度
既往我院做过以下研究:采用泛CLDN18抗体(克隆43 - 14A和克隆MM02)和CLDN18.2特异性抗体(克隆EPR19202 - 244),通过IHC对66份胃腺癌样本中CLDN18.2表达评估,并用qPCR和CLDN18.1特异性抗体进一步验证结果[11]。通过43 - 14A和MM02评估的CLDN18.2表达在不同标准(≥40%或≥75%的肿瘤细胞中的≥2 +膜染色强度)中表现出高度一致性,总体百分比一致性(OPA)分别为95.45%和90.91%,表明泛Claudin18抗体具有更高的敏感性和特异性,应将其用于CLDN18.2的院内检测。
1. Mathias - Machado MC, de Jesus VHF, Jácome A, et al. Claudin 18.2 as a New Biomarker in Gastric Cancer - What Should We Know?. Cancers (Basel). 2024;16(3):679.
2. S. Klempner, L. Shen, D. Liu, et al. 1017P Updated Safety and Efficacy from the Phase I Study of Givastomig, a Novel Claudin 18.2/4 - 1BB Bispecific Antibody, in Claudin 18.2 Positive Advanced Gastroesophageal Carcinoma (GEC) [J]. Annals of Oncology, 2024, 35: S689.
3. Micheal J. Overman, MD, Harshabad Singh, MBBS, MD, et al. 1532TiP TWINPEAK Phase 1/2 Study, PT886 a Bispecific Antibody Targeting Claudin 18.2 and CD47 in Combination with Chemistry and/or Pembrolizumab in Gastric/GEJ - Carcinomas or PDAC[J]. Annals of Oncology, 2024, 35: S933 - S934.
4. Yoon - Koo Kang, Manish A. Shah, Kohei Shitara, 1438P First - line zolbetuximab + chemotherapy in patients with claudin 18.2 (CLDN18.2)+, HER2−, locally advanced unresectable or metastatic gastric or gastroesophageal junction adenocarcinoma: A pooled final analysis of SPOTLIGHT + GLOW[J]. Annals of Oncology, 2024, 35: S895.
5. Jinming. Yu, Yuping. Sun, Tianshu. Liu et al. 651P Phase 1 Study of XNW27011, A Novel Claudin 18.2 ADC, in Patients with Locally Advanced and/or Met Ocal Tumors[J]. Annals of Oncology, 2024, 35: S514.
6. Park W, O'Reilly E M, Li C P, et al. 1532TiP Zolbetuximab with gemcitabine + nab - paclitaxel (GN) in first - line treatment of Claudin 18.2–positive metastatic pancreatic cancer (mPC): Phase II, open - label, randomized study[J]. Annals of Oncology, 2024, 35: S934.
7. Nakayama I, Qi C, "br" Chen Y, Nakamura Y, Shen L, Shitara K. Claudin 18.2 as a novel therapeutic target. Nat Rev Clin Oncol. 2024;21(5):354 - 369.
8. Baek JH, Park DJ, Kim GY, et al. Clinical Implications of Claudin18.2 Expression in Patients With Gastric Cancer. Anticancer Res. 2019;39(12):6973 - 6979.
9. Rohde C, Yamaguchi R, Mukhina S, Sahin U, Itoh K, Türeci Ö. Comparison of Claudin 18.2 expression in primary tumors and lymph node metastases in Japanese patients with gastric adenocarcinoma. Jpn J Clin Oncol. 2023;49(9):870 - 876.
10. Shitara K, Xu R H, Moran D M, et al. Global prevalence of CLDN18.2 in patients with locally advanced (LA) unresectable or metastatic gastric or gastroesophageal junction (mG/GEJ) adenocarcinoma: Biomarker analysis of two zolbetuximab phase 3 studies (SPOTLIGHT and GLOW) J. Clin. Oncol. 2023;41:4036.
11. S. Ni, W. Sheng, W. Su, et al. 159P Better performance of pan - claudin18 antibodies on claudin18.2 detection in gastric adenocarcinoma than claudin18.2 specific antibody[J]. Annals of Oncology, 2023, 34: S244 - S245.
排版编辑:栗子











 苏公网安备32059002004080号
苏公网安备32059002004080号


