2024年7月25日,美国FDA(食品药品监督管理局)召开了一场ODAC(肿瘤药物咨询委员会)会议,讨论阿斯利康提交的度伐利尤单抗作为围术期治疗在可切除、不伴EGFR突变或ALK重排的非小细胞肺癌(NSCLC)成人患者的补充生物制剂许可申请。召开此次会议的原因为FDA对关键性Ⅲ期研究AEGEAN的试验设计方案有质疑——双臂设计无法区分度伐利尤单抗在术前和术后的疗效贡献。并对“FDA是否应要求未来进行的可切除NSCLC围术期临床试验的新设计方案中纳入对不同治疗阶段贡献的充分评估”进行投票。最终,专家组以11票赞同、0票反对的结果通过了该决议。
2024年8月20日晚7:30,中国医学科学院肿瘤医院GCP中心发起的临床研究大查房·监管科学系列之“FDA创新药物审评原则深度解析”第四期开播。本期会议由中国医学科学院肿瘤医院副院长李宁教授主持,中国医学科学院肿瘤医院GCP中心研究医生江宁博士介绍背景,清华大学医院管理研究院卫生经济学专家陈怡教授、中国医学科学院肿瘤医院胸外科副主任谭锋维教授、阿斯利康全球研发(中国)中心肺癌疾病领域总监丰盛梅女士和中国医学科学院肿瘤医院GCP中心统计师黄慧瑶教授参与讨论,对该期ODAC会议内容进行了复盘与深度解析。
讨论问题
讨论1:如何看AEGEAN研究的阳性结果?
谭锋维教授:以AEGEAN、CheckMate 816、Impower 010、KEYNOTE-671等为代表的研究将免疫治疗加入可切除NSCLC的围手术期治疗,带来了优于传统的治疗模式,同时也带来了一些值得探索的问题:第一,直接手术就能达到很好的根治效果的患者,是否有必要行新辅助治疗?第二,部分患者在新辅助治疗后因疾病进展或不良反应失去手术机会,如何评估失去手术机会对患者造成的影响?第三,免疫治疗相关不良反应如何早期预测及管理?第四,新辅助免疫治疗后已经达到病理完全缓解(pCR),是否还有必要做辅助免疫治疗?AEGEAN等一系列研究当然是成功的,但我们不能要求在一个研究中解决所有的问题,研究设计的优化有待未来继续努力。
丰盛梅女士:AEGEAN研究pCR和无事件生存(EFS)双终点的改善具有临床和统计学的双重意义,度伐利尤单抗在ODAC会议后很快获FDA批准围术期适应证,而能够获得监管的批准是一个临床试验成功的最终目标。
讨论2:帕博利珠单抗(俗称K药)凭借KEYNOTE-671研究顺利获批,同样设计相似结果的AEGEAN研究却被FDA质疑其试验设计,并要求AEGEAN之后开展的研究都应该在研究设计方案中纳入对治疗阶段贡献的评估,如何看待FDA的意见?
谭锋维教授:KEYNOTE-671顺利通过,AEGEAN被质疑,我认为这是一个时机的问题,因为度伐利尤单抗提交上市申请是在帕博利珠单抗获批之后。但AEGEAN同KEYNOTE-671一样,有非常严谨的统计设计,也同样证明了围手术期免疫治疗相较于传统方案的优势,虽然术前和术后两个阶段的治疗贡献未明确,但这一新的治疗模式确实给一部分患者带来了获益,FDA不批对患者是不公平的。
陈怡教授:从卫生经济学的角度,新药新技术医疗费用的增加对美国的医保支付造成了很大的压力,这份支付压力也影响了FDA的审批。医保的支付意愿与治疗的临床价值密切相关:临床获益大、能够填补治疗空白的新药,医保的支付意愿就高;锦上添花的药物,医保的支付意愿就低。在这个肿瘤新药研发同质化竞争激烈的时代,药企不能一味拼速度,建议在研发的早期就考虑后续的医保支付意愿,征询卫生经济学家的意见,否则有可能造成药物研发成功却被医保拒之门外,欲速则不达。因为药监的获批并不意味着医保一定会纳入,药监更关注的是药物的安全性和有效性,医保更关注的是临床获益和经济性。
黄慧瑶教授:FDA在AEGEAN研究之后,要求将来的可切除NSCLC围手术期研究都应该分阶段评估新辅助和辅助治疗的贡献,我认为FDA做这一决策是公平且谨慎的。其实2018年AEGEAN研究开展之前FDA就从科学性的角度提出了分阶段评估的建议,但并非强制,因为分阶段评估的研究设计会大大增加申办方的研发投入,强制要求会打击企业的研发热情。2024年6月BR.31研究结果出炉,FDA看到度伐利尤单抗辅助治疗并未给患者带来疗效获益并引发更多的安全性风险,且2023年10月帕博利珠单抗已获批NSCLC围手术期适应证,治疗需求得到一定的满足,考虑到辅助治疗有过度治疗之虞,FDA对未来的研究设计方案提出了分阶段评估疗效的要求,这是在现有有效治疗手段基础上对于未来研究方案进一步优化的思路,体现了监管的责任,因为监管的审批原则就是为患者提供更安全、更有效、更可负担的治疗方案。
李宁教授:FDA的审批以是否满足临床需求为前提,帕博利珠单抗凭KEYNOTE-671顺利获批,因为当时可切除NSCLC的术前+术后围术期免疫治疗是空白,帕博利珠单抗获批之后,度伐利尤单抗提交上市申请就不再是满足未满足的临床需求,可能就会被质疑。
讨论3:此次ODAC会议上,FDA对未来的可切除NSCLC围术期研究设计拟了一个指导意见和方法,提出了三臂和四臂设计,这种建议方案如何评价?
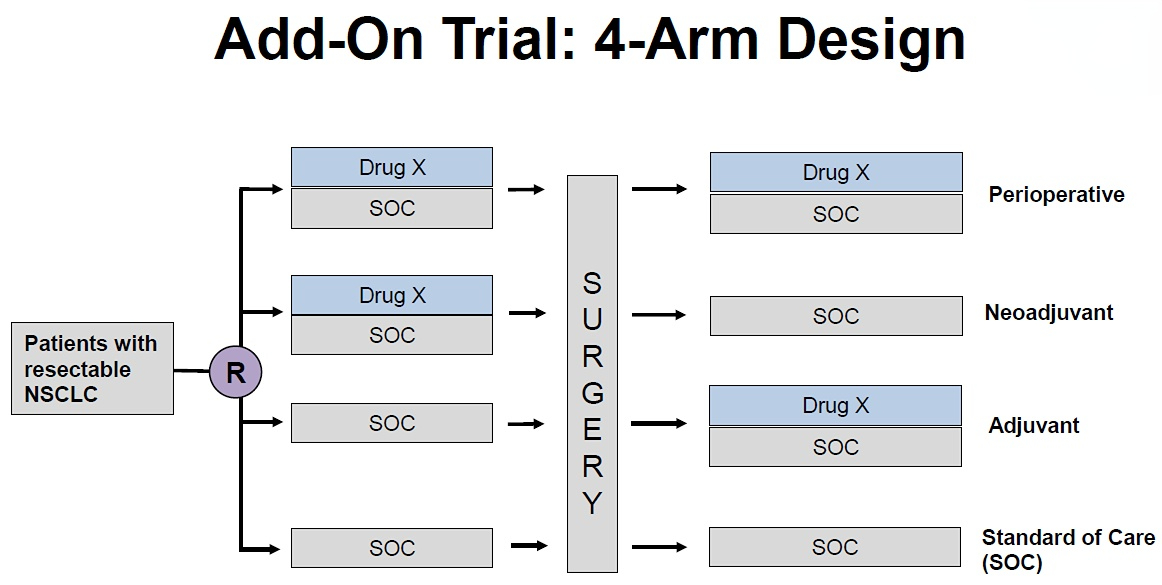
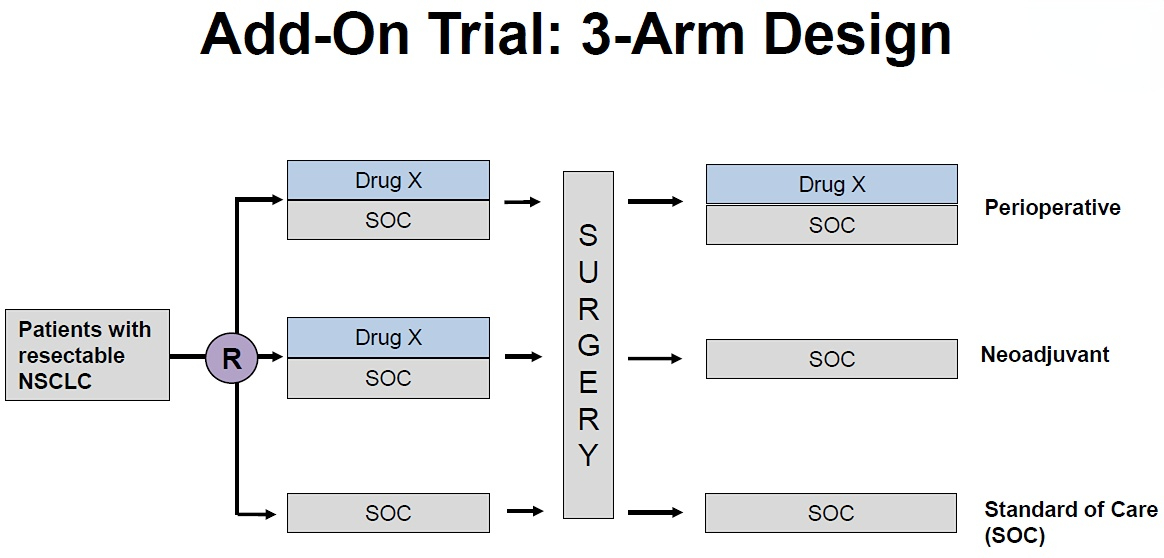
黄慧瑶教授:FDA建议的三臂和四臂设计中,都是要求试验组与标准治疗(SOC)组之间做统计学对比,不要求试验组间对比。诚然,如果要求试验组间对比就能更好地回答是手术前后都用新药更好还是仅单阶段用新药更好,但这样的统计学假设算出来的样本量会非常大,FDA会担心打击申办方在NSCLC围手术期适应证药物开发的积极性。
李宁教授:临床研究中,科学性、伦理性和可行性三者要平衡,纯科学纯正义的东西在现实世界中是很难存在的。
丰盛梅女士:FDA在NSCLC已有围手术期免疫治疗获批的现阶段,对未来的研究方案提出了更高的要求,以期未来的治疗方案更有效、更安全、更经济,这是一个在恰当时机做的明智决策,这一决策对于其他肿瘤的围手术期研究也有借鉴意义。未来,对于可切除NSCLC围手术期治疗的研究设计,我们阿斯利康一定会遵循FDA至少设三个臂的监管要求,为患者开发更好的治疗方案。
李宁教授:FDA在这一时间节点召开ODAC会议,提出将不同的治疗阶段进行析因设计,代表了肿瘤用药越来越精准的研究方向。
背景介绍
AEGEAN研究设计和结果
AEGEAN是一项双臂、随机、双盲、安慰剂对照的全球多中心Ⅲ期临床试验,802例未发现EGFR或ALK突变的ⅡA~ⅢB(N2)可切除NSCLC患者按1∶1随机分配,手术前接受4个周期的新辅助度伐利尤单抗+含铂化疗,手术后接受1年的度伐利尤单抗单药辅助治疗(度伐利尤单抗组),或仅接受新辅助化疗和手术(安慰剂组)。研究设置了双主要终点:病理完全缓解(pCR)和无事件生存期(EFS)。关键的次要终点包括主要病理学缓解(MPR)、无病生存期(DFS)和总生存期(OS)。
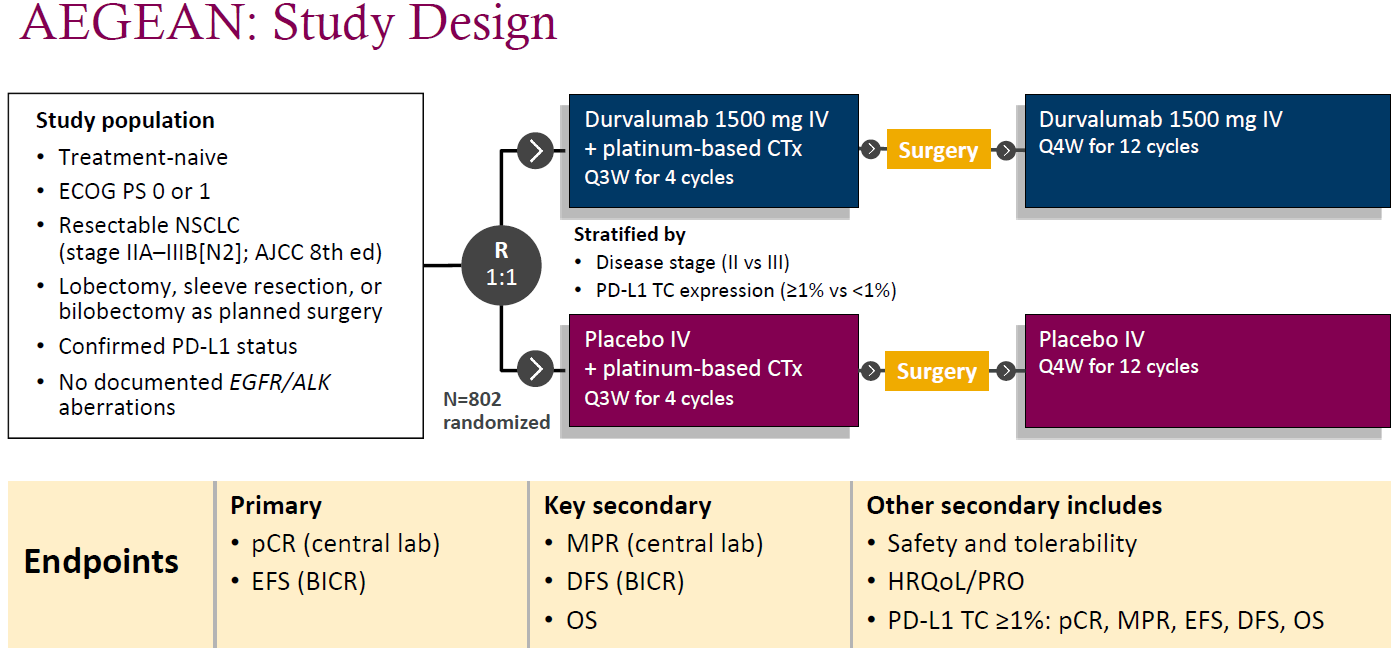
图1.AEGEAN研究设计
研究显示,两个主要终点pCR和EFS均达到:度伐利尤单抗组(N=366)和安慰剂组(N=374)的pCR率分别为17.2%和4.3%(P<0.001),中位EFS分别为未达到(NR)和25.9个月(HR=0.68,P=0.0039)(见图2)。DFS有改善趋势但未达统计学显著性(HR=0.66,P=0.0137,未达到预设的0.0123的界值);OS数据显示度伐利尤单抗组有获益趋势(中位OS分别为未达到和53.2个月;HR=0.66)。
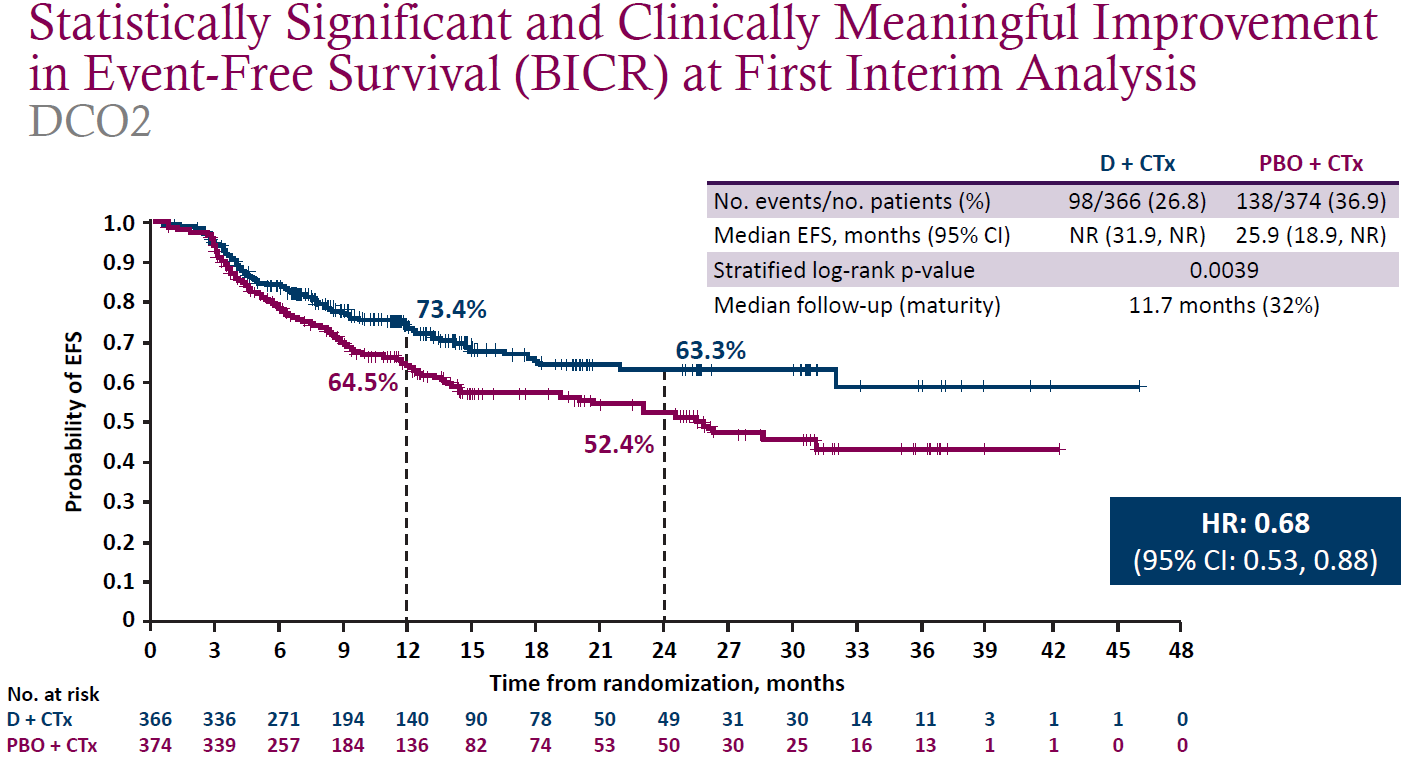
图2.EFS的第一次中期分析结果
FDA承认,AEGEAN研究达到了pCR和EFS双主要研究终点,OS亦未显示围手术期使用度伐利尤单抗有害,但FDA指出,AEGEAN的双臂研究设计无法判断患者是否在新辅助和辅助这两个治疗阶段都受益于度伐利尤单抗。已有越来越多的证据表明了免疫检查点抑制剂在术前使用的益处,但术后使用度伐利尤单抗可能会使患者面临严重的副作用和经济负担,且可能没有临床获益。
讨论问题:鉴于在新辅助和辅助这两个阶段都需要度伐利尤单抗存在不确定性,讨论在度伐利尤单抗围手术期方案获批前是否需进行额外的研究以判断该药在新辅助和辅助这两个不同治疗阶段的获益贡献。
投票问题:对于未来进行的可切除NSCLC围手术期临床试验,FDA是否应该要求新的试验设计方案中纳入对不同治疗阶段贡献的充分评估?
ODAC后续
2024年8月15日,FDA批准度伐利尤单抗联合含铂化疗作为新辅助治疗,随后单药度伐利尤单抗作为可切除(肿瘤≥4 cm和/或淋巴结阳性)NSCLC且无已知EGFR突变或ALK重排成人患者的术后辅助治疗。
排版编辑:研值圈-Shelley











 苏公网安备32059002004080号
苏公网安备32059002004080号


