长期以来,癌症一直根据其解剖起源和定位进行分类和治疗,其中Vater壶腹癌属于罕见恶性肿瘤,约占胃肠道恶性肿瘤的0.2%。晚期壶腹癌预后差,缺乏有效治疗手段,5年生存率仅约4%[1]。然而,随着临床肿瘤基因组测序分析的发展,参与肿瘤发生和进展的基因组驱动改变逐步得到明确解析,使很多罕见肿瘤可以根据基因改变的特点进行个性化治疗。本文报道了1例在解放军第901医院确诊为广泛转移性Vater壶腹腺癌的老年女性患者,伴神经营养受体酪氨酸激酶(Neurotrophic Receptor Tyrosine Kinase,NTRK)1基因扩增,并接受了拉罗替尼的靶向治疗。据我们所知,这是第1例NTRK1基因扩增壶腹癌患者接受拉罗替尼治疗的病例,现报道如下:
1. 病例资料
患者女性,80岁,因“腹痛半年伴双下肢无力1月”于2024年6月14日就诊于解放军第901医院。病程中患者无明显诱因出现持续性腰背部疼痛,进行性加重,伴乏力,并于1月前开始出现双下肢无力,1周前出现排尿障碍,大便未见异常,无发热、恶心呕吐、腹泻、黑便等不适。既往高血压病史30余年,冠心病病史20余年,否认结核、肝炎病史,否认家族遗传病史。查体:体温37.1℃,脉搏92次/min,呼吸20次/min,血压150/85mmHg,皮肤巩膜无黄染,右侧上腹部压痛(+),腰部叩击痛(+),双侧下肢中枢性瘫痪。实验室检查:肝功提示丙氨酸转氨酶17.1 U/L、天冬氨酸转氨酶84 U/L、总胆红素 11.6 μmol/L。肿瘤标志物:糖链抗原(CA)153:40.5U/ml,CA199:873.09U/ml,癌胚抗原(CEA):5.69ng/ml,甲胎蛋白、神经元特异性烯醇化酶、鳞状细胞癌抗原水平正常,凝血检查:D-二聚体 5.88ng/ml。完善影像学检查,全腹部CT平扫+三期增强示:1. 十二指肠降部内侧、胰腺钩突区见多发团块状异常密度影,病变似呈融合状,大小约50mm×34mm,考虑为恶性病变。2. 肝脏右叶巨大占位(105mm×77mm)、右侧肾上腺占位(45mm×40mm)、腹膜后多发肿大淋巴结——均考虑为转移性病变。 3. T11-L1椎体及附件、右侧第11、12助骨见溶骨性骨质破坏并形成软组织肿块,肿块大小约为67mm×61mm,病变累及椎管,相应椎管内结构显示欠清。4. 两侧胸腔积液。2024年6月17日予以唑来膦酸+椎体转移瘤适形放疗抑制骨质破坏并止痛。同步行腰椎旁占位组织穿刺活检,病理示:腺癌,倾向肝外胆管/壶腹部来源,免疫组化:Villin (+),IDH1 (-),HER-2 (-),Hepatocyte (-),Glypican-3 (-), СК7 (+), СK20 (-), СD56 (-), Sуn (-),Іnhіbіn-a (-),Melan-A (-),CgA (-),PD-L1:TPS <1%,CPS 1。穿刺标本行二代基因测序,6月28日结果回报示:NTRK1基因扩增(拷贝数 5.0),伴MUTYH Y453C、GEN1 G432E、ALK Q459E错义突变,微卫星稳定型(MSS)。该患者最终诊断:壶腹腺癌(cT4N2M1 IV期 NTRK1扩增)。
2024年7月2日患者病情进展出现进食梗阻伴发热、意识模糊,予以空肠营养管置入后行积极肠内营养支持及抗感染等对症治疗,此时美国东部肿瘤协作体力评价 (Eastern Cooperative Oncology Group, ECOG) 评分PS 4,患者已至终末期,无化疗指征。经患者家属知情同意后,患者开始予以拉罗替尼进行治疗(100mg 溶解后空肠营养管注入 2次/日)。1周后,患者意识逐渐清醒,梗阻缓解,恢复进食。治疗期间出现头晕不良反应,患者家属自行 停药1周后减量至50mg 2次/日,患者头晕症状缓解。至2024年8月6日复查,CA199降至245.45U/ml,CA153降至26.4U/ml。根据实体肿瘤临床疗效评价指标(RECIST1.1),腹膜后淋巴结和右侧肾上腺的两个转移瘤以及肝右叶的转移瘤被视为肿瘤评估的靶病灶,基线时靶病灶长径总和为186.2mm(图1 A~C),1周期治疗后未见新发病灶,靶病灶长径总和降至160.7mm(图1E~G),尚未达到部分缓解(PR)标准,疗效评价为疾病稳定(SD)。同时可见壶腹部原发病灶治疗前局部肿胀结构模糊不清(图1D),治疗后病灶明显退缩,肠腔结构恢复清晰(图1H)。双侧胸腔积液仍然存在,患者ECOG体能状态改善至2,体重增加3公斤。
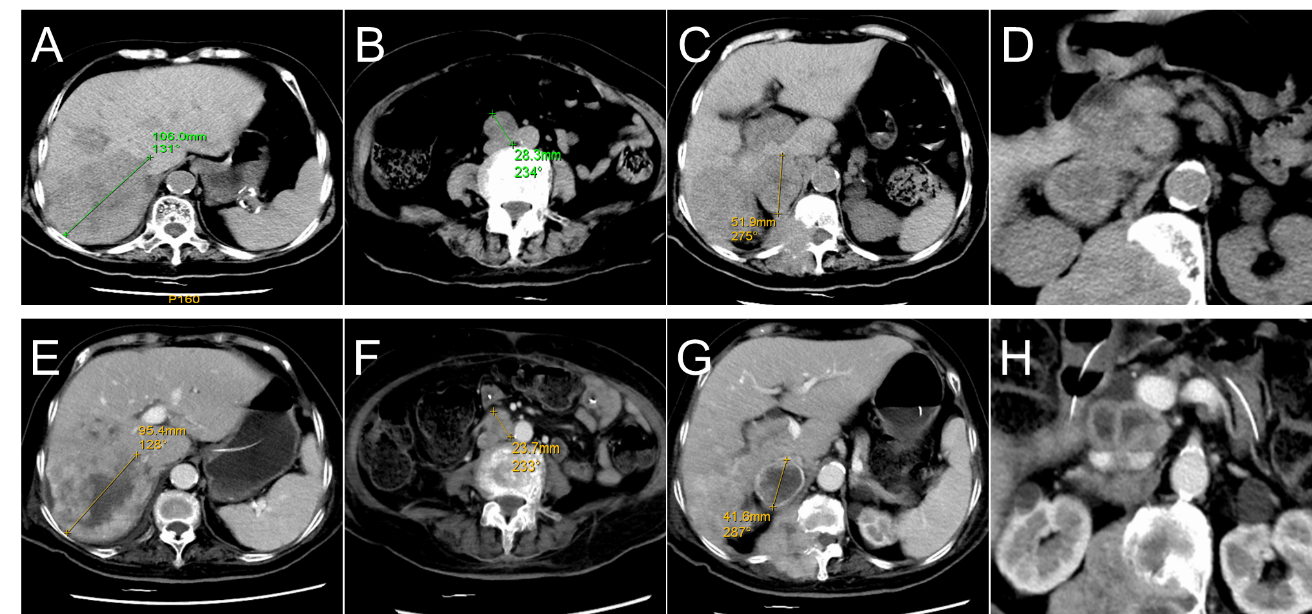
图1. A~D治疗前腹部原发灶和多发转移灶CT基线影像(2024年6月26日); E~H拉罗替尼治疗后复查,原发病灶退缩,肾上腺、腹膜后淋巴结和肝脏多发转移性病灶轻度退缩(2024 年8月6日)
2. 讨论
Vater区的壶腹在解剖上是肠、胰管和胆总管在十二指肠壁上的交汇处,它们在此狭窄区域扩张成壶腹状,解剖结构非常复杂,因1720年由Vater首次描述,故称为“Vater壶腹”[2]。非转移性壶腹癌可行根治性肿瘤切除+区域淋巴结清扫术,预后好于临近区域的胰腺癌,5年生存率在41%至45%之间,但只有约50%的壶腹癌患者有机会接受手术治疗[3]。对于已经无法根治的晚期患者,因壶腹癌的罕见性,目前还没有专门针对壶腹癌的临床试验,相关的指南和专家共识主要建议根据体力状况采用姑息化疗或营养支持治疗来减轻痛苦,同时也推荐可以根据其分子病理学的特点进行个体化的治疗[4]。
NTRK基因融合是已知致癌和转化潜能最重要的分子变化之一,基因融合导致TRK融合蛋白产生,这些融合蛋白的激酶结构域配体独立活化,将会激活MAPK和PI3K信号通路并驱使肿瘤增殖、存活、侵袭和血管生成[5]。因此,NTRK基因融合突变可作为肿瘤治疗的特异性靶点,并且已经开发了几种泛瘤种NTRK抑制剂,包括拉罗替尼及恩曲替尼等。他们分别于2018年11月和2019年8月获美国食品药品监督管理局(FDA)批准上市,并于2022年4月和2022年7月获中国国家药品监督管理局(NMPA)附条件批准上市。然而,对于NTRK基因扩增目前的研究还相对较少,具有这一分子病理学特点的恶性肿瘤是否能得到有效靶向治疗的相关知识也很匮乏。尽管在 NTRK 基因融合中,拉罗替尼和恩曲替尼的活性已经确定,但它们在NTRK 扩增中的作用尚不清楚[6]。
复习文献,迄今为止只有2例NTRK1基因扩增患者有成功靶向治疗的记录。2019年在美国的一项多中心开放标签的I期临床研究中,入组的70名实体瘤患者中有1例患者存在NTRK1基因扩增,使用拉罗替尼后,该患者的单个靶病灶从基线的11mm缩小至治疗后5mm,疗效达到PR,维持时间为3.7个月[7]。另1例由德国学者在2020年报道,该晚期食管鳞癌患者在后线治疗的检测中发现存在NTRK1基因扩增,使用拉罗替尼后,疗效同样达到PR,无进展生存(PFS)3.5个月,并且该例患者还在耐药后进一步明确其耐药原因为出现MET扩增[8]。基于此,美国M.D. Anderson中心于2021年开展了一项应用拉罗替尼治疗NTRK扩增晚期实体瘤的II期临床研究[9],该研究初步结果揭盲时间预计在2025年11月,但考虑到入组患者的困难性,该研究最终的纳入人群是否能达到预期人数仍存疑。
笔者参编了发布于2022年11月的中国首部《中国实体瘤NTRK融合基因临床诊疗专家共识》,该共识详细的给予了NTRK基因融合实体瘤在国内的诊疗路线,但通篇并未涉及NTRK扩增的任何内容[10]。回溯文献可知,NTRK扩增在中国实体瘤人群中的发生率约为0.8%,且几乎都发生在NTRK1基因(92%),其次是NTRK3(7%)和NTRK2(1%)。具体到不同的瘤种,其发生扩增的频率由高到低分别为肝细胞性肝癌(3.1%)、软组织肉瘤(2.1%)、肝内胆管细胞癌(1.4%)、胃癌(0.5%)和非小细胞肺癌(0.2%)[11]。但遗憾的是,文献中没有发现相关的靶向治疗数据或案例,仅有1篇文献涉及NTRK扩增胃癌的临床病理特征分析[12]。因此,本例晚期壶腹癌患者是目前所知的国内第1例应用拉罗替尼治疗的NTRK1扩增实体瘤患者。从治疗过程中可以看到,患者治疗前已经进入临床终末期,意识模糊伴进食梗阻,但是经过尝试性的精准靶向治疗,短期内症状迅速改善,意识恢复清醒,体重有所增加,肿瘤靶病灶也有明显的缩小坏死,这些都表明拉罗替尼对NTRK1扩增的壶腹癌患者有明确的抗肿瘤活性。后续我们将继续随访观察疗效,评估其PFS是否能超过欧美同类患者约3.5个月的有效时间。
综上所述,本病例报道了国内第1例应用拉罗替尼一线治疗广泛转移性NTRK1基因扩增壶腹癌患者的短期疗效,展示了拉罗替尼对NTRK1扩增实体瘤患者具备一定的抗癌活性。后续将继续复查随访,进一步观测后续可能的获得性耐药,并研究其抵抗机制。本文的研究结果可能对该类型壶腹癌患者的治疗提供一些启示。
参考文献
[1] John, D.H. Bekaii-Saab T., Ampullary Cancer: An Overview [J]. American Society of Clinical Oncology Educational Book, 2014. 34(1): 112-115.
[2] Pea A, Riva G, Bernasconi R, et al. Ampulla of Vater carcinoma: molecular landscape and clinical implications [J]. World J Gastrointest Oncol. 2018;10(11): 370-380.
[3] Walter D, Schnitzbauer AA, Schulze F, et al. The Diagnosis and Treatment of Ampullary Carcinoma [J]. Dtsch Arztebl Int. 2023;120(43): 729-735.
[4] Shin DW. Treatment of Ampullary Adenocarcinoma [J]. Korean J Gastroenterol. 2023;82(4): 159-170.
[5] O'Haire S, Franchini F, Kang YJ, et al. Systematic review of NTRK 1/2/3 fusion prevalence pan-cancer and across solid tumours [J]. Sci Rep. 2023;13(1): 4116.
[6] Berger S, Martens UM, Bochum S. Larotrectinib (LOXO‐101). Recent Results Cancer Res. 2018;211: 141-151.
[7] Hong D S, Bauer T M, Lee J J, et al. Larotrectinib in adult patients with solid tumors: a multi-centre, open-label, phase I dose-escalation study [J]. Annals of oncology: official journal of the European Society for Medical Oncology, 2019, 30(2): 325-331.
[8] Hempel D, Wieland T, Solfrank B, et al. Antitumor Activity of Larotrectinib in Esophageal Carcinoma with NTRK Gene Amplification. Oncologist;25(6): e881-e886.
[9] https://clinicaltrials.gov/study/NCT04879121.
[10] Xu C, Si L, Wang W, et al. Expert consensus on the diagnosis and treatment of NTRK gene fusion solid tumors in China[J]. Thorac Cancer. 2022 Nov;13(21):3084-3097.
[11] Xu Y, Shi X, Wang W, et al. Prevalence and clinico-genomic characteristics of patients with TRK fusion cancer in China. NPJ Precis Oncol. 2023;7(1): 75.
[12] 许安迪, 付尧, 濮晓红, 等. NTRK重排/扩增胃癌4例临床病理学特征 [J] . 中华病理学杂志, 2023, 52(5) : 454-459.
中国人民解放军联勤保障部队第九O一医院肿瘤一科主任
第三军医大学西南癌症中心/全军病理学研究所/教育部肿瘤免疫重点实验室肿瘤学博士,师从卞修武院士
中国抗癌协会肝脏肿瘤康复委员会常务委员
中华医学会安徽省肿瘤学分会委员/肿瘤内科分会委员
安徽省放疗学会肺癌学组委员
援非医疗专家组组长
第一/通讯作者SCI论文16篇,研究成果入选ESI全球前1%高被引论文。主持省部级科学基金3项。副主编专著1部。参编国家级肿瘤专业诊疗问题专家共识7部。第一完成人获安徽省科技进步三等奖1项
排版编辑:Linda











 苏公网安备32059002004080号
苏公网安备32059002004080号


